MER 型沸石的结构、合成及应用进展
2020-11-16王建强张富民
石 勤,王建强,席 静,张富民
(兰州石化职业技术学院 应用化学工程学院,甘肃 兰州 730060)
沸石是一种无机多孔材料,由于它具有规则的孔道结构、较大的比表面积、优异的水热稳定性、丰富的酸性中心以及多种阳离子交换等性质,在工业催化、吸附分离和离子交换等工业领域具有重要地位。MER 型沸石是一种三维八元环小孔沸石,它的拓扑结构包括天然相钡十字沸石和合成相沸石W,沸石W 在1953 年被首次合成,24 年后(1977年)天然相钡十字沸石在意大利列蒂被发现[1-3]。天然相钡十字沸石储量有限,主要分布在意大利、德国、冰岛、法国、美国和俄罗斯等地的山区和海洋中,且往往与丝光沸石、钙十字沸石、毛沸石、方沸石及菱沸石等共生。随着工业化进程的加快,MER 型沸石凭借特殊的孔道结构,在海水卤水提钾、工业催化、气体吸附分离以及工业脱水等领域显示出潜在的工业应用前景。因此,人工合成具有MER 型拓扑结构的沸石W 受到越来越多的关注。
本文对MER 型沸石的结构、合成及应用进行了综述和展望,为MER 型沸石的进一步研究、推广和应用提供了参考。
1 MER 型沸石的结构
沸石的独特拓扑结构决定了它在工业应用中的性能,深入认识沸石的结构对其工业应用具有重大指导意义。MER 型沸石的结构[1-2]如图1 所示。由图1 可见,沿着z轴方向有两种八元环通道交替排列,一种八元环通道由d8R 笼和pau 笼共享八角平面连接构成(图1b),另一种八元环通道由ste 笼连接构成(图1c);沿着x轴和y轴方向,pau 笼和ste 笼共享弯曲八元环,各自连接形成八元环通道(图1a)。
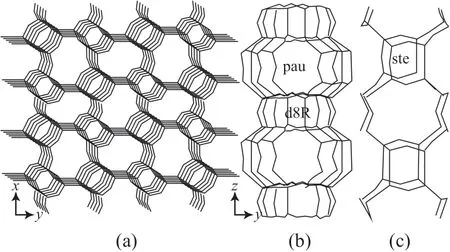
图1 MER 型沸石的结构[1-2]Fig.1 The structure of MER-type zeolite[1-2].
MER 型沸石的晶胞空间群有Immm、Pnnm 和P42/nmc 三种,其中Immm 占主导地位,沸石晶胞空间群与其骨架硅铝比(骨架外阳离子数目)、孔道中的阳离子类型和含水量等有关[1-6]。Pakhomova等[1]采用单晶X 射线衍射法研究了温度变化对天然钡十字沸石晶胞结构的影响。在室温下,晶胞的空间群为Immm,晶胞参数a=(1.403 12±5)nm,b=(1.426 75±6)nm,c=(1.008 74±4)nm,晶胞体积V=(2.019 40±14)nm3;温度升高至75 ℃时,晶胞的空间群转变为P42/nmc,继续升温至200 ℃,沸石完全脱水;继续升温,晶胞空间群保持不变,在225 ℃下,晶胞参数a=(1.334 1±4)nm,b=(1.334 1±4)nm,c=(0.970 7±4)nm,V=(1.727 7±12)nm3,升温脱水会引发沸石骨架变形和晶胞体积减小,骨架结构的对称性下降,骨架外的阳离子位置也随之变化。Georgieva 等[6]合成了沸石W,发现沸石骨架外阳离子为K+和Cs+时,晶胞空间群为P42/nmc;骨架外阳离子为Na+时,晶胞空间群为Immm。
MER 型沸石是一种低硅铝比沸石,骨架原子Al 的位置分布具有统计性[7]。石勤等[8]通过密度泛函理论计算得到沸石骨架最小硅铝比为1.67,目前报道的自然界和合成的MER 型沸石骨架硅铝比的范围为1.67 ~3.80[1-6]。MER 型沸石骨架外阳离子主要为K+[1-6],其他阳离子的MER 型沸石由离子交换实验得到。大量研究结果表明,沸石骨架外阳离子的种类、位置及数目对沸石在不同工业领域的应用具有很大影响。MER 型沸石骨架外阳离子的位置分布如图2 所示。从图2 可看出,MER型沸石骨架外阳离子的位置[1-6,8]大致为三种:第一种位于pau 笼和d8R 笼共享的八角平面附近(图2 中的Ⅰ或Ⅰa);第二种位于pau 笼和ste 笼共享的弯曲八元环中(图2 中的Ⅱa 或Ⅱb);第三种位于ste 笼的弯曲八元环中(图2 中的Ⅲ)。在三种位置中,K+在Ⅱa 和Ⅱb 位置出现的概率最大,其次是Ⅰ和Ⅰa 位,落位概率最小的是Ⅲ位。
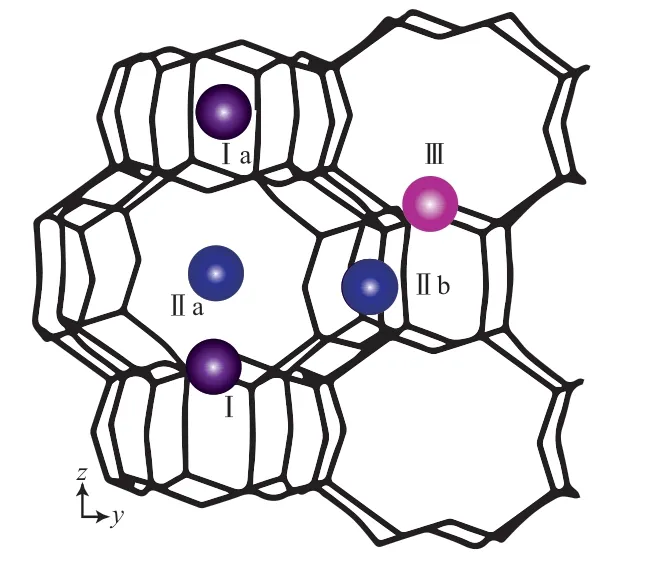
图2 MER 型沸石骨架外阳离子的位置分布Fig.2 The position distribution of extra-framework cations in MER-type zeolite.
综上所述,MER 型沸石骨架外阳离子主要位于八元环孔道中,阳离子与八元环骨架原子之间的距离决定了沸石中分子扩散的通道,了解通道孔径的大小对在工业应用中筛选、调控沸石以及理解它的工作机理具有指导作用。石勤等[8]采用分子动力学模拟方法计算了骨架外K+与八元环骨架原子之间的径向分布函数,结果如图3 所示。从图3可看出,骨架外K+与其所处八元环骨架原子O,Al,Si 的距离分别为0.271,0.329,0.353 nm,与文献[9]报道的MER 型沸石窗口孔径大小一致,沿着(001)方向形成的八元环窗口直径分别为0.33 nm×0.33 nm 和0.34 nm×0.51 nm, 沿着(100)和(010)方向形成的八元环窗口直径分别为0.31 nm×0.35 nm 和0.27 nm×0.36 nm。
2 MER 型沸石的合成
2.1 原料及胶体组成
目前,合成沸石W 的胶体主要包含化学原料组成为K2O-SiO2-Al2O3-H2O 和Na2O-K2O-SiO2-Al2O3-H2O 的胶体、硅铝酸盐离子液体、含钾岩石熔解后的胶体及粉煤灰为原料熔解后的胶体共五种体系。胶体中较高的K+含量是合成沸石W 的关键因素,这是因为水合K+在沸石W 的合成过程中起到了模板剂的作用,具有稳定沸石W 骨架结构的功能。石勤等[10]采用分子动力学方法模拟了MER 型沸石骨架外水合阳离子的微观结构,发现水合K+在MER 型沸石通道中非常有序,而水合Na+则杂乱无序,也从侧面证明了上述观点。
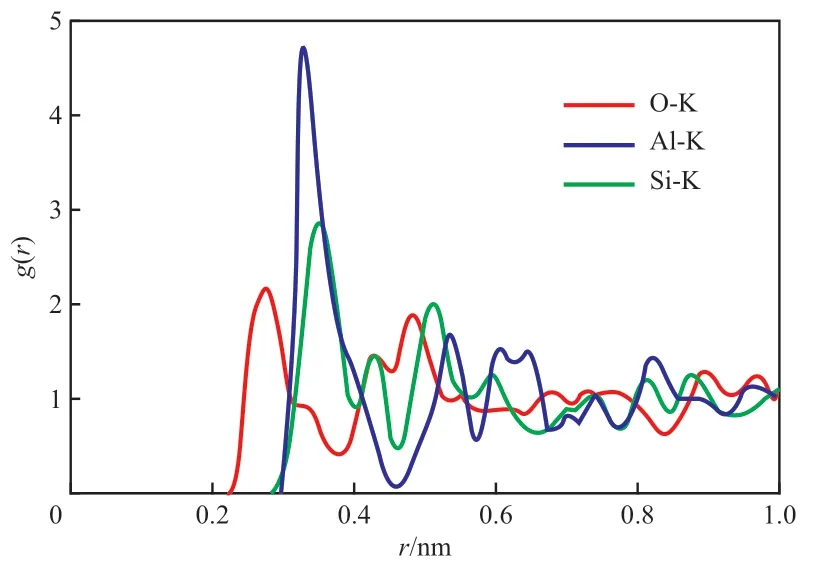
图3 MER 型沸石骨架原子与骨架外K+之间的径向分布函数[8]Fig.3 Radial distribution function between the framework atoms and extra-framework K+ of MER-type zeolite[8].
利用K2O-SiO2-Al2O3-H2O 胶体合成沸石W是研究最多的体系。Skofteland 等[2]采用不同K+来源的胶体水热合成了沸石W,发现胶体中的K+和OH-含量是控制晶体结构的主要参数,合成沸石W 的最佳胶体组成为n(K2O)∶n(SiO2)∶n(Al2O3)∶n(H2O)=7.5∶5∶1∶600(KOH 为K+源)和n(K2O)∶n(SiO2)∶n(Al2O3)∶n(KNO3)∶n(H2O)=2.5∶5∶1∶11∶600(KOH 和KNO3为K+源)。Maghsoodloorad 等[11-12]在胶体组成为n(K2O)∶n(SiO2)∶n(Al2O3)∶n(H2O)=5.6∶6.4∶1∶164.6 时合成了高纯度的沸石W,发现过量的K2O/SiO2摩尔比是合成沸石W 的关键,调整K2O/SiO2摩尔比在0.7 ~1.0 之间能够合成纯相沸石W。天然的和合成的MER 型沸石骨架硅铝比均较低(1.67 ~2.40),Barrett 等[4]通过在胶体中添加有机模板剂四乙铵(TEA)和KOH,在胶体组成为n(K2O)∶n(TEA+KOH)∶n(SiO2)∶n(Al2O3)∶n(H2O)=2.76∶4.4∶10∶1∶150 的条件下,合成了骨架硅铝比(3.8)较高的沸石W。
当胶体中含有Na+时,它对沸石W 的合成产生很大影响。Bieniok 等[3]通过在胶体中调节NaOH 和KOH 的添加量研究了Na2O-K2O-SiO2-Al2O3-H2O 胶体对合成沸石W 的影响,主要考察了过碱度和阳离子比值对合成沸石W 的影响。研究结果表明,过碱度在1.4 ~2.9 的范围内能够合成沸石W,随着过碱度的增加(从1.4 增至2.2),合成沸石W 的骨架硅铝比减小(从2.1 减至1.68);阳离子比值每降低0.1(从0.8 降至0.4),沸石W的结晶度下降40%。石勤[13]以硅酸钠为硅源、偏铝酸钠为铝源、氢氧化钾为矿化剂,系统地探究了含有Na+的胶体(Na+由原料引入)对合成沸石W的影响,并确定了合成沸石W 的胶体晶化区域(图4 黑色虚线及其区域内);与不含Na+的胶体晶化区域(图4 黑色实线及其区域内)[2]相比,胶体中含有Na+时,胶体晶化区域明显减小。
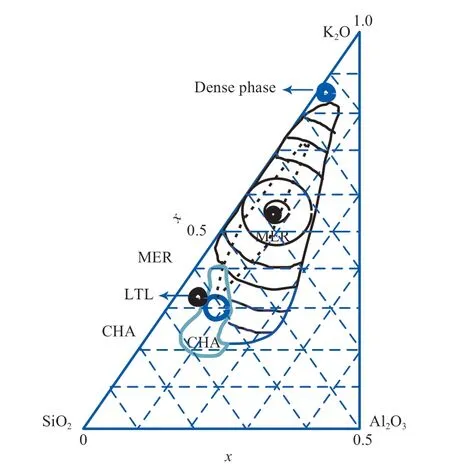
图4 含有Na+和不含Na+的胶体合成沸石W 的胶体晶化区域的比较[2,13]Fig.4 Comparison of colloidal crystallization regions of zeolite W with and without Na+[2,13].
以硅铝酸盐离子液体为原料合成沸石W 是一种新的合成策略。Haouas 等[14]首次利用硅铝酸盐离子液体合成了沸石W,发现沸石W 的合成产率随离子液体中Al 含量的增大而增加,晶粒尺寸随离子液体中Al 含量的增加从几百微米减小到纳米尺度;随H2O 含量的增加,晶粒尺寸减小。Maarten等[15]以水合硅酸盐离子液体为原料在不同温度下合成沸石W,在胶体组成为n(K2O)∶n(SiO2)∶n(Al2O3)∶n(H2O)=1∶0.5∶0.013∶8 的条件下,考察了反应温度对合成沸石的影响。研究结果表明,随着反应温度的升高,沸石W 晶体形貌变得细长。
以钾长石、海绿石及钾云母等含钾岩石为原料,采用碱熔活化法分解含钾岩石得到含K+的硅铝酸盐液体,再通过补加化学原料调整组成得到合成沸石W 的胶体,这种胶体不仅利用了含钾岩石中的钾资源,而且利用了岩石中的硅和铝,具有良好的发展前景。曹吉林课题组[16-19]提出了以KOH、KOH-K2CO3和NaOH-Na2CO3为碱熔活化介质分解含钾岩石合成沸石W 的工艺,活化物料按n(K2O)∶n(SiO2)∶n(Al2O3)∶n(H2O)=15∶10∶1∶760 调整胶体配比可合成纯相沸石W,合成后的母液可循环用于合成沸石W,也可通入CO2副产白炭黑和K2CO3。Liu 等[20]利用钾长石合成了沸石W,发现胶体陈化时间对合成沸石影响不大,沸石W 可在较宽的H2O/Al2O3摩尔比、反应温度和时间范围内合成。
粉煤灰是燃料(主要是煤)燃烧后的固体废弃物,主要成分为SiO2、Al2O3和Fe2O3等,将粉煤灰“变废为宝”用于合成沸石是目前的研究热点之一。由于不同来源的粉煤灰物化性质差异较大,合成沸石W 的方法和反应条件也不同。Medina 等[21]以墨西哥粉煤灰(MFA)为原料,采用直接法和碱熔法在n(KOH)∶n(MFA)=0.23 ~1.46、反应温度为90 ~175 ℃、反应时间为8 ~24 h 的条件下均可合成沸石W。Li 等[22]采用直接法以中国新疆粉煤灰合成了沸石W,高质量沸石W 的合成条件为KOH 溶液浓度为5 mol/L、KOH(溶液)/粉煤灰(固体)的比为2 L/kg、反应温度和反应时间分别为150 ℃和8 h。Gamero-Vega 等[23]用KOH 活化预处理粉煤灰后,在KOH/粉煤灰的质量比为0.33、n(SiO2)∶n(KOH)=1.64、n(H2O)∶n(SiO2)=17.08、n(SiO2)∶n(Al2O3)=3.90、反 应 温 度175 ℃和反应时间16 h 的条件下合成了沸石W。
2.2 合成方法
合成沸石W 的主要方法是水热合成法,此外还有干凝胶合成法、微波合成法和沸石转晶法等。水热合成法是在反应釜中利用高温高压的水热条件合成晶体的方法,具有设备简单、操作容易、合成晶体粉末分散性好等优点,在沸石合成中被广泛使用。水热合成沸石W 的温度和时间范围较宽,但也存在产率低、合成周期长的问题。例如,Skofteland 等[2]水热合成沸石W 的反应温度和反应时间为150 ℃和10 d;Maghsoodloorad 等[11]水热合成沸石W 的反应温度和反应时间为165 ℃和3 d;Bieniok 等[3]水热合成沸石W 的反应温度为150 ℃,反应时间为29 h 或24 h。
干凝胶合成法以硅铝干凝胶为硅铝源、氢氧化钾为碱源,添加少量水,晶化合成沸石W,该方法具有良好的应用前景。Hu 等[24]采用干凝胶合成法在胶体组成为n(K2O)∶n(SiO2)∶n(Al2O3)∶n(H2O)=3.75∶10∶2∶74、反应温度和反应时间为150 ℃和12 h 的条件下合成了高结晶度的沸石W。与水热法相比,干凝胶合成法的水量减少、晶化时间缩短、原料利用率和产率提高。
微波合成法与水热法相似,是利用微波辐射代替水热加热反应物,具有加热速率快的特点,但成本高。Liu 等[20]分别采用微波合成法和水热法合成了沸石W,发现微波加热的合成速率是水热加热的2 ~3 倍,主要原因是反应初始阶段利用微波加热提升了沸石W 的合成速率,所以采用微波(前期加热)和水热(后期加热)联合加热是一种合成沸石W的良好策略。Cheong 等[25]采用微波加热法,在胶体组成为n(K2O)∶n(SiO2)∶n(Al2O3)∶n(H2O)=3.5∶7∶1∶196、反应温度为180 ℃的条件下,将合成沸石W 的时间缩短到12 min。
沸石转晶法是以沸石为原料合成另一种目标沸石的方法。胡成玉等[26]以KOH 为结构导向剂、Y 型沸石(HY 和NaY)为原料,在水热条件下转晶合成了沸石W。研究结果表明,H2O/SiO2摩尔比和KOH/SiO2摩尔比对Y 型沸石的转晶具有很大的影响,利用转晶法缩短了沸石W 的合成周期。
3 MER 型沸石的应用
3.1 海水卤水提钾
钾盐是重要的农业及工业原料,而钾盐在我国属于稀缺资源。海水和卤水中含有大量的K+,且我国具有丰富的卤水资源和较长的海岸线,因此开发海水卤水提钾工艺具有重要意义。沸石法海水卤水提钾技术展现了良好的工业应用前景,但沸石对K+吸附容量小,选择性低,导致能耗过高,所以选择吸附性能良好的沸石至关重要。MER 型沸石硅铝比低,骨架电负性大,需要较多的骨架外阳离子来平衡沸石骨架电负性,是目前报道中对K+吸附量最大的沸石。石勤等[8]采用密度泛函理论计算得到MER 型沸石对K+的理论吸附量为171.4 mg/g,并模拟了MER 型沸石离子交换的热力学性质。研究结果表明,钠型及铵型沸石与溶液中K+的交换为放热反应,铵型沸石与溶液中Na+的交换为吸热反应;实验合成的沸石W 改性后用于模拟海水中K+的吸附动力学实验,在模拟海水中铵型沸石对K+的吸附速率快于钠型沸石,钠型及铵型沸石对模拟海水中K+的吸附均属于准二级反应,膜扩散是控速步骤[27]。Hou 等[28]采用水热法合成了沸石W 并用于海水吸钾,发现沸石W 对K+的吸附速率很快,20 min 即可达到吸附平衡,平衡吸附量为54.9 mg/g,在Na+-K+混合溶液中对K+的选择性为85.6。Jin 等[29]考察了沸石W 的合成条件对吸附海水中K+的影响,在最佳条件下合成的沸石W 对海水中K+的吸附量达58.7 mg/g。Chen等[30]以多孔陶瓷管α-Al2O3作为支撑管水热合成了MER 型沸石膜并用于海水提钾,该沸石膜在室温下经过108 h 的连续离子交换反应,对K+仍表现出较大的选择性。
3.2 工业催化
沸石作为催化剂的载体在工业催化中占有举足轻重的地位。MER 型沸石是一种微孔、低硅铝比的沸石,在小分子催化中具有潜在的应用前景。Seo 等[31]采用水热法和微波法分别合成了较高硅铝比的沸石W,发现它们均具有优异的热稳定性和适宜的酸性,合成的沸石W 作为催化剂载体用于甲醇脱水制二甲醚反应,在反应温度为325 ℃时,甲醇的转化率分别达到28%(微波法)和43%(水热法),二甲醚的选择性高达100%,连续运行37 h 后没有发现焦炭,说明催化剂具有较长寿命,这归因于沸石W 具有较弱的酸性位。
催化裂化汽油具有高硫和高烯烃含量的特点,对其进行加氢改质的关键是脱硫,难点在于尽可能降低硫含量的同时还要尽量保持辛烷值,即避免烯烃过度饱和导致辛烷值大幅下降。沸石W 与其他沸石复合生长制备的催化剂具有适宜的酸性和较大的比表面积及孔径,表现出优异的催化性能。段爱军课题组[32-35]制备了L/W 复合分子筛和W-MCM-41 复合分子筛,并用于催化裂化汽油加氢改质。研究结果表明,L/W 复合分子筛中L 分子筛部分生长在W 分子筛的表面上,具有更大的比表面积、孔体积以及平均孔径,并且具有更多的酸性中心和适宜的L/B 酸比;复合催化剂具有良好的异构和芳构化性能,从而补偿了因烯烃饱和所造成的辛烷值损失,在催化裂化汽油加氢改质中表现出更高的脱硫活性以及更少的辛烷值损失。以沸石W 为前体,采用水热法自组装制备的微/介孔分子筛W-MCM-41 兼具了介孔MCM-41 分子筛和微孔沸石W 的优点,具有良好的比表面积和孔体积,在催化裂化汽油加氢反应中也表现出良好的芳构化和异构化性能,具有较高的加氢脱硫活性以及较少的辛烷值损失。
硅铝沸石中带有负电荷的骨架氧原子是碱性位,碱性大小取决于骨架Al 含量和骨架外阳离子的类型,骨架Al 含量越高(硅铝比越低),骨架氧原子邻近的碱金属离子半径越大,骨架氧原子的碱性越强[36]。沸石W 是一种低硅铝比沸石,相当于一种固体弱碱,可用作碱性催化剂。Cheong 等[25]采用微波法合成了硅铝比为2.28 的沸石W,将其作为碱性催化剂用于香兰素与硝基乙烷制备香兰素2-硝基丙烯的反应中。研究结果表明,纳米尺度的沸石W 具有良好的催化性能,以香兰素2-硝基丙烯为唯一产物的转化率达到了86.5%,催化剂经过5 次循环利用后,虽然有少量的损失,但反应物的转化率和产物的选择性均无明显损失。Cheong 等[37]通过改变合成参数得到了四种不同形貌的沸石W,即纳米状、子弹状、棱柱状和麦穗状。表征结果显示,不同形貌的沸石W 虽然具有相近的骨架硅铝比(2.29),但具有不同的比表面积,沸石W 的总活性位点(弱、中、强碱性强度)与比表面积成线性正相关(相关系数为0.954)。他们还研究了不同形貌的沸石W 作为碱性催化剂对甲醇和丙烯腈的氰乙基化反应的影响,发现纳米状的沸石W具有最佳的催化性能(甲醇转化率达94.1%,产物选择性100%)。催化剂的催化活性与催化剂的形貌密切相关,因为不同形貌的催化剂暴露的碱性活性位数量不同,而催化剂的活性与反应物可达催化活性位点的数量直接相关。
3.3 气体分离
选择性地从CH4中分离CO2对于天然气和沼气等燃气的纯化具有重要意义,MER 型沸石作为沸石膜或吸附剂能够很好地完成这一任务。石勤等[38]采用分子模拟技术揭示了MER 型沸石吸附分离CO2/CH4的机理,CO2和CH4的平衡吸附量与沸石的自由体积和比表面积大小顺序一致,且近似成线性关系;与其他沸石相比,MER型沸石具有相当或更大的CO2吸附量,且具有较高的吸附选择性。MER 型沸石对CO2/CH4的吸附选择性高有两方面原因:一方面,骨架外阳离子与CO2的作用力很强,为CO2提供了大量的活性位;另一方面,MER 型沸石的扩散孔径介于CO2和CH4的动力学直径之间,扩散通道有利于CO2(动力学直径0.33 nm)通过,而阻碍CH4(动力学直径0.38 nm)扩散。Yeo 等[39]采用水热晶种法制备了MER 型沸石膜,该沸石膜对CO2表现出很高的选择性和渗透性,并指出对CO2/CH4的高选择性是CO2优先吸附与分子筛筛分效应结合的结果。Mirfenderesk[40]合成了用于分离CO2/CH4的高渗透性MER 型沸石膜,并考察了合成工艺参数对该沸石膜的渗透性和选择性的影响,最佳沸石膜对CO2/CH4的选择性为20.1,CO2渗透量为2.5×10-8mol/(m2·s·Pa)。Georgieva 等[6]研究了不同阳离子交换的MER 型沸石对CO2的吸附性能,结果表明,MER 型沸石是一种柔性结构沸石,在298 K、100 kPa 下,K-MER 型沸石对CO2的吸附量达3.5 mmol/g,CO2/CH4吸附选择性高达850(298 K,50 kPa,CO2/CH4的摩尔比为20∶80);穿透曲线表明K-MER 型沸石对分离CO2/CH4具有良好的动力学性质。
3.4 工业脱水
采用沸石膜在酸性环境下对有机溶剂脱水具有重大的工业应用价值。MER 型沸石因其独特的扩散通道、良好的机械和热稳定性、较大的吸水容量(0.56 mL/g)[23]、较好的亲水性和耐酸性,在酸性条件下对有机溶剂脱水表现出优异的性能。Hasegawa 等[41]以α-Al2O3为支撑管制备了MER型沸石膜,在573 K 及pH=4 的乙酸酸性溶液中均具有稳定的结构;在350 K 时,渗透蒸发分离乙醇水溶液中水的渗透通量和选择性分别达到1.9 kg/(m2·h)和9 300;制备的沸石膜还用于分离含水的不同有机溶剂,当有机分子直径大于乙醇分子直径时,MER 型沸石膜对水分子的分离因数随有机分子直径的增大而增大,而它对甲醇水溶液的分离因数较小,是因为甲醇分子较小进入了沸石通道,阻碍了水分子的扩散,说明MER 型沸石膜的扩散孔径是筛分水和有机溶剂的关键因素;与其他沸石(LTA,T,MOR)膜相比,MER 型沸石膜在有机溶剂脱水中具有较高的稳定性、渗透和分离能力。Nagase 等[42]分别采用K-MER、K-CHA 和Na-PHI 沸石作为晶种制备了MER 型沸石膜,并用于乙醇溶液脱水。实验结果表明,MER 型沸石膜具有很强的亲水性,它对溶液的渗透性和选择性由沸石膜和底部晶种粒子共同决定,选择亲水性的晶种可以提高分离选择性。
3.5 其他领域
MER型沸石还被用于缓释钾肥和水溶液脱砷。Li 等[22]利用沸石W 具有较高K+吸附容量的优点,以粉煤灰为原料合成了沸石W,并将其作为缓释钾肥用于农作物生长,通过向日葵生长实验发现沸石W 是一种良好的缓释钾肥,它与氮肥和磷肥(如磷酸铵镁)混合可广泛用于缺乏营养的土壤中以满足农作物的高营养要求。Flores 等[43]以巴西粉煤灰为原料合成了沸石W,测得沸石W 对K+离子的交换容量为102.2 mg/g,可将其置于小麦栽培土壤中作为释放钾元素的肥料,与农业上最常用的钾肥相比,沸石W 对植物具有良好的养分释放效率。
Medina 等[21]将合成的沸石W 经硫酸铝改性后用于水溶液脱砷,发现改性后的沸石W 在水溶液中对砷的吸附速率非常快,5 min 内即可使砷的质量浓度由740 μg/L 降至10 μg/L,回收率高达99%。
4 结语
与商业化的A,X,ZSM-5 等沸石相比,MER 型沸石的研究报道相对较少,但MER 型沸石因其独特的结构,在很多工业领域均展示出潜在的应用前景,将会受到了越来越多的关注。为进一步认识MER 型沸石并加快其工业化应用进程,今后应从以下几个方面加强研究:1)利用实验和分子模拟互补技术深入探究MER 型沸石的结构及其在不同应用领域的工作机制,精准调控MER 型沸石结构以获得良好的应用性能;2)选择廉价易得的原料,开发快速高效、安全绿色的沸石W 合成工艺,尤其是根据不同应用领域的工艺特点,开发适合不同工艺特点的沸石W 合成路线;3)在不同的原料、合成方法和条件下,往往合成出晶粒形状及尺寸不同的沸石W,有必要研究这些因素对应用性能的影响。
