c-GMP诱导对盐胁迫下番茄的转录组分析
2020-11-14朱晓林魏小红王宝强张明君
朱晓林,魏小红,王宝强,王 贤,张明君
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070; 2.甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070; 3.甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070)
在干旱和半干旱的广大地区,土壤中含有大量的盐分,这些盐分对植物生长的影响十分显著,而盐度作为一种主要的环境胁迫因素,对植物产生离子毒害、渗透胁迫、氧化胁迫等不利影响[1]。当植物暴露在盐中时,盐胁迫导致植物离子不平衡和高渗胁迫[2],对光合作用造成严重损害,同时产生活性氧自由基[3]。盐胁迫条件下,幼苗生长和存活率降低,导致结实率低和作物产量低[4],谷物质量也受到盐度的不利影响[5],特别是渗透胁迫会影响植物的气孔导度和吸水能力,导致水分亏缺和生理干旱[6]。离子胁迫通过细胞内高浓度的离子干扰植物的正常代谢[7]。同时由于Na+毒性对叶绿体光合和生物合成过程的间接影响,在高盐胁迫下,土壤有效钾和有效钠在植物根系中竞争吸收,其中一种离子对另一种离子的偏好程度决定了植物对盐胁迫的适应和耐受能力[8],当过量的Na+通过非特异性阳离子通道进入细胞时,它将与K+竞争结合到各种酶的活性部位,这不仅抑制酶的活性,而且导致叶绿体的功能紊乱,最终抑制光合作用[7]。因此,维持离子内环境平衡对于植物细胞应对盐碱环境至关重要[9],控制Na通过质膜(PM)运动以维持较低的Na+,细胞质中的浓度是细胞适应盐胁迫的关键因素[10]。应对盐分的成本效益策略之一是种植具有内在耐盐分能力的作物[11],为此,在分子生物学层面上阐明植物的耐盐机制,获得植物的耐盐相关基因,通过现代生物技术实现耐盐基因转化,并以此提高植物耐盐性已成为目前耐盐植物研究的热点[12]。
研究表明,第二信使环鸟苷3′,5′-单磷酸(c-GMP)是植物体内具有多种生物学功能的重要信号成分[13],与动物体内的情况相似。c-GMP作为一种次级信使,通过直接作用于下游效应器从而调节复杂的信号级联反应[14],c-GMP信号通路及其反馈调节分别通过鸟苷酸环化酶(GC)和3′,5′-环c-GMP磷酸二酯酶的合成和降解来操作[15]研究表明,c-GMP通过调节c-GMP依赖性蛋白激酶(PKGs)、c-GMP调节的磷酸二酯酶和环核苷酸门控离子通道发挥作用[16]。在植物中,c-GMP参与胁迫反应、种子萌发[17]、α-淀粉酶产生[18]、气孔运动[19]、不定根发育[20]、花粉管重新定向和细胞极性[21],花青素和类黄酮生物合成[22]。最近的研究表明,盐胁迫激活c-GMP信号通路[23],c-GMP调节单价阳离子(Na+还有K+)拟南芥的运输[14]。然而,c-GMP在植物抗盐胁迫中的调控机制及相关的信号转导机制尚不清楚。
番茄(Solanumlycopersicum)作为世界上种植最广、经济最重要的蔬菜作物之一,是植物中的模式作物,其染色体数目为2n=24,野生型从二倍体到六倍体不等[24]。作为一种中度盐敏感性植物,土壤中盐分过高会对番茄生长造成不利影响,从而使番茄产量与品质下降。研究表明,高浓度NaCl胁迫会使番茄产量下降。虽然关于番茄耐盐机理的报道较多[25-26,5],但大多从分析气孔形态特征及空间分布格局入手,同时监测叶片气体交换参数,高通量测序技术的应用极大地提高了人们对盐适应机制的认识,确定了各种非模式植物的盐适应机制,而从转录组水平揭示外源c-GMP诱导下番茄品种对盐胁迫响应机理的相关研究还鲜有报道。然而,盐胁迫反应涉及的整个网络还很不完整,不同植物特有的新基因或机制尚待发现。因此,本实验以番茄作为试材,通过利用转录组技术探究外源c-GMP诱导下番茄基因在盐胁迫中的表达模式,旨在为揭示外源c-GMP诱导下番茄响应盐胁迫的分子机制提供参考依据。
1 材料与方法
1.1 材料
供试材料为樱桃番茄,中早熟,品种为美味。产于北京东升种业有限公司。c-GMP的供体为膜透性类似物8-Br-c-GMP,Sodium salt,CAS Number:51116—0109,购买于An Apoptosis and Epigenetics Company,室温避光保存。以甘肃农业大学生命科学院实验室种植的组培苗为试验材料。
1.2 方法
1.2.1 NaCl与c-GMP处理
樱桃番茄种子(完全没有机械损伤)用2%NaClO表面消毒3~4 min,用无菌水洗5~6次,然后种植在带有两层滤纸的培养皿(直径90 mm)中,水培方式培育:生长条件包括温度为26 ℃,光周期为16 h/8 h(光/暗)。试验设计分为4组:CK,蒸馏水处理;T1,20 μmol·L-1c-GMP处理;T2,50 mmol·L-1NaCl处理;T3,50 mmol·L-1NaCl+20 μmol·L-1c-GMP处理。种植后,用5 mL CK、T1、T2、T3溶液处理樱桃番茄种子直到第7天,每天更换处理液。处理的第7天,选用事先已经消毒完毕的剪刀取其番茄叶片作为样品,立即用锡箔纸包装置于液氮中冷冻6 h左右,然后在-80 ℃下储存直至RNA提取,为避免非盐胁迫的潜在影响,依次将不同处理的叶片连续在4 h内收集完毕。该过程重复3次,作为3个生物学重复,每个重复包括70株植物。
1.2.2 总RNA提取及文库构建和转录组测序
根据每个生物学3次重复的原则,使用Trizol(Invitrogen,Carlsbad,CA,USA)提取总RNA,同时用DNA裂解酶裂解DNA,用带有Oligo(dT)的磁珠富集真核细胞mRNA,以mRNA为模板,用六碱基随机引物合成单链cDNA,然后利用试剂盒(Invitrogen,Carlsbad,USA)将单链cDNA合成为双链cDNA;纯化后的双链cDNA进行末端修复并加尾。连接测序接合器,选择片段大小,进行PCR扩增,构建的文库使用安捷伦2100生物分析仪进行鉴定,并使用Illumina HiSeq X Ten测序仪(中国上海)进行测序,以生成150 bp双端数据。
1.2.3 功能注释
使用BLAST[27]软件将发掘的新基因与NR、Swiss-Prot、GO、COG、KOG、Pfam、KEGG数据库进行序列比对,取阈值e<1×10-5,使用KOBAS2.0[28]得到新基因的KEGG Orthology结果,预测完新基因的氨基酸序列之后使用HMMER软件与Pfam数据库比对,获得新基因的注释信息。基因的Reads和FPKM通过bowtie2[29]和express[30]在线软件获得,此外在差异表达基因检测过程中,将差异倍数(fold change)≥2且错误发生率(FDR)<0.01作为筛选标准。
2 结果与分析
2.1 测序结果及数据组装
番茄幼苗在不同浓度c-GMP与NaCl处理下在第7天共取样12个,经过测序质量控制,共得到83.35 Gb的原始数据,平均每个样本6.94 Gb,各样品Q30碱基百分比均不小于90.91%,同时GC含量均大于42%,说明测序结果可行度较高,为后续研究分析提供了可靠的依据。
2.2 基因功能注释
由表2可知,外源c-GMP诱导NaCl胁迫下番茄幼苗共得到34 959条序列,其中31 734个基因在不同的数据库里得到了注释。在NR数据库里注释的基因最多,占99.35%,其次是eggNOG数据库,达到91.62%;而注释到COG数据库里的基因最少,仅占31.45%。
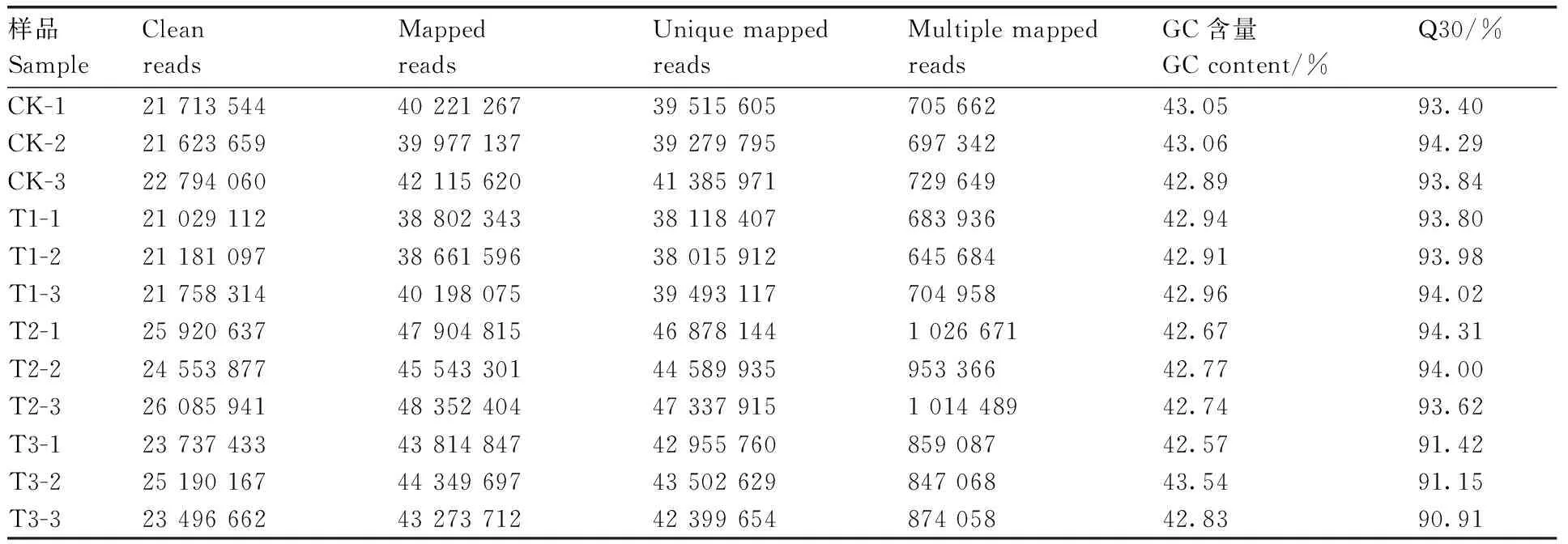
表1 测序数据统计表Table 1 Sequencing data statistics
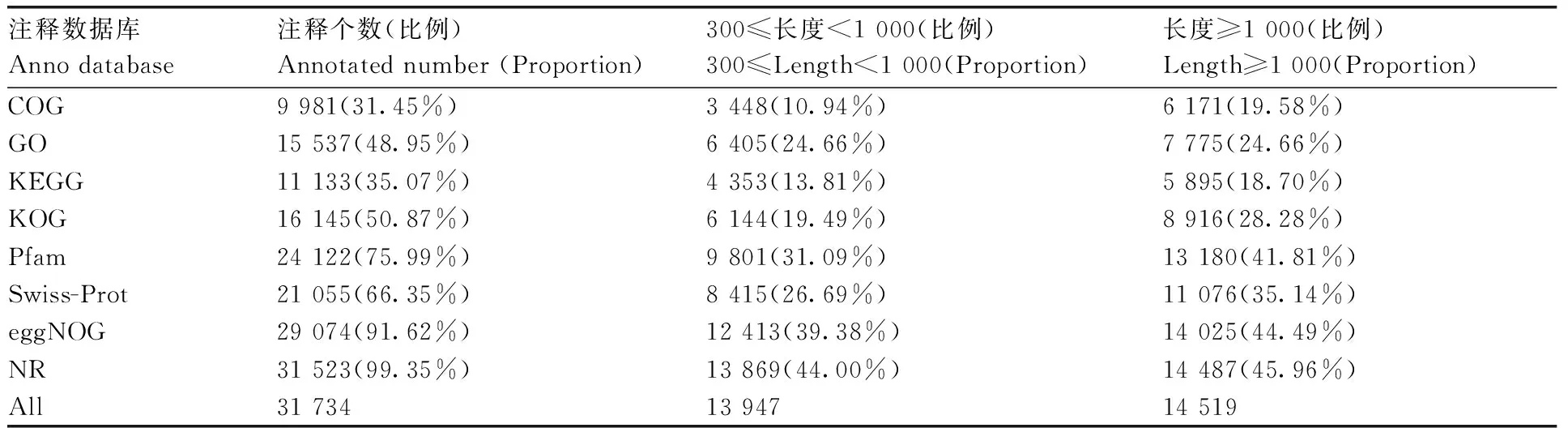
表2 单基因序列注释统计表Table 2 gene sequence annotation statistics
由图1可知,番茄不同处理转录组得到的基因在NR数据库注释中与马铃薯同源序列相对最多,共2 505个,占总注释的7.96%,其次是烟草与花叶草中,分别为1.74%,1.56%,最少的是在葡萄中,仅为0.20%;而在其他物种共1 166个,仅占注释的3.70%。
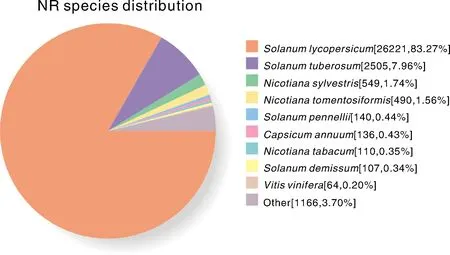
图1 番茄转录组基因在NR数据库中的同源性分析Fig.1 Homology analysis of tomato transcriptome genes in NR database
2.3 GO注释与分类
GO作为基因本体联合会建立的数据库,其主要是为探究并描述基因及其蛋白功能,因此其在多个物种中得到了广泛的应用,本研究通过GO数据库,对不同处理下的番茄基因进行基因生物学功能分类。结果如图2所示,总共将获得的15 537个番茄基因在GO数据库中得到相应的85 186个注释。在细胞组分(cellular component)、分子功能(molecular function)以及生物学过程(biological process)三大注释类别下的51个亚功能组中。15个亚功能类被注释到细胞组分中,其包含28 452个注释条目,其中基因在细胞(cell)与细胞部分(cell part)中均达到6 000以上,而在病毒粒子(virion)与病毒粒子部分(virion part)中个数最少,均为5个;15个亚功能组被注释到分子功能中,其包含18 815个注释条目,而其中催化活性(catalytic activity)所含基因最多,为7 669个,而转录调节(translation regulator)仅为1个;21个亚功能组被注释到生物学过程中,其所含的注释条目最多,为37 919个,其中代谢过程(metabolic process)的基因最多,达到8 688个。
2.4 KOG与COG注释与分类
为更深层次地了解番茄幼叶转录组基因的功能,我们对其进行了COG注释,COG数据库一般可以分为两类,原核生物的COG数据库以及真核生物的KOG数据库,我们通过将不同处理下的番茄基因在COG数据库与KOG数据库比对,得到9 982个基因在COG数据库被注释,16 145个基因在KOG数据库得到注释。并按其功能划分为25组,其中一般功能预测(general function prediction only)在COG与KOG中注释的基因均最多,分别为2 935个,3 376个,其次在COG数据库中,转录(transcription,1 620),复制、重组和修复(replication, recombination and repair,1 496),信号转导机制(signal transduction mechanisms,1 355)过程也得到较多注释;COG中注释最少的则均为细胞流动功能(cell motility),为4个,在COG数据库中,翻译后修饰、蛋白质更新、伴侣(posttranslational modification, protein turnover, chaperones,1 853),信号转导机制(signal transduction mechanisms,1 712),转录(transcription,1 088)过程也涉及较多的基因注释,注释最少的则为核结构过程(nuclear structure),仅2个。获得注释超过1 000的生物学过程中的基因在植物生长、发育、免疫、营养和生物活性化合物代谢等基本生物过程中发挥着重要的作用,根据这些序列注释,研究者能够了解基本的基因功能,以及基因在细胞中的位置、可能参与的生物过程以及涉及的代谢途径或信号通路等,这为后期的基因功能研究提供了数据。
2.5 KEGG注释与分布
将所有的基因在KEGG数据库进行功能分类,最终11 133个基因获得注释,我们挑选了基因分布前10的代谢通路,如表3所示,其所含的基因均超过200个,其中核糖体代谢(ribosome)通路中的基因最多,达422个,其次为植物激素信号转导(plant hormone signal transduction)通路332个,碳水化合物代谢(carbon metabolism)通路308个。
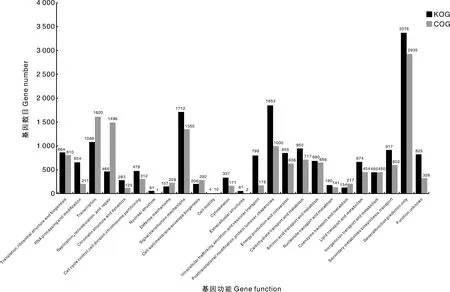
图3 番茄基因的COG与KOG分类Fig.3 COG and KOG classification of tomato genes
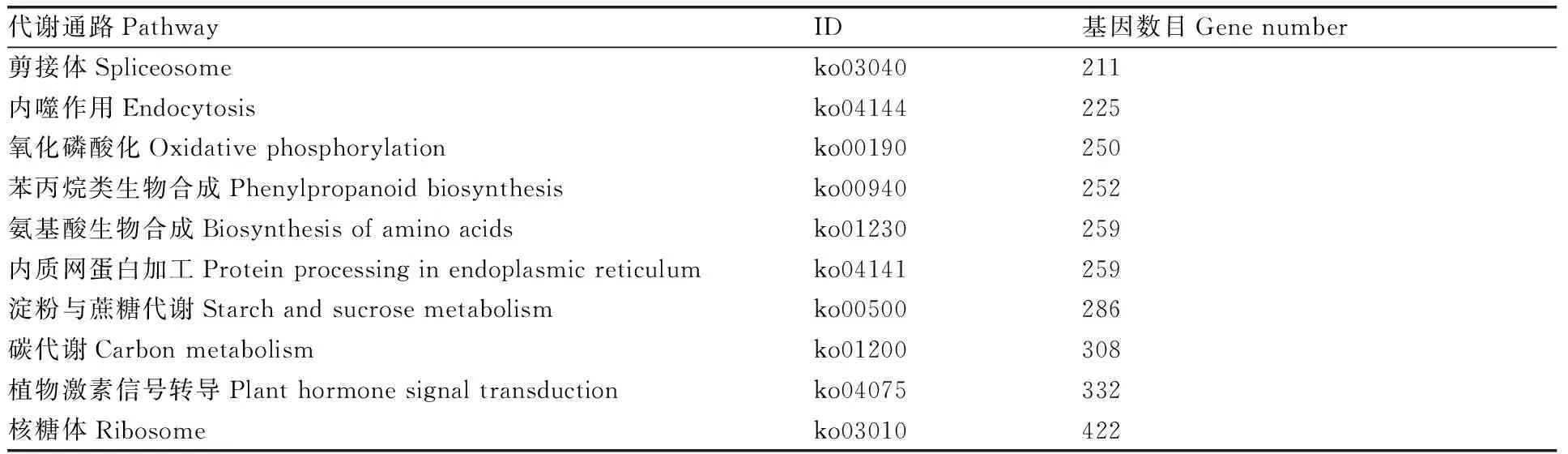
表3 番茄转录组基因数量最多的10个代谢通路Table 3 Ten metabolic pathways with the highest number of genes in the tomato transcriptome
2.6 SNP位点分析
SNP是指在基因组上由单个核苷酸变异形成的遗传标记,以置换、颠换、缺失和插入为主,其数量多,多态性丰富,SNP位点在DNA、RNA以及蛋白水平可能影响基因的功能以及生物性状的改变,特别是编码区的SNP,对基因表达与翻译有很大的影响,因此我们对番茄不同处理下的基因进行SNP预测分析,结果如表4所示,在未处理组中含有最多的SNP位点数(69 250),而在复合处理T3中,SNP位点数最少(59 638),其次各处理中基因区位点数约为基因间区位点数的3倍,且SNP类型数依次是转换型>颠换型>杂合型。同时通过采用SNPEff分别对其转录组SNP、InDel注释,可得不同处理下内含子区与编码区SNP位点最多,其次是基因下游与基因上游,而不同处理下的SNP数均高于对照下的SNP数。
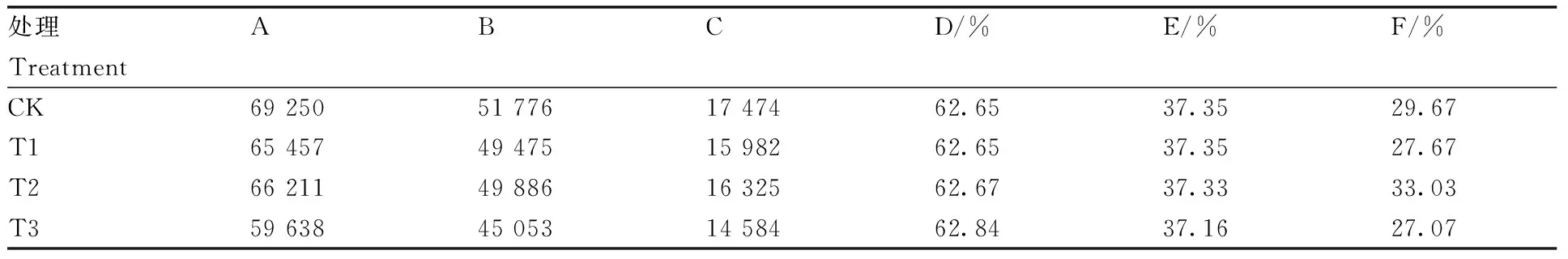
表4 番茄不同处理SNP位点分析Table 4 Different treatments of tomato SNP locus analysis
2.7 差异表达基因分析
由表5可知,与对照相比,番茄幼叶中上调基基因依次为T2处理>T3处理>T1处理;而将T2处理作为对照与T3相比时,番茄幼苗中271个基因上调,772个基因下调。

表5 番茄不同处理下差异基因表达分析Table 5 Analysis of differential gene expression under different treatments of tomato
3 讨论
据植物在盐环境中的生长能力,将其分为盐生植物和糖苷类[31]。一般来说,盐生植物被认为能够在超过200 mmol·L-1NaCl的浓度下完成生命周期,但是,对于大多数糖生植物来说,100 mmol·L-1NaCl的处理会严重限制它们的正常生长,并导致诸如黄化、叶萎缩和抑制根系生长等有害症状[32],而番茄作为糖苷类植物,盐胁迫会对其光合作用、蛋白质合成、离子转运、能量代谢等生理过程产生严重影响,甚至导致植物死亡。为了解c-GMP诱导盐胁迫下番茄幼苗的分子调控机制,本研究通过转录组测序技术,对不同处理下的番茄幼苗进行转录测序分析,完成12个样本的转录组分析,共获得83.35 Gb Clean data,Q30碱基百分比在90.91%及以上,测序结果表明测序质量非常可靠,满足转录组分析的基本要求。通过与番茄基因组数据库比对共得到34 959条基因序列,其中31 734条在NR、COG、SwissProt、KEGG、COG和GO数据库得到注释。
在番茄GO数据库注释中,我们发现注释到细胞组分、分子功能以及生物学过程的基因最多;主要涉及细胞、催化活性以及代谢过程等功能,这与郭强等[33]在转录组测序对紫花苜蓿铅胁迫分析得出的结论基本一致,同时也可以说明此类生物学过程与分子功能在c-GMP诱导的番茄幼苗抵御盐胁迫的过程中发挥着关键的作用。通过COG与KOG数据库,对不同处理下的番茄幼苗基因进行功能注释,9 982个基因在COG数据库被注释,16 145个基因在KOG数据库得到注释,其中主要涉及一般功能预测、mRNA转录、RNA加工修饰、信号转运机制、蛋白质翻译与核糖体结构等过程,这与韩媛吕[34]在中华螽斯转录组分析中的研究一致,说明这些注释到的基因在生物体生长、发育、免疫以及代谢过程中发挥着重要作用。
KEGG功能注释到11 133个基因涉及128个代谢通路,该数据为番茄幼苗特殊代谢途径相关基因等研究提供了基础数据,其中注释前三的依次是翻译过程、植物激素信号转导以及碳水化合物代谢途径,这是因为盐胁迫下的番茄幼苗受到外源c-GMP诱导时,首先通过自身碳代谢来产生应对不良环境的能量,其次,植物也通过合成许多酶从而催化自身的各种活动,同时将受到的不良信号通过体内的第二信使等进行传导,使植物产生应激反应抵御外界所造成的影响。这与赵路遥[35]、汤晓丽[36]在植物盐胁迫下转录组研究相符。
SNP作为育种中最广泛的分子标记[37],其分布密度高、遗传稳定性强,因此在遗传多样性分析、品种鉴定、遗传连锁图谱构建等研究中得到广泛的应用[38]。而依靠高通量测序方法,得到不同物种的SNP位点信息,已经是SNP开发的热点[39],本研究通过转录组数据获得不同处理下的SNP位点以及SNP类型数,扩大了番茄基因组SNP变异信息,其碱基变异类型主要以转换为主,且转换数约为颠换的2倍,这与在其他转录组SNP等研究相一致[40],且不同处理番茄幼叶中转换与颠换之比均大于1.5,远大于理论值(0.5),这种现象被称作转换偏差[41],转换偏差说明SNP位点碱基突变并不是随机的,其或许与外界环境相关。分析番茄幼苗转录组数据的SNP,我们发现位于编码区的SNP仅占22.6%,由此可知大多数SNP位于非编码区,此类SNP位点处的碱基变化可能对番茄生物性状的影响较小,同时SNP位点分析有助于我们更进一步明确不同处理的番茄幼苗在哪些代谢途径可能存在个体形状差异,以至于将这些SNP和其表型关联起来进行更深入的研究。
差异基因结果显示,组合处理(c-GMP+NaCl)下,其上调基因数远大于单独盐胁迫的基因上调数,这可能是单独盐胁迫时更多的是与抗盐无关的基因表达受到抑制,而抗盐相关基因则表达来抵御外界不良环境,而在外源c-GMP诱导下,更多与防御相关的基因表达从而合成一些抗氧化酶来抵御外界环境,例如MDA[42],同时c-GMP作为第二信使,可进行信号的传递,从而诱导更多基因表达。而差异基因的进一步分析,有助于我们从分子角度阐明c-GMP是如何诱导番茄盐胁迫下基因表达的机制。
4 结论
本研究通过Illumina高通量测序技术对NaCl胁迫、c-GMP诱导以及两者组合处理下番茄幼苗转录组进行测序,共获得83.35 Gb的原始数据,Q30碱基百分比在90.91%及以上,分别将各样品的原始读数与指定的参考基因组进行序列比对,比对效率从88.03%到92.74%不等。同时将得到的31 734条序列注释到不同的数据库(GO、KEGG、KOG、NR、Pfam、Swiss-Prot和egg NOG),通过GO数据库,将其划分到细胞组分、分子功能以及生物学过程三大注释类别下的51个亚功能组中,通过COG数据库与KEGG数据库将其分别注释到25个类别与128个代谢通路。在NaCl胁迫、c-GMP诱导以及两者组合处理下共发现SNP位点127 944个,其中仅有22.6%的SNP位点位于非编码区。差异基因结果显示,c-GMP能诱导盐胁迫下更多基因的表达。
