不同杨梅品种的耐低温能力比较
2020-11-14张淑文梁森苗朱婷婷任海英郑锡良戚行江
张淑文,梁森苗,朱婷婷,任海英,郑锡良,戚行江
(浙江省农业科学院 园艺研究所,浙江 杭州310021)
杨梅(MyricarubraSieb.et Zucc)是特色常绿亚热带果树,我国杨梅主要分布在长江流域以南,18°N~33°N,比较适于栽培在年平均气温为15~21 ℃的地区[1]。大多数来源于热带亚热带的植物,处于低温(0~12 ℃)条件时,生长和发育都会受到不同程度的影响,各个生理过程也会受到干扰。浙江作为杨梅主产区,2—4月份经常遭受低温阴雨天气,甚至是0 ℃以下的冰冻天气,对杨梅授粉和生长极为不利,进而影响产量、品质和经济效益。目前,尚无杨梅耐低温种质筛选的报道。本研究以12个杨梅主栽品种为研究对象,通过模拟早春低温环境,测定8个耐低温相关的生理指标,采用主成分分析法对主栽品种的耐低温能力进行综合评价,旨在填补杨梅耐低温种质筛选的空白,为栽培生产奠定理论基础。
1 材料与方法
1.1 试验材料
以浙江兰溪杨梅基地为采集地,选择长势良好、8~10年生健康植株进行取样。12个主栽品种资源分别为紫晶、早鲜、早色、迟色、荸荠种、水晶种、深红种、瑞光、早佳、木叶梅、东魁和早大梅,其果色、熟期和采集地等基本信息如表1所示。于2019年2月(最低气温3 ℃,杨梅处于休眠期)采集长度10 cm和粗度一致(茎粗周长2.5 cm)的1年生枝条,低温4 ℃保存,再在0 ℃低温处理24 h后作为实验材料。

表1 不同杨梅品种介绍Table 1 Introduction of different Chinese bayberry varieties
1.2 指标测定
将采集的12个品种整理编号,0 ℃低温处理24 h后,测定枝条的丙二醛(malondialdehyde, MDA)含量、超氧化物歧化酶(superoxide dismutase, SOD)活性、过氧化物酶(peroxidase, POD)活性(以上指标采用上海索桥生物科技有限公司试剂盒测定)和过氧化氢酶(catalase, CAT)活性(采用南京建成生物研究所试剂盒测定)。采用蒽酮法测定枝条的可溶性总糖(soluble sugars, SS)含量[2],采用考马斯亮蓝比色法测定可溶性蛋白(soluble proteins, SP)含量[2],采用茚三酮比色法测定脯氨酸(proline, Pro)含量[3]。同时选取低温处理后的枝条,避开芽眼剪成3~5 mm的薄片,混合均匀后称取2 g,分别置于15 mL去离子水的刻度试管中,盖上玻璃塞置于室温下浸泡处理12 h,用电导仪测定浸提液电导率(R1);然后沸水浴加热30 min,冷却至室温后摇匀,再次测定浸提液电导率(R2)。计算相对电导率(relatively electrical conductivity, REC),RREC(%) =R1/R2×100。
1.3 数据处理
本试验使用标准化法对测定的数据进行无量纲化,利用软件SPSS 22对标准化的数据进行聚类分析和主成分分析,得到品种的聚类分析结果和主成分分值Fjn,采用综合得分公式:综合分值F综=∑Fjn×Ej。F综为因子分析法得到的各样品耐低温性的综合分值,Fjn为第n个样品第j个特征值>1的公因子的分值,Ej为第j个公因子的方差贡献率[4]。
采用Excel对全部指标的3次重复进行均值和标准差的计算。
2 结果与分析
2.1 不同杨梅品种的SS、SP和Pro含量比较
植物体内SS、SP和Pro含量与其抗逆生理密切相关,在植物受到逆境胁迫时,这些物质可作为渗透调节物质和防脱水剂[5],提高细胞内渗透物浓度而降低水势,使细胞保持膨压[6],即植物耐逆性越强,体内SS、SP和Pro含量越高[7-8]。在本试验中,低温处理后不同杨梅品种SS含量为23.068~41.236 mg·g-1,其中荸荠种SS含量最高,迟色含量最低;12个品种的SS含量大小为荸荠种>早鲜>紫晶>早佳>木叶梅>早色>瑞光>早大梅>深红种>东魁>水晶种>迟色。不同品种的SP含量集中在2.632~3.266 mg·g-1,其中深红种的SP含量最高,12个品种的SP含量大小为深红种>木叶梅>早大梅>水晶种>紫晶>早鲜>东魁>迟色>早佳>早色>瑞光>荸荠种。不同品种的Pro含量为96.055~235.026 μg·g-1,其中木叶梅的Pro含量最高,12个品种的Pro含量大小为木叶梅>早鲜>瑞光>东魁>早佳>迟色>紫晶>深红种>水晶种>早大梅>迟色>荸荠种(表2)。
2.2 不同杨梅品种的REC和MDA含量比较
REC可直观地反映植物细胞在抗逆环境中受损伤的程度;MDA作为植物膜脂过氧化产物,可反映细胞膜受损程度和植物耐低温能力[9]。如表2所示,低温处理后,不同杨梅品种的REC为29.834%~41.421%,其中,迟色的REC最小,12个品种的相对电导率大小为水晶种>早色>早佳>木叶梅>早鲜>荸荠种>早大梅>紫晶>瑞光>东魁>深红种>迟色。12个杨梅品种的MDA含量为17.255~33.835 nmol·g-1,其中,荸荠种的MDA含量最高,12个品种的MDA含量大小为荸荠种>紫晶>早鲜>深红种>瑞光>迟色>早大梅>水晶种>木叶梅>东魁>早佳>早色。
2.3 不同杨梅品种的POD、SOD和CAT活性比较
当植物受到低温胁迫时,活性氧含量大幅增多,会破坏细胞膜和蛋白质,对植物造成伤害,此时植物会通过保护酶系统(SOD、POD和CAT)来清除活性氧,使细胞膜不被过氧化[10]。在本研究中,低温处理后不同杨梅品种的POD活性为2.012~6.368 U·g-1,深红种的酶活性最高,12个品种的POD活性大小为深红种>早色>东魁>水晶种>迟色>早鲜>早大梅>紫晶>荸荠种>早佳>木叶梅>瑞光;不同杨梅品种的SOD活性为3 528.572~9 457.182 U·g-1,早大梅的 SOD活性最高,12个杨梅品种的SOD活性大小为早大梅>水晶种>早佳>木叶梅>早鲜>紫晶>荸荠种>迟色>瑞光>深红种>迟色>东魁;12个杨梅品种的CAT活性为5.067~19.398 U·g-1,深红种CAT活性最高,12个品种的CAT活性大小为深红种>荸荠种>木叶梅>早色>东魁>水晶种>迟色>紫晶>早鲜>早佳>瑞光>早大梅(表2)。
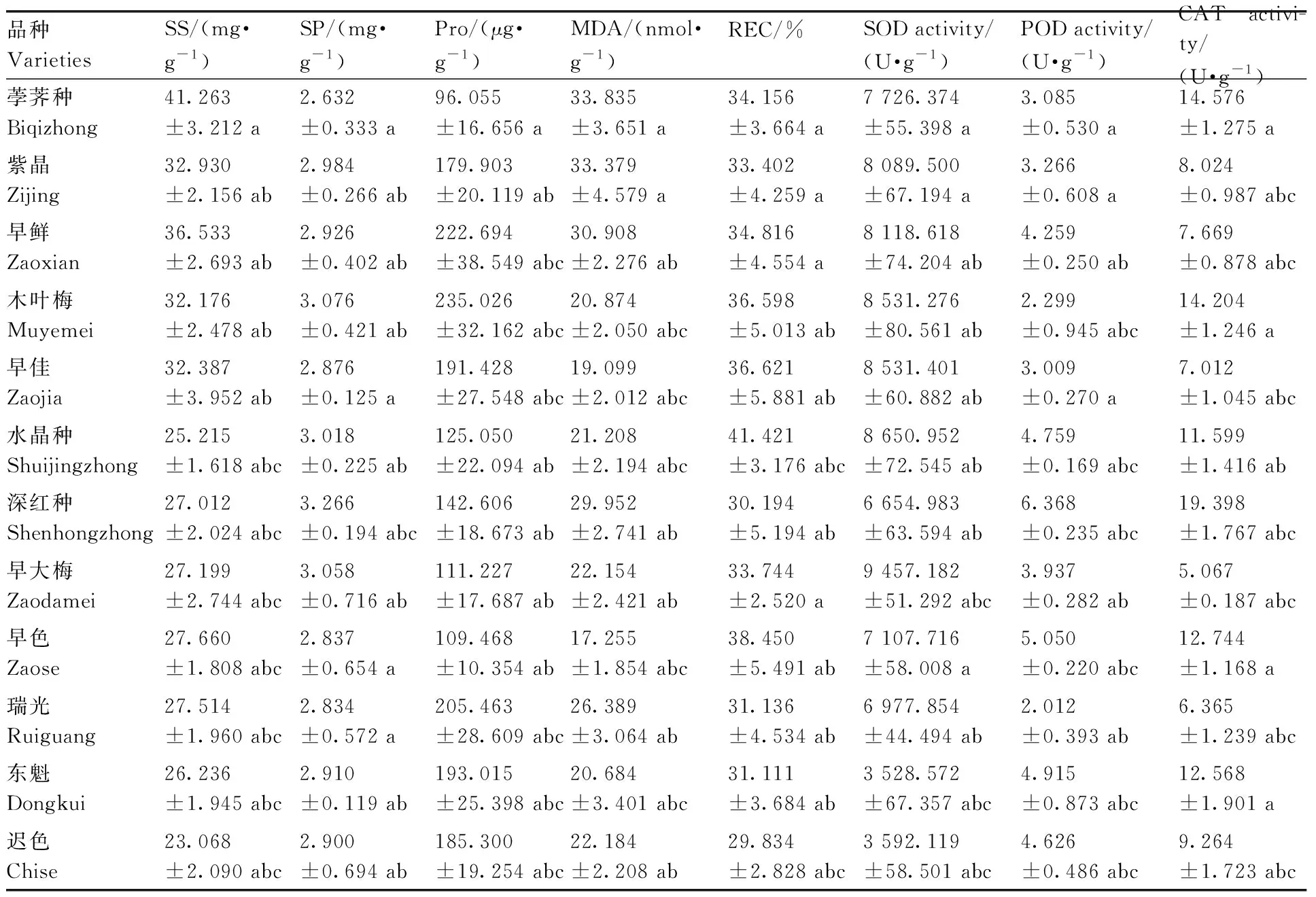
表2 低温胁迫下不同杨梅品种间生理指标的比较Table 2 Comparison of physiological indexes among different varieties of Chinese bayberry under cold stress
2.4 不同杨梅品种耐低温能力的综合评价
采用标准化数据和SPSS 22软件降维模块的因子分析功能,对12种杨梅品种的8个耐低温性状进行主成分分析,提取到4个主成分(表3),累积贡献率为85.558%,主成分特征值分布在1.117~2.589。同时计算出4个主成分的因子载荷矩阵(表4),第1主成分的方差贡献率为32.365%,具有较大载荷值的性状为SS含量。第2主成分的方差贡献率为21.403%,REC具有较大的载荷值。第3主成分的方差贡献率为17.832%,具有较大载荷值的性状是MDA含量和CAT活性。第4主成分的方差贡献率为13.958%,具有较大载荷值的性状是SP含量。
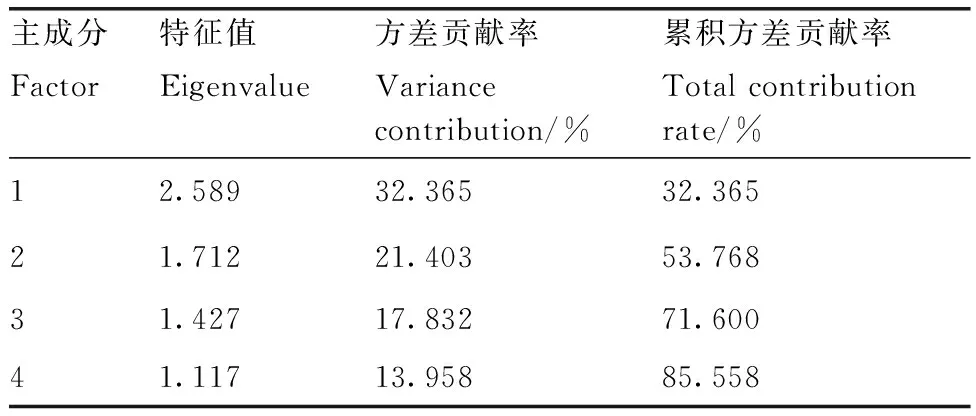
表3 杨梅耐低温评价因子的特征值和方差贡献率Table 3 Eigenvalue and contribution rate of low temperature resistant factors
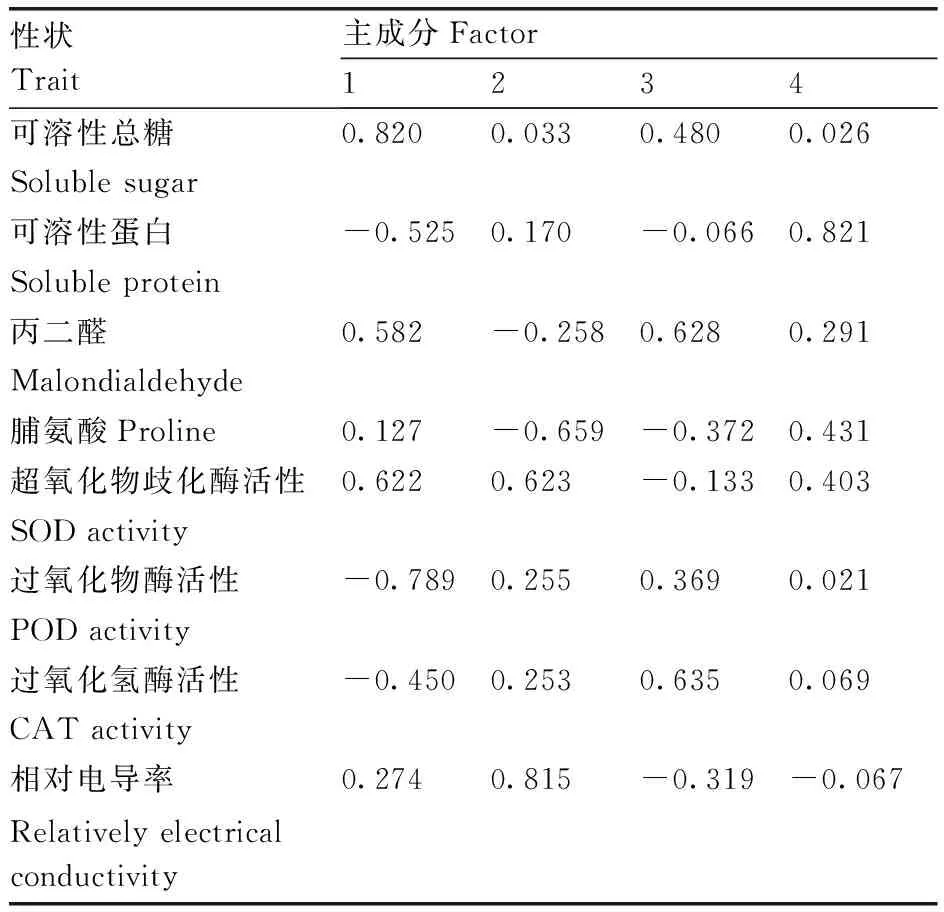
表4 主成分在不同性状上的因子载荷矩阵Table 4 Rotated component matrix of the principle component analysis
以4个主成分和每个主成分对应的特征值占总特征值的比例为权重,计算主成分综合模型:F综=0.324F1+0.214F2+0.178F3+0.140F4。12个品种的综合得分如表5所示,得分高低为荸荠种>早鲜>紫晶>木叶梅>水晶种>早大梅>早佳>早色>深红种>瑞光>东魁>迟色。
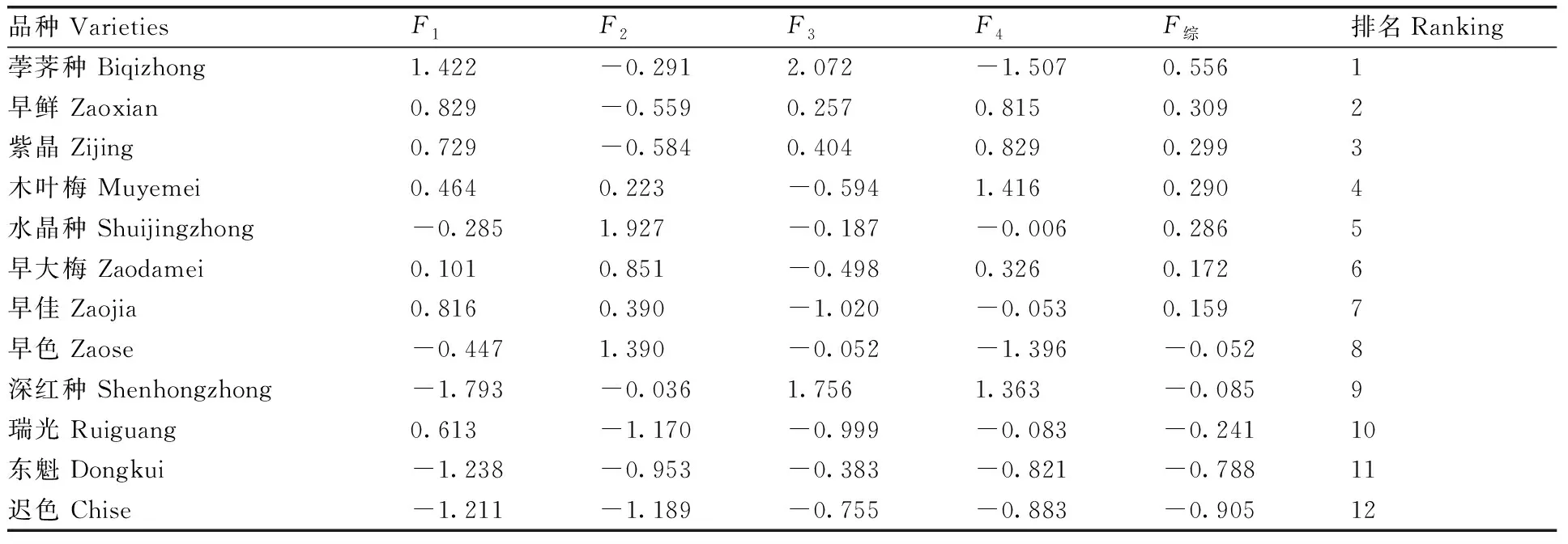
表5 不同杨梅品种耐低温性的综合评价Table 5 Evaluation of different bayberry varieties under cold stress
2.5 不同杨梅品种耐低温性状的聚类分析
采用SPSS 22对12个杨梅品种的耐低温性状进行聚类分析,结果如图1所示。12个品种根据耐低温能力强弱和耐低温性状所占比重可以分为5组:第1组为东魁和迟色,耐低温能力最弱;第2组为木叶梅、早佳、紫晶、早鲜和瑞光,耐低温能力较强且耐低温性状和机制较一致;第3组为水晶种、早色和早大梅,耐低温能力较弱,易发生冻害;第4组为荸荠种,单独为一类,耐低温能力最强,适应范围较广;第5组为深红种,也是单独一类,在耐低温性状综合评价中排名第9,耐低温机制较特殊,POD和CAT活性较高。
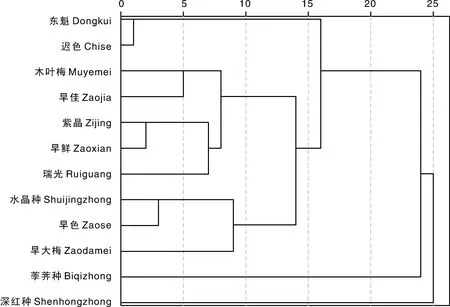
图1 不同杨梅品种耐低温综合指标聚类分析Fig.1 Dendrogram of comprehensive index of cold resistance of different Chinese bayberry varieties
3 讨论
低温胁迫可诱导植物体内积累更多游离的SS、SP和Pro等物质,这些渗透调节物质的积累可减轻渗透胁迫,降低冰点,增强保水能力,防止膜脂和蛋白质的过氧化作用等[11]。在主成分分析中,第1主成分中的SS具有较高的载荷值,表明SS在综合评价时起到了最为重要的作用;在对SS进行比较时发现,12个不同品种的SS含量顺序与综合评价的结果较一致,荸荠种最高,早鲜次之;说明在杨梅的耐低温研究中,SS含量可以最直接地表示其耐低温能力,这与核桃[12]和石榴[13]中的研究结果相同。植物低温胁迫下体内会积累Pro,Pro是植物蛋白质的组成成分之一,并以游离状态存在于植物体内,是逆境下细胞质的渗透调节物之一,在稳定生物大分子、解毒、增强膜中蛋白质分子间的水合力、调节渗透压与保护原生质膜等方面具有重要作用[14]。在耐低温性研究中关于SP、Pro与低温胁迫的关系有2种观点,其一是支持低温导致植物细胞中该物质含量变化趋势是逐渐增加的,即与植物的耐低温性成正相关;其二是认为该物质含量在低温抗冷过程中并不会发生改变,或者与抗冷性的增强并不存在因果关系[15]。本研究中Pro在12个不同品种间的含量顺序与综合评价结果有差异,所以在杨梅中关于Pro与耐低温能力的关系符合第2种观点,当然这一结论仍需进一步讨论。在第4主成分中SP具有较高的载荷值,说明SP在耐低温能力评价中起到重要作用,而且在不同品种间SP含量的比较中发现,其含量顺序与综合评价顺序大体一致,表明杨梅的SP含量与耐低温性成正相关,符合第1种观点,这也与果蔗[16]和花生[17]中的研究结果相同。
植物在受到逆境胁迫时,细胞膜的结构和功能首先受到伤害,导致膜透性增加,内容物外渗。若将受低温伤害的组织浸入去离子水中,其外渗液中电解质的含量比正常组织外渗液高,组织受伤害越严重,电解质含量增加越多[18]。低温胁迫会促进胞内活性氧(ROS)的产生,过多的ROS易诱发膜脂过氧化,进而导致膜脂过氧化产物MDA的大量积累,通常可利用MDA含量的高低来反映膜脂过氧化的水平和细胞膜受损的程度,以及植物抵御逆境能力的强弱[19]。本试验中,在第2主成分中REC和第3主成分中MDA均具有较大的载荷值,表明在此次基于系列耐低温指标的杨梅耐低温能力综合评价中,REC和MDA起到重要作用。在对REC的比较中发现,水晶种的REC最大,说明0 ℃低温处理24 h后,水晶种的膜系统最为敏感,而从表2可以看出该品种的POD、SOD和CAT活性较高,最终综合评价的结果中水晶种排名第5位,为较耐低温的品种,推测这可能与其具有较强大的细胞保护酶系统有关,使其能够快速做出冷激反应,并较好地适应低温环境。通过比较MDA含量发现,荸荠种的MDA含量最高,该品种在本研究中是最耐低温的种质,与前人研究的MDA与耐低温能力呈负相关这一结论有矛盾[20],笔者认为这可能与MDA含量的变化会随着低温胁迫时间的变化呈现先上升后下降的趋势有关[21],这可能是荸荠种单独聚为一类的主要原因,这一推测还需进一步验证。
植物细胞膜应对低温胁迫的保护酶系统主要包括POD、SOD和CAT等酶类。POD和CAT是清除活性氧的主要保护酶,低温胁迫期间CAT可分解植物体内的过氧化氢,POD可降解过氧化氢,解除细胞内有害自由基。通过POD和CAT的协同作用,使自由基维持在一个低水平,从而防止自由基伤害;SOD可以与超氧化物阴离子自由基反应,阻止氧化的发生[22-23]。在主成分分析中,第3主成分的CAT活性具有较大的载荷值,表明CAT活性与杨梅耐低温能力关系密切。12个品种中深红种、荸荠种和木叶梅具有较高的CAT活性,其中深红种的CAT活性最高;此外,深红种的POD活性也是最高,说明深红种具有较强的POD和CAT保护酶的协同作用,能够及时清除细胞中的活性氧,使自由基降低到安全水平,推测深红种具备较为独特的耐低温机制。通过比较SOD活性发现,早大梅、水晶种和早佳具有较高的SOD活性,与最终的综合评价结果中三者的得分顺序也较为一致。
在果树生产中,低温伤害是主要的自然灾害,特别是对早花果树,常因遭受早春寒潮袭击而影响果实生产。果树一般为多年生,一旦受害将比其他作物产生的后果更为严重。在本研究中,通过8个耐低温性状的综合评价和聚类分析发现,荸荠种单独聚为一类,且耐低温能力最强;早鲜、紫晶和木叶梅聚为一类,也具备较强的耐低温能力;深红种由于其独特的耐低温机制也单独聚为一类;迟色和东魁聚为一类,为最不耐低温的品种,在冬季或初春低温时需做好防寒措施。
