加用三黄胰瘅散外敷治疗急性胰腺炎临床观察
2020-11-13林丽芳杨伟兴
林丽芳,杨伟兴,赵 星,向 未
(1.西南医科大学中西医结合学院,四川 泸州 646000;2.西南医科大学附属中医医院,四川 泸州 646000)
急性胰腺炎(acute pancreatitis,AP)是胰腺的急性炎症过程,临床表现为上腹部疼痛,常伴有恶心呕吐、腹胀、发热、血(尿)淀粉酶升高等腹膜炎症状与体征[1]。本病根据患者是否伴有多器官功能衰竭、局部和(或)全身并发症划分为轻症急性胰腺炎(mild acute pancreatitis,MAP)以及重症急性胰腺炎(severe acute pancreatitis,SAP)两大类,同时根据器官功能衰竭持续性时间(是否大于48 h)划分为中重症急性胰腺炎(moderate to severe acute pancreatitis,MSAP)和重症急性胰腺炎[2-3]。轻症急性胰腺炎病理类型多为胰腺充血、水肿型,具有自限性,预后尚可;中重症及重症急性胰腺炎病理类型多为胰腺出血、坏死型,预后不佳,死亡率较高[4]。西医治疗急性胰腺炎的方案主要包括早期的补液、维持内环境稳态、胃肠道减压、抑制胰酶及胰液的分泌、营养支持及抗感染等治疗[5-6]。近年来,越来越多的研究者将本病的治疗研究着眼于祖国医学,大量实验室及临床研究发现,中药能够多方面、多靶点、多层次地作用于全身各组织器官[7]。本研究观察三黄胰瘅散治疗急性胰腺炎患者的临床疗效及对患者相关炎性细胞因子的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年1月1日至2020年1月1日于我院住院的60 例符合纳入标准的急性胰腺炎患者,随机分为治疗组和对照组,每组30 例。两组胰腺炎患者的年龄、性别及病情严重程度方面比较,差异均无统计学意义(P>0.05),具有可比性。见表1。本研究项目已获得西南医科大学附属中医医院伦理委员会同意。
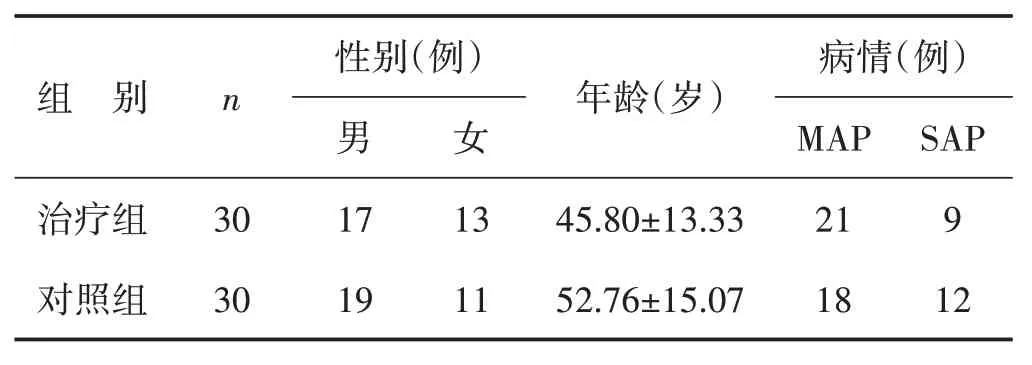
表1 两组患者一般资料比较
1.2 诊断标准
1.2.1 西医诊断标准[2]①与AP相符合的腹痛:主要表现为急性发作的、持续性的上腹部剧烈疼痛,通常放射至腰背部,疼痛性质表现多样,可表现为绞痛、钻痛、钝痛或刀割样疼痛等,可伴有腹胀、恶心呕吐及发热等症状;②血清淀粉酶(AMS)、血清脂肪酶(LPS)活性至少超过正常上限值的3 倍;③腹部影像学(增强CT为诊断AP的有效检查方法)检查符合AP影像学改变。具备上述3 项中的任意2 项,即可诊断为AP。按照AP的分级标准分为MAP、MSAP、SAP。
1.2.2 中医诊断标准 参照《中医内科学》[8]进行诊断。腹痛:系指以胃脘部以下,耻骨毛际以上的部位,出现剧烈疼痛为主要表现的一种病证;湿热壅滞证:上腹部剧痛,腹部胀满,拒按,便秘,或大便黏腻不爽,胸闷不适,烦渴欲饮,身热汗出,小便黄,舌质红,苔黄燥或黄腻,脉滑数。
1.3 纳入标准 ①符合AP的诊断标准及中医湿热壅滞证型的患者;②患者近1 个月内未使用任何含激素的药物;③患者年龄18~80岁;④患者同意参加本次研究项目,并签订相关知情同意书。
1.4 排除标准 ①入院时距发病时间大于72 h者;②患有严重心、脑血管疾病以及肝肾疾病者,慢性疾病临终状态者;③对所用中药药材过敏者;④肿瘤患者及准备妊娠、妊娠期、哺乳期患者;⑤病因非脂源性、胆源性、酒精性的患者;⑥有神经精神类疾病而无法合作,或不愿配合者。
1.5 治疗方法
1.5.1 对照组 予以西南医科大学附属中医医院脾胃病科常规中西医结合治疗方案:禁食水、胃肠道减压、补液、抗感染、抑制胃酸及胰液的分泌、柴黄清胰活血颗粒(由我院制剂室将柴胡、黄芩、栀子、大黄、厚朴等药按一定比例制成颗粒备用)通过胃管口服及灌肠、对症支持等治疗。
1.5.2 治疗组 在对照组治疗的基础上加用三黄胰瘅散外敷中上腹部疼痛处。三黄胰瘅散组成:生大黄、栀子、连翘、黄芪、甘遂等药。将上述中药研成细粉末状,搅拌均匀后,分装成盒备用,每次取成品药末20 g 加入适量温开水调成糊状,可加入少许蜂蜜以增加药物黏性,平敷于上腹部疼痛处并固定,外敷范围超过腹部疼痛区域,每天1次,敷药时间为6 h,两次用药时间至少间隔12 h。
两组疗程均为2周。
1.6 观察指标 ①两组腹痛消失时间,血清淀粉酶(AMS)、血清脂肪酶(LPS)、血清白细胞计数(white blood cell count,WBC)等指标恢复正常的时间,住院天数等。②治疗前后两组血清肿瘤坏死因子-α(TNF-α)及白介素-6(IL-6)的水平变化。③不良反应。
1.7 疗效判定标准 参照文献[9-10]拟定。治愈:治疗后LPS、AMS、WBC 等血清炎性指标及TNF-α、IL-6水平均恢复正常,发热、腹痛、恶心呕吐等入院时存在的局部或全身症状及体征消失;有效:治疗后患者症状及体征明显改善,血清炎症指标及相关细胞因子水平较治疗前降低但没有恢复到正常水平;无效:治疗后发热、腹痛、恶心呕吐等症状及体征未见好转甚至病情进一步加重,血清炎性指标及炎性细胞因子亦无明显下降趋势。总有效率=(治愈病例数+有效病例数)/总病例数×100%。
1.8 统计学方法 应用统计软件SPSS 17.0 进行统计学分析,计数资料采用率(%)统计描述,计量资料用(±s)表示,计数资料比较采用χ2检验,计量资料用t检验,等级资料比较用秩和检验,均以P<0.05 为差异有统计学意义。
2 治疗结果
2.1 两组临床疗效比较 治疗组总有效率为96.67%,对照组总有效率为86.67%,治疗组临床疗效优于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组临床疗效比较 (例)
2.2 两组炎性指标恢复正常时间、腹痛消失时间以及住院天数比较 两组WBC、AMS、LPS 等血清炎性指标恢复正常时间、腹痛消失时间、住院天数比较,治疗组均较对照组明显缩短,差异均具有统计学意义(均P<0.05)。见表3。
表3 两组炎性指标恢复正常时间、腹痛消失时间、住院天数比较 (d,±s)
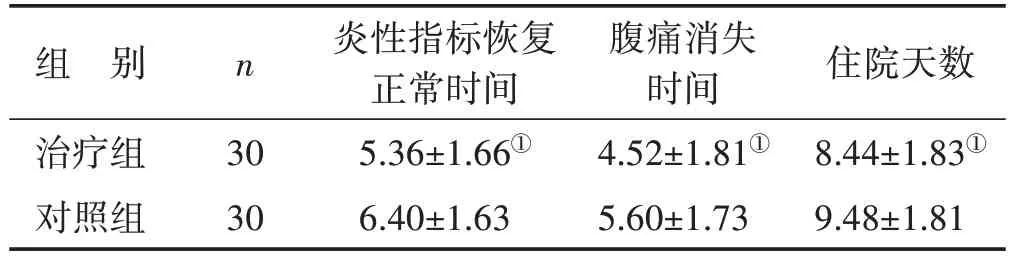
表3 两组炎性指标恢复正常时间、腹痛消失时间、住院天数比较 (d,±s)
注:与对照组比较,①P<0.05
组 别治疗组对照组n 30 30炎性指标恢复正常时间5.36±1.66①6.40±1.63腹痛消失时间4.52±1.81①5.60±1.73住院天数8.44±1.83①9.48±1.81
2.3 两组相关炎性细胞因子的水平比较 治疗前两组患者的TNF-α 及IL-6 水平比较,差异均无统计学意义(P>0.05);治疗后两组患者的TNF-α及IL-6水平均较治疗前降低,差异有统计学意义(P<0.05),治疗后治疗组的TNF-α、IL-6 水平均明显低于对照组,差异有统计学意义(P<0.05)。见表4。
2.4 不良反应 在治疗中,治疗组有2 例患者出现轻微过敏症状,主要表现为腹部皮肤潮红、皮疹等,经过对症处理后症状消失。
表4 两组治疗前后相关炎性细胞因子水平比较 (pg/ml,±s)

表4 两组治疗前后相关炎性细胞因子水平比较 (pg/ml,±s)
注:同组治疗前后比较,①P<0.05;与对照组治疗后比较,②P<0.05
组 别治疗组对照组n 30 30 TNF-α治疗前62.50±5.99 59.45±5.75治疗后25.13±3.95①②33.54±4.91①IL-6治疗前37.75±7.96 36.87±4.42治疗后26.60±2.40①②31.23±4.26①
3 讨 论
由于现代人们饮食不节制、生活作息不规律,AP的发病率呈逐年上升趋势[11],已成为严重危害人们健康、占用医疗卫生资源的常见多发危重疾病。而SAP更是凭借其发病机理复杂、起病凶猛、进展迅速等临床特点,成为高死亡率的危急重症之一[12]。国内外许多学者对于AP 的发病机理及损伤机制做了大量的研究,目前“细胞因子学说”[13]已经成为继“胰腺消化学说”“自由基损伤学说”“胰腺微循环障碍学说”之后的研究重点。研究发现,在AP 发病的过程中往往是促炎性细胞因子表达过度,而抗炎性细胞因子表达不足,最终导致细胞因子平衡失调,致使脏器结构和功能受到炎性损害[14]。因此,过度的免疫炎性反应,被认为是SAP最常见的重要死因之一。
而本研究中,选择TNF-α 及IL-6 作为观测指标是因为在AP 发生时,TNF-α 水平在疾病初期即升高,是最为重要的促炎性细胞因子之一[15]。在炎症发生发展的过程中,TNF-α 是由浸润胰腺的巨噬细胞受到过多的病理刺激而产生和释放的,而过量的TNF-α又可促进白细胞向胰腺组织聚集并活化,刺激其他细胞分泌炎性介质[如血小板活化因子(PAF)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)等],引起胰腺及胰腺周围组织出现水肿、充血、渗出、坏死等一系列损害,甚至会引发全身炎症反应综合征、多器官功能障碍综合征等严重并发症的发生[16]。研究表明,TNF-α 的水平与急性胰腺炎患者的病情严重程度及预后呈正相关,是评估SAP 预后的主要指标之一[17]。而IL-6 在急性胰腺炎早期即由巨噬细胞、内皮细胞等释放[17-18],在疾病早期即可达到峰值,其升高与上升到高峰的时间可反映急性胰腺炎患者体内炎症的严重程度以及胰腺损伤情况[19],可用于评估AP 炎症反应的病情严重程度[20];同时疾病早期IL-6 水平的升高预示AP 患者可能会出现器官功能衰竭和其他严重疾病[21]。
对于AP 的治疗,西医主要以对症处理为主,并没有特效药或者相关技术手段提高治愈率及生存率。依据AP 的发病部位与主要临床表现,中医将AP 归属于“脾心痛”“胁痛”“腹痛”“胰瘅”等范畴[22]。病位在脾胃,与肝、胆密切相关,病机演变多为湿、热、瘀、毒等各种致病因素引起人体气机不畅,肝疏泄失常,脾运化失司,湿浊内生,郁而化热,致使中焦被有形之邪阻滞,加重气机阻滞,气滞而血瘀,从而导致“肠腑不通,不通则痛”[23]。六腑以通为用,以降为顺。“正气存内,邪不可干”,“体虚之处便是邪聚之处”,因此急性AP 发病必有正虚的一面。遵循此原则,湿热壅滞证型AP 的中医治疗宜清热通腑泄浊,佐以活血化瘀扶正。
三黄胰瘅散是我科治疗AP 的经验外用药方。本方中大黄为君药,性味苦寒,具有泻下攻积、清热解毒、活血化瘀的功效。现代药理研究发现,大黄素是大黄的主要有效成分,能够加强肠道蠕动,使炎性介质及病原菌加速从肠道清除,从而保护肠黏膜、改善肠道微循环并减轻炎性反应[7]。张延英等[24]及曹砚杰等[25]通过动物实验发现,生大黄、大黄素都能降低AP 大鼠模型的血淀粉酶以及IL-6、TNF-α 等炎症因子的水平,并在一定程度上缓解病情,其作用机制可能是通过抑制单核细胞趋化蛋白-1(MCP-1)、单核细胞趋化蛋白-2(MCP-2)的表达来控制炎症反应。栀子、连翘、甘遂为臣药。栀子与连翘二药合用,增强大黄的清热解毒之功;甘遂性味苦寒,有小毒,具有泻水逐饮、消肿散结的功效,善行经隧之水湿,使体内潴留之水饮从二便排出,与大黄合用,增强了大黄的泻下攻积作用。马美妮等[5]通过研究发现临床上多使用芒硝、生大黄、甘遂等药通过口服、外敷、灌肠等方式帮助AP 患者排气、排便,改善腹痛、腹胀等临床症状,从而提高患者的治愈率,降低死亡率。黄芪味甘性温,具有益气扶正、补肺脾之气、敛疮生肌、托毒排脓的功效。其主要药理成分为黄芪皂苷、黄芪多糖、黄芪黄酮等,邓蓓蓓[26]通过动物实验研究发现,黄芪多糖(astragalus polysacharin,APS)可降低SAP 大鼠D-乳酸水平及血二胺氧化酶(DAO)浓度,这表明APS 具有保护肠黏膜上皮细胞的作用,减轻了肠上皮细胞的损伤程度,维持了肠黏膜屏障结构和功能的完整性。本方主要通过通腑、泻热、消瘀、祛毒、扶正等方法,达到通则不痛的目的,促进肠道内大量富含细胞因子和炎性介质的物质排出体外,减少肠道黏膜对炎性物质的吸收,抑制炎性反应的发生,改善胰腺、肠道微循环障碍,维持肠黏膜屏障完整,从而避免全身炎症反应综合征、多器官功能障碍综合征等并发症的发生[27]。
本课题研究结果显示,治疗后治疗组的TNF-α、IL-6 水平均明显低于对照组(P<0.05),表明三黄胰瘅散可有效抑制炎性细胞因子的表达,促进炎症的恢复。治疗后治疗组的腹痛消失时间、住院时间、炎性血清指标恢复正常时间与对照组相比较,均明显缩短(P<0.05),表明三黄胰瘅散具有良好的止痛抗炎作用,能有效缓解患者腹痛,促进白细胞、血清淀粉酶、血清脂肪酶等相关血清炎性指标恢复正常,缩短患者的住院时间、减少住院费用,提高临床疗效。
综上所述,三黄胰瘅散对急性胰腺炎有显著的临床疗效,且具有制作成本低、操作简单、不良反应少等优势,其作用机制可能与降低TNF-α、IL-6 等相关炎性细胞因子的水平有关,值得临床推广应用。
