基于IBR模型研究BDE-47和BDE-153对半滑舌鳎的毒性效应
2020-11-13迟潇陈碧鹃孙雪梅朱琳唐学玺夏斌曲克明
迟潇,陈碧鹃,孙雪梅,朱琳,唐学玺,夏斌,*,曲克明
1. 中国海洋大学海洋生命学院,青岛 266071 2. 中国水产科学研究院黄海水产研究所,农业部海洋渔业资源可持续发展重点实验室,山东省渔业资源与生态环境重点实验室,青岛 266071 3. 青岛海洋科学与技术试点国家实验室,海洋生态与环境科学功能实验室,青岛 266237
多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是一类常用的溴代阻燃剂,由于其阻燃效率高、热稳定性好、所需添加量小、对材料性能影响小及价格便宜等优点,被广泛应用于电子、化工、建筑、纺织和石油等生产生活领域中[1]。作为添加型阻燃剂,PBDEs不会和聚氨酯、树脂或者聚苯乙烯等物质形成稳定化学键而紧密连接,因此,在各种产品使用、废弃、填埋、老化和降解等过程中,容易从这些产品表面挥发脱离,释放到环境中,随后通过大气沉降和地表径流等方式进入到海洋中[2-3]。如胶州湾养殖区海水中PBDEs含量范围为ND~630.8 pg·L-1,其中,BDE-47为主要污染物[4];中国香港附近海域水体中PBDEs的含量约为311~1 187 pg·L-1,达到ng·L-1水平[5]。研究表明,PBDEs属于环境内分泌干扰物,对生物作用的主要靶器官有甲状腺、肝脏和肾脏等,其毒理学效应主要表现为神经毒性、内分泌系统毒性、生殖发育毒性、免疫毒性和细胞毒性[6-8]。目前的研究主要集中于高浓度PBDEs对水生生物的毒性效应,但是关于环境浓度PBDEs对海洋生物的毒性效应研究还很少。
近年来,已在大量水生生物体内检测到PBDEs,包括鱼类、白鲸(Delphinapterusleucas)、环斑海豹(Phocahispida)和北极熊(Ursusmaritimus)等海洋哺乳类生物[9-11],特别是在鱼体内的富集情况尤为严重[12]。目前,已开展6种PBDEs同系物(BDE-28、BDE-47、BDE-99、BDE-100、BDE-153和BDE-183)对斑马鱼(Barchydanioreriovar)的毒性效应研究[13]。但是PBDEs对海洋经济鱼类的毒性效应研究较少,鱼类是海洋生态系统中的顶级群落,在海洋生态系统中起着重要作用,因此,研究PBDEs对海洋鱼类的毒性效应具有重要意义。半滑舌鳎,属鲽形目、舌鳎科、舌鳎属,主要分布在我国渤海和黄海等近海海域,是我国重要的名贵海水鱼类,也是近海增养殖品种,但是目前关于PBDEs对半滑舌鳎毒性效应的研究还未见报道。
综合生物标志物响应(integrated biomarker response, IBR)指数能够综合所有的生物标志物对污染物的响应,转换成一个“压力指数”值,已经成功应用于评估石油烃等多种污染物的生物毒性效应研究中[14-15]。本文测定了不同暴露浓度下半滑舌鳎肝脏的超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、雌激素受体(estrogen receptor, ER)和7-乙氧基-3-异吩唑酮脱乙基酶(7-ethoxyresorufin-o-deethylase, EROD)的活性以及丙二醛(malondialdehyde, MDA)含量,并运用IBR模型来研究BDE-47和BDE-153对半滑舌鳎的毒性效应,为客观评价PBDEs的海洋生态风险评估提供理论依据。
1 材料与方法(Materials and methods)
1.1 材料与仪器
1.1.1 实验生物及其驯养
半滑舌鳎购于莱州市金益源水产公司,体长为(3.0±0.5) cm,体重为(2.4±0.5) g。
实验前,暂养3~5 d,自然死亡率低于1%;暂养过程中水温22 ℃,连续充气,每天喂食1次,每天更换1/3水量。
1.1.2 仪器与试剂
2,2’,4,4’-四溴联苯醚(BDE-47)、2,2’,4,4’,5,5’-六溴联苯醚(BDE-153)均购于AccuStandard公司(色谱纯)。PBDEs微溶于水,以二甲基亚砜(DMSO)(色谱纯,国药集团化学试剂有限公司)为溶剂,配制每种PBDEs浓度为1 mg·L-1的母液,4 ℃下保存备用。实验前,用F/2培养基依次稀释成所需浓度的实验溶液。
丙二醛试剂盒、超氧化物歧化酶试剂盒、谷胱甘肽试剂盒、谷胱甘肽硫转移酶试剂盒、谷胱甘肽过氧化物酶试剂盒、过氧化氢酶试剂盒、考马斯亮蓝总蛋白试剂盒和标准蛋白均购自南京建成生物工程研究所。
1.2 实验设计
本实验设置5、500和50 000 ng·L-1这3组实验浓度,并设有空白对照组、溶剂对照组,每组3个平行。其中,5 ng·L-1为环境浓度[16]。暴露时间为15 d,挑选体长相近、健康的半滑舌鳎用于实验,每组放入半滑舌鳎幼鱼15尾,实验期间每天早上适量投喂1次饲料,24 h不间断微量充气。采用半静水接触染毒法,每隔24 h换相同浓度的新鲜试验液。实验开始后,于1、5、7和15 d随机选取一尾,将随机捞取的样本鱼麻醉后在冰盘上进行解剖,取出肝脏并去除表面附带的结缔组织,在4 ℃生理盐水中漂洗干净,用滤纸拭干表面水分,称取适量样品。生理盐水作为匀浆介质,在冰水浴条件下,用匀浆器制成10%的肝脏组织匀浆液。在4 ℃、2 000 r·min-1下离心15 min,上清液即为粗酶液,用于酶活性测定。测定用试剂盒均购于南京建成生物工程研究所,并使用酶标仪进行测定。
1.3 测定方法
SOD通过黄嚷吟及黄嚷吟氧化酶反应产生超氧阴离子自由基,后者与胺盐可形成亚硝酸盐,在显色剂的作用下呈现紫红色,在450 nm处可测定其吸光度值。SOD活性单位定义:每毫克组织蛋白在1 mL反应液中,SOD抑制率达50%时所对应的酶量。
GSH-Px可以促使H2O2与还原性谷胱甘肽(GSH)反应生成H2O和氧化性谷胱甘肽(GSSG),而GSH可与二硫代二硝基苯甲酸作用,生成的5-六代二硝基苯甲酸阴离子呈现黄色,在412 nm处测吸光度,从而得到GSH-Px活性。GSH-Px活性单位定义:每毫克蛋白质每分钟扣除非酶反应,使GSH浓度降低1 μmol·L-1为一个酶活力单位。
CAT分解H2O2的反应通过钼酸铵而中止,剩余的H2O2与钼酸铵作用产生淡黄色的络合物,可在405 nm处测定其生成量,由此计算H2O2的反应量,计算CAT活性。CAT活性单位定义:每毫克组织蛋白每秒钟分解1 μmol的H2O2的量。
MDA与硫代巴比妥酸(TBA)反应生成红棕色产物,在532 nm处有最大吸收峰,可测定此波长处的吸光值,从而确定MDA含量。
用纯化ER捕获抗体包被微孔板,制成固相抗体,微孔中加入ER,与辣根过氧化物酶(HRP)标记的检测抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物3,3’,5,5’-四甲基联苯胺(TMB)显色,在450 nm波长下测定吸光度,从而确定ER含量。
EROD酶采用快速终止荧光光度法,在催化剂作用下,催化7-乙氧基-异吩噁唑酮转化成为荧光代谢产物异吩唑酮,经代谢后富集,异吩唑酮的量与EROD活性成正比,可以通过测定荧光密度得到EROD活性。EROD活性单位定义:用每分钟每毫克蛋白产生的9-羟基-3-异吩唑酮相对量来表示。
1.4 IBR计算方法

(1)
式中:xi’为xi均一化后的值。
各阶段生物标志物的得分(Bi值)计算公式为:
Bi=Z+|xmin|
(2)
式中:|xmin|为各阶段生物标志物均一化处理后的数据最小值的绝对值,Bi值大小在星状图中以辐射线的长度代表,星状图面积(即图中由相邻生物标志物的辐射线围成的星状图面积Ai之和)按照下式计算:
(3)
式中:
Ai=Bi/2sinβ(Bicosβ+Bi+1sinβ)
(4)
β=arctan(Bi+1sinα/Bi-Bi+1cosα)
(5)
式中:n为生物标志物数量,β为相邻两辐射线围成的三角形的夹角,α为相邻的2条辐射线夹角,α=2π/n;Bn+1=B1。
1.5 数据处理与分析
所有数据均以平均值±标准差(Means±SD)表示,应用SPSS 16对数据进行分析,采用One-way ANOVA对数据进行单因素方差分析,并用Duncan’s进行显著性差异,显著性水平P<0.05。
2 结果与讨论(Results and discussion)
2.1 BDE-47和BDE-153对半滑舌鳎肝脏SOD活性的影响
BDE-47和BDE-153对半滑舌鳎肝脏SOD活性的影响如图1所示。空白对照组半滑舌鳎肝脏组织中SOD活性在实验期间基本保持不变,溶剂对照组的SOD活性基本保持不变,与空白对照组没有显著差异。BDE-47暴露下,5 ng·L-1浓度组的SOD活性与对照组相比变化不大,在7 d时SOD活性略有升高但无显著性差异;500 ng·L-1浓度组的SOD活性先升高后有所降低,在1 d和3 d时显著升高,分别为45.62 U·mg prot-1和48.39 U·mg prot-1,在7 d和15 d时SOD活性虽然有所降低但仍高于对照组;而50 000 ng·L-1浓度组SOD活性在暴露之后迅速降低,在3 d以后,显著低于对照组。BDE-153暴露下,5 ng·L-1浓度组的SOD活性略有浮动但无显著变化;500 ng·L-1浓度组的SOD活性在1 d时迅速升高,后逐渐降低;而50 000 ng·L-1浓度组SOD活性在暴露之后迅速降低,在7 d以后,显著低于对照组。
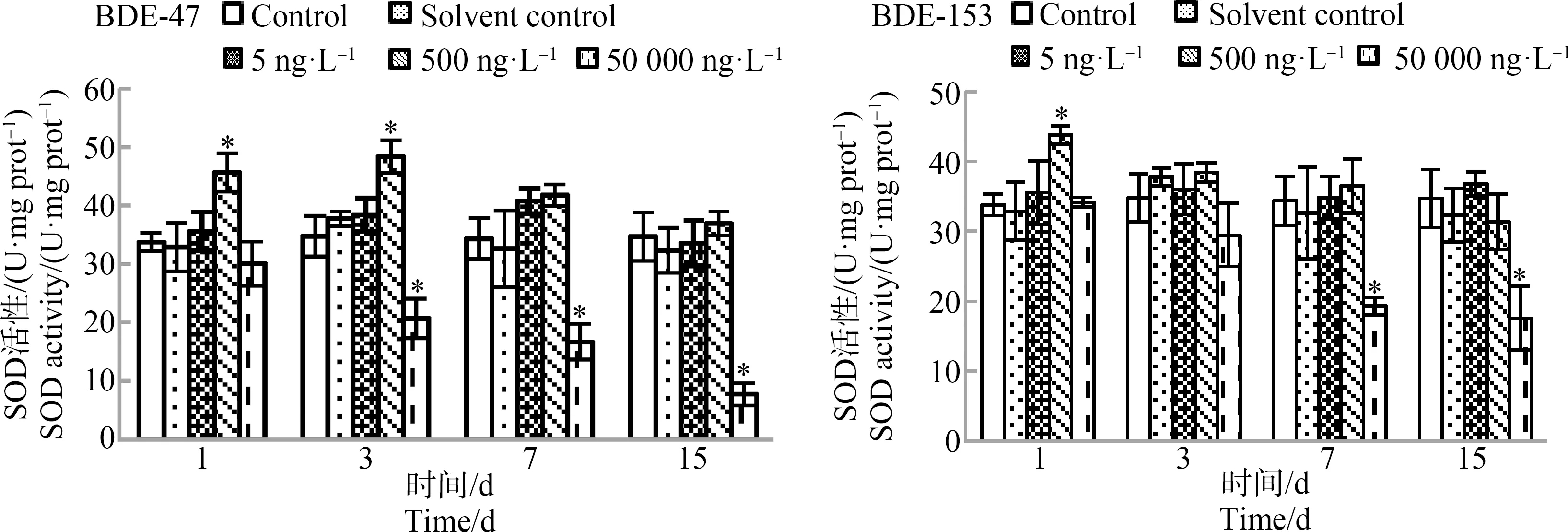
图1 BDE-47和BDE-153对半滑舌鳎肝脏超氧化物歧化酶(SOD)活性的影响(n=3)注:*表示显著性差异,P0.05。Fig. 1 Effects of BDE-47 and BDE-153 on superoxide dismutase (SOD) activity in liver of Cynoglossus semilaevis Gunther (n=3)Note: * indicates significant differences, P0.05.

2.2 BDE-47和BDE-153对半滑舌鳎肝脏GSH-Px活性的影响
BDE-47和BDE-153对半滑舌鳎肝脏GSH-Px活性的影响如图2所示。空白对照组半滑舌鳎肝脏GSH-Px活性基本保持不变,溶剂对照组的GSH-Px活性也基本保持不变,与空白对照组无明显差异。在BDE-47暴露下,5 ng·L-1浓度组中GSH-Px活性无显著变化;500 ng·L-1浓度组中GSH-Px活性迅速升高后逐渐降低,在1 d时GSH-Px活性为32.81 U·mg prot-1,显著高于对照组,随后逐渐降低至对照组水平;50 000 ng·L-1浓度组中GSH-Px活性随时间增长不断降低,在7 d和15 d时分别为15.61 U·mg prot-1和13.60 U·mg prot-1,显著低于对照组。在BDE-153暴露下,5 ng·L-1浓度组中GSH-Px活性无显著变化;500 ng·L-1浓度组中GSH-Px活性先升高后降低,在1 d时GSH-Px活性为31.36 U·mg prot-1,显著高于对照组,随后逐渐降低;50 000 ng·L-1浓度组中GSH-Px活性逐渐降低,在7 d和15 d时分别为16.90 U·mg prot-1和16.62 U·mg prot-1,显著低于对照组。
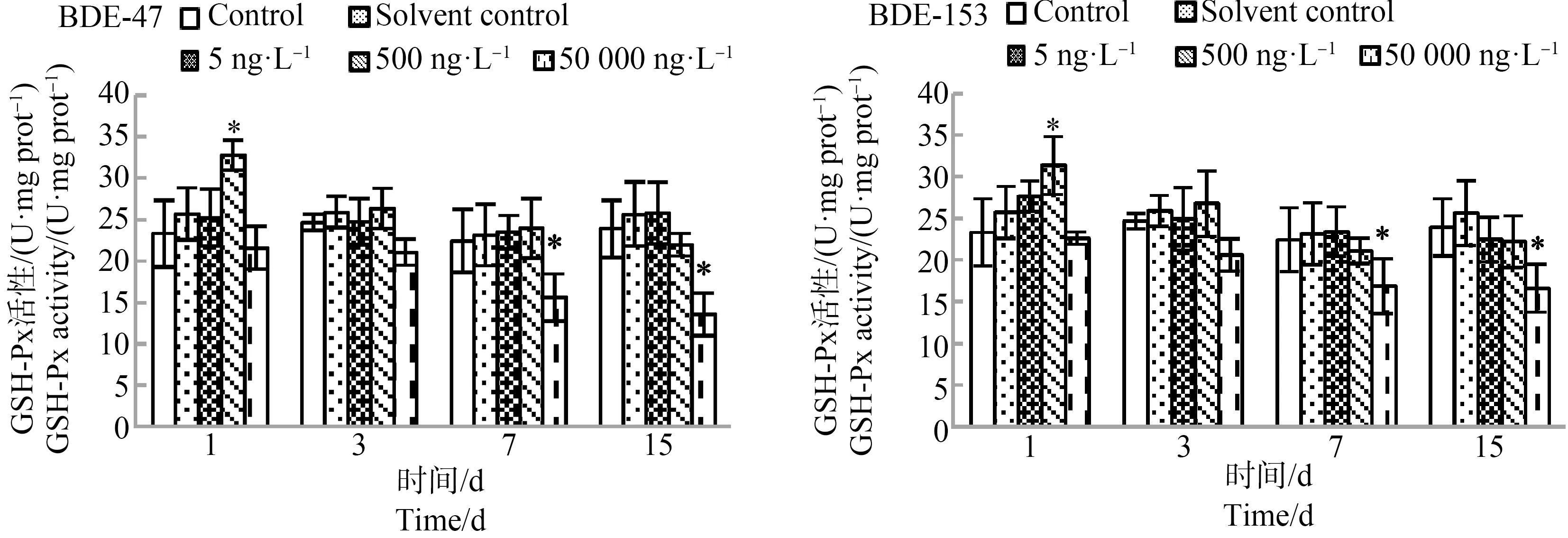
图2 BDE-47和BDE-153对半滑舌鳎肝脏谷胱甘肽过氧化物酶(GSH-Px)活性的影响(n=3)注:*表示显著性差异,P0.05。Fig. 2 Effects of BDE-47 and BDE-153 on glutathione peroxidase (GSH-Px) activity in liver of Cynoglossus semilaevis Gunther (n=3)Note: * indicates significant differences, P0.05.
GSH-Px是机体内广泛存在的一种重要过氧化物分解酶,它能催化GSH变为GSSG,同时促进H2O2的分解,分解产生的物质可以清除在细胞呼吸代谢过程中产生的过氧化物和羟自由基,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害[23-24]。有研究发现,BDE-47和BDE-209对鲫鱼(Carassiusauratusauratus)GSH-Px活性影响呈现显著的剂量效应[22]。本实验结果表明,5 ng·L-1浓度组中GSH-Px活性无显著变化,说明环境浓度的BDE-47和BDE-153不会对半滑舌鳎GSH-Px活性产生显著影响;500 ng·L-1浓度组中GSH-Px活性先升高后降低,这是由于低浓度刺激使得机体抗氧化系统清除体内产生的自由基,从而迅速抵御外界环境的刺激;但是50 000 ng·L-1浓度组中GSH-Px活性逐渐降低,在后期显著低于对照组,说明在长时间的高浓度胁迫下,机体抗氧化系统出现损伤,使得其GSH-Px活性不断降低。
2.3 BDE-47和BDE-153对半滑舌鳎肝脏CAT活性的影响
BDE-47和BDE-153对半滑舌鳎肝脏CAT活性的影响如图3所示。空白对照组与半滑舌鳎肝脏组织中CAT活性基本保持不变,溶剂对照组的CAT活性也基本保持不变,与空白对照组无明显差异。在BDE-47暴露下,5 ng·L-1浓度组中CAT活性无显著变化;500 ng·L-1浓度组中CAT活性在3 d内逐渐升高,在3 d时CAT活性显著高于对照组,随后降低,CAT活性显著低于对照组;50 000 ng·L-1浓度组中CAT活性在3 d内随时间增长不断升高,明显高于对照组,随后降低,显著低于对照组。在BDE-153暴露下,5 ng·L-1浓度组中CAT活性无显著变化;500 ng·L-1浓度组中CAT活性在3 d内逐渐升高,但与对照组无显著差异,随后降低,显著低于对照组;50 000 ng·L-1浓度组中CAT活性在3 d内随时间增长不断升高,显著高于对照组,随后下降,显著低于对照组。

图3 BDE-47和BDE-153对半滑舌鳎肝脏过氧化氢酶(CAT)活性的影响(n=3)注:*表示显著性差异,P0.05。Fig. 3 Effects of BDE-47 and BDE-153 on catalase (CAT) activity in liver of Cynoglossus semilaevis Gunther (n=3)Note: * indicates significant differences, P0.05.
CAT是生物体内重要的抗氧化酶,可以促使H2O2分解为O2和H2O,排除生物体内的H2O2,从而保护细胞避免受到H2O2的损伤,是生物体内抗氧化防御系统的重要组成部分[25-26]。CAT活性也经常被用作监测环境污染物的生物标志物。研究表明,较低浓度的污染物对CAT产生诱导激活作用,可增强机体消除活性氧自由基的能力,高浓度污染物对CAT产生抑制是污染物对生物体的作用超过机体的适应能力而产生的中毒反应的前兆[27];低浓度BDE-47可诱导黄孢原毛平革菌(PhanerochaetechrysosporiumBurdsall)细胞内CAT活性的升高[28]。本实验结果表明,5 ng·L-1浓度组中CAT活性无显著变化,说明环境浓度BDE-47和BDE-153不会对半滑舌鳎CAT活性产生显著影响;500 ng·L-1浓度组中CAT活性先短暂升高后显著降低,说明短暂的PBDEs胁迫刺激了机体的抗氧化系统,使其发挥功能从而清除体内的H2O2,但由于长时间的暴露,抗氧化系统受到了严重损伤,使其CAT活性无法恢复。
2.4 BDE-47和BDE-153对半滑舌鳎肝脏MDA含量的影响
BDE-47和BDE-153对半滑舌鳎肝脏MDA含量的影响如图4所示。空白对照组半滑舌鳎肝脏MDA含量基本保持不变,溶剂对照组的MDA含量基本保持不变,与空白对照组无显著差异。在BDE-47暴露下,5 ng·L-1浓度组MDA含量与对照组无显著差异;500 ng·L-1浓度组中MDA含量先升高后逐渐降低,在1 d时达到8.6 nmol·mg prot-1,显著高于对照组,后逐渐降低,在15 d时与对照组无显著差异;50 000 ng·L-1浓度组中MDA含量与对照组相比显著升高,在1 d达到对照组含量的2倍,后在15 d中逐渐降低,但都显著高于对照组。在BDE-153暴露下,5 ng·L-1浓度组MDA含量与对照组无显著差异;500 ng·L-1浓度组中MDA含量先升高后逐渐降低,在1 d时达到7.99 nmol·mg prot-1,显著高于对照组,后逐渐降低,在15 d恢复至对照组水平;50 000 ng·L-1浓度组中MDA含量显著升高,在1 d达到12.23 nmol·mg prot-1,后在15 d中逐渐降低,但均显著高于对照组。

图4 BDE-47和BDE-153对半滑舌鳎肝脏丙二醛(MDA)含量的影响(n=3)注:*表示显著性差异,P0.05。Fig. 4 Effects of BDE-47 and BDE-153 on the content of malondialdehyde (MDA) in liver of Cynoglossus semilaevis Gunther (n=3)Note: * indicates significant differences, P0.05.
MDA含量是反映机体抗氧化潜在能力的重要参数,可以反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度[29]。已有研究发现,暴露于BDE-47的太平洋真宽水蚤(Eurytemorapacifica)和日本虎斑猛水蚤(TigriopusjaponicusMori)的MDA含量随其浓度的升高而增加[30];暴露于BDE-47的剑尾鱼肝脏MDA含量随浓度升高而增加[31];暴露于BDE-209的双叶杜鹃叶片的MDA随其浓度升高而增加[32]。本实验结果表明,5 ng·L-1浓度组中MDA含量无显著变化,说明环境浓度BDE-47和BDE-153不会对半滑舌鳎MDA产生显著影响;500 ng·L-1浓度组中MDA含量迅速升高,说明肝脏中抗氧化系统已不足以消除过量的自由基,肝脏受到损伤,导致MDA在肝脏中积累,含量迅速增加,但随着暴露时间的延长,体内的抗氧化系统被激活,MDA被逐渐清除,使得其含量降低到正常水平,但MDA含量在高浓度组中暴露15 d时仍显著高于对照组(P<0.05),其原因可能是由于长时间的高浓度暴露,使其体内抗氧化系统的解毒能力受损,导致MDA在肝脏中积累而无法清除。
2.5 BDE-47和BDE-153对半滑舌鳎肝脏ER含量的影响
BDE-47和BDE-153对半滑舌鳎肝脏ER含量的影响如图5所示。空白对照组半滑舌鳎肝脏ER含量基本保持不变,溶剂对照组的ER含量基本保持不变,与空白对照组无显著差异。在BDE-47暴露下,5 ng·L-1浓度组ER含量在15 d内无显著变化,1 d中不同浓度组ER含量相差不大;随时间增长,500 ng·L-1浓度组中ER含量逐渐升高,在3 d后显著高于对照组;50 000 ng·L-1浓度组中ER含量从1 d开始随时间逐渐升高,且显著高于对照组。在BDE-153暴露下,5 ng·L-1浓度组ER含量在15 d内无显著变化,1 d中不同浓度组ER含量相差不大,但随时间增长,500 ng·L-1浓度组中ER含量逐渐升高,在7 d以后与对照组有显著差异;50 000 ng·L-1浓度组中ER含量从3 d开始与对照组有显著差异。
ER主要有2种亚型,可通过参与雌性脊椎动物中性腺组织基因的表达与调控,从而进一步影响雌性的第二性征、繁殖周期、生殖力及妊娠[33]。ER选择性激活剂注射实验证明,ER可以反馈抑制促性腺激素的表达[34]。目前,已有研究发现,BDE-47可以干扰细胞内ER从而影响雌激素相关基因的表达,产生内分泌毒性[35];Dang等[36]也发现,BDE-47暴露可降低猪卵巢滤泡细胞中ER,从而加强了雌激素对卵巢的刺激作用,干扰动物性激素的作用。

图5 BDE-47和BDE-153对半滑舌鳎肝脏雌激素受体(ER)含量的影响(n=3)注:*表示显著性差异,P0.05。Fig. 5 Effects of BDE-47 and BDE-153 on the content of estrogen receptor (ER) in liver of Cynoglossus semilaevis Gunther (n=3)Note: * indicates significant differences, P0.05.
2.6 BDE-47和BDE-153对半滑舌鳎肝脏EROD活性的影响
BDE-47和BDE-153对半滑舌鳎肝脏EROD活性的影响如图6所示。空白对照组半滑舌鳎肝脏EROD活性基本保持不变,溶剂对照组的EROD活性基本保持不变,与空白对照组无显著差异。在BDE-47暴露下,5 ng·L-1浓度组EROD活性在15 d内无显著变化,1 d中不同浓度组EROD活性相差不大,但随时间增长,500 ng·L-1和50 000 ng·L-1浓度组中EROD活性逐渐升高,在7 d时到达峰值,后在15 d时略有降低,均与对照组有显著差异。在BDE-153暴露下,5 ng·L-1浓度组EROD活性在15 d内无显著变化,1 d中不同浓度组EROD活性相差不大,但随时间增长,500 ng·L-1和50 000 ng·L-1浓度组中EROD活性逐渐升高,在7 d时到达峰值,后在15 d时略有降低,但均与对照组有显著差异。

图6 BDE-47和BDE-153对半滑舌鳎肝脏7-乙氧基-3-异吩唑酮脱乙基酶(EROD)活性的影响(n=3)注:*表示显著性差异,P0.05。Fig. 6 Effects of BDE-47 and BDE-153 on 7-ethoxyresorufin-o-deethylase (EROD) activity in liver of Cynoglossus semilaevis Gunther (n=3)Note: * indicates significant difference, P0.05.
海洋鱼类混合功能氧化酶的典型反应为包括芳烃羟化酶和EROD的反应,其中,EROD的反应更具代表性。在正常环境中,生物体内混合功能氧化酶的活性相对较低,但在外来某些特定的化学污染物的诱导下,它的活性异常增高[37]。结果表明,5 ng·L-1浓度组EROD活性无显著变化,说明环境浓度剂量下的BDE-47和BDE-153不会对半滑舌鳎EROD活性产生显著影响;500 ng·L-1和50 000 ng·L-1浓度组EROD活性都随暴露时间的增长而不断升高。目前,有研究表明,PBDEs对生物体内的EROD活性有影响,如McDonald[38]在研究BDE-71对雄性大鼠(Rattusnorvegicus)的毒性效应时,发现大鼠体内EROD活性增加。Eggens等[39]在研究红鲻鱼(Limandalimanda)体内的EROD活性时发现,鱼体肝脏内多氯联苯(PCB-28)的浓度与EROD活性存在良好的正相关关系。
2.7 IBR分析
由于各种酶活性在污染胁迫下,既有抑制,又有诱导,而且各种酶在生物毒性暴露响应中具有不同步性,表明不同的酶对污染物刺激的敏感程度有所差异,所以单一的酶活性不能很好地定量评价污染状况。应该将各种酶以及其他的生物标志物结合起来,运用IBR指数消除随机误差和变化,才能准确客观地评估海洋环境的污染状况[40-41]。IBR值越大,表明生物受到的影响越大[42]。本文选择SOD、CAT、GSH-Px、MDA、ER和EROD这6个指标进行整合,进行IBR分析。BDE-47和BDE-153暴露15 d时半滑舌鳎肝脏的星状图及IBR值如图7所示,BDE-47和BDE-153的IBR值呈现出显著的剂量效应,浓度越高,IBR值越大,表明BDE-47和BDE-153对半滑舌鳎生物体产生的毒性越大。另外,不同浓度BDE-47的IBR值均大于BDE-153组,这表明低溴代的BDE-47的毒性要高于高溴代的BDE-153。谢嘉[43]运用IBR模型评估BDE-47对牡蛎(Ostreagigasthunberg)的复合毒性效应,发现不同站位的长牡蛎组织中,生物标志物的响应值存在较大的空间差异。Kim等[44]运用IBR模型评估全氟辛烷磺酸和全氟辛酸对鱼类的毒性效应,发现全氟辛烷磺酸的毒性效应要高于全氟辛酸。Zheng等[14]运用IBR对污染物进行毒性效应比较,发现邻苯二甲酸二环己基酯毒性最大,邻苯二甲酸二乙酯毒性最小。Xie等[45]研究了BDE-209及其与BDE-47和BDE-99的混合物对金鱼(Carassiusauratus)的毒性效应,并测定了暴露4 d后的SOD等酶活生物标志物,运用IBR模型将多个生物标志物进行整合计算,用于定量评估不同PBDEs同系物的毒性效应:BDE-47>BDE-99>BDE-209。综上所述,IBR模型能够有效地对PBDEs的海洋环境风险进行科学评价。

图7 BDE-47和BDE-153暴露下半滑舌鳎的综合生物标志物响应指数(IBR)星状图和数值Fig. 7 The integrated biomarker response (IBR) star-shaped diagram and values of Cynoglossus semilaevis Gunther after exposure to BDE-47 or BDE-153
◆
