抗生素的胁迫与抗生素抗性基因产生与传播关系的研究
2020-11-13卢文强孙昊宇王雅娟林志芬张饮江
卢文强,孙昊宇,王雅娟,林志芬,张饮江,*
1. 上海海洋大学海洋生态与环境学院,上海 201306 2. 同济大学环境科学与工程学院,污染控制与资源化研究国家重点实验室,上海 200092
抗生素作为一类可抑制微生物生长和繁殖,甚至杀死微生物的自然产生、部分合成或全合成的化合物,现已广泛应用在医疗卫生与畜牧养殖业中,用于治疗或预防细菌感染以及促进畜牧业的增长等[1]。然而,抗生素的过度使用,导致水体[2-3]、土壤[4]和空气[5]中残留的抗生素不断累积,不仅对生物体有潜在的毒性作用,更严重的是导致环境中抗生素抗性基因(antibiotics resistance genes, ARGs)的增加[6]。ARGs能够降低抗生素对细菌感染的治疗潜力,致使细菌感染的人和动物的死亡率上升[7-8]。目前,ARGs已被公认为新兴和持久的环境污染物,如果ARGs持续累积得不到有效控制,到2050年每年可能导致1千万人死于ARGs污染[9]。因此,研究ARGs污染来源,深入探究ARGs污染机理,对采取更为有效的防治措施至关重要。
目前,有研究表明,抗生素是ARGs污染的主要驱动力[10]。例如,Zhao等[11]发现在活性污泥反应器中抗生素与相应的ARGs丰度相关。Zhang等[12]研究发现,我国温榆河及其支流耐药大肠杆菌(Escherichiacoli,E.coli)的数量与残留抗生素水平呈正相关关系。Rodriguez-Mozaz等[13]调查了医院和城市废水中残留抗生素和ARGs的发生情况,发现检测到的残留抗生素与ARGs呈显著正相关。然而,与此相反,还有一些研究表明,环境中残留的抗生素与ARGs的污染无关。例如,在美国东北部一个未经处理的混合粪肥坑中,研究者发现,四环素抗性基因(tetO)的浓度与四环素浓度无关[14]。此外,Jia等[15]研究了巴河中残留抗生素与ARGs的相关性,研究表明,残留的抗生素与它们相应的ARGs无明显相关性。因此,ARGs污染与抗生素关系究竟如何,还需要进一步探究。
众所周知,ARGs污染源于ARGs的产生和传播。ARGs的产生主要来源于抗生素诱导的细菌基因突变,在细菌增殖过程中,亲代细胞中的ARGs可遗传给子代细胞[16]。而ARGs在细菌之间的传播主要由水平基因转移引起。水平基因转移是遗传物质通过可移动的遗传因子(质粒、转座子和整合子等)在种内或种间的转移,包括接合,转化和转导[17]。然而,转化和转导这2种转移方式因发生的条件较为苛刻,发生转化的条件是细菌需建立感受态,在自然环境中不是所用的细菌都能建立感受态,并且,细菌建立感受态的条件较为苛刻,所以转化在自然环境中发生频率较少,例如,E.coli被认为在自然条件下无法建立感受态,然而,在低温下,用钙离子处理时可以建立感受态[18-19];转导是病毒介导的细胞间进行遗传转移,噬菌体转导不需要裸露的DNA,而是噬菌体介导了两宿主之间的DNA重组,所以,转导发生频率低[18,20];接合在环境中较容易发生,既可以在细菌之间发生,也可以在细菌与介质之间发生,其也就成为环境中细菌水平基因转移主要方式[21]。因此,研究抗生素对ARGs突变和接合转移的影响可能是探讨ARGs污染与抗生素关系的重要途径。
磺胺类药物(SAs)作为一种人工抗生素已被广泛应用于药物治疗和饲料添加[22]。近10年来,我国主要河流和海域的水和沉积物中检出的近百种抗生素中,磺胺类抗生素是检出率最高的抗生素之一[9]。在本研究中,选择了SAs作为代表性的测试化合物,探讨了在实验室条件下ARG的产生与传播与抗生素胁迫之间的关系,并且用SAs对E.coli生长的毒性作用表征SAs对E.coli的胁迫,用ARGs的突变和接合转移表征ARGs的产生和传播。探讨ARGs的产生和传播与抗生素胁迫之间的关系,并分析影响抗生素胁迫与ARGs产生和传播关系的环境因素等,为研究ARGs污染与抗生素的关系提供新的思路,对ARGs污染防治措施提供一定的理论支撑和依据。
1 材料与方法(Materials and methods)
1.1 化学品与受试生物
实验用的E.coliMG1655购自北京谱如汀生物技术有限公司。在质粒接合转移实验中,含有RP4质粒(能够编码bla、aphA、tetA和tetR基因)的E.coli(RP4)被设定为供体菌(耐卡那霉素、氨苄青霉素和四环素),而能够耐萘啶酮酸的E.coli(Nal)被设定为受体菌。
实验用的磺胺类化合物购于Sigma-Aldrich化学制品有限公司(上海),纯度均≥99%,试剂信息如表1所示。用二甲基亚砜(DMSO)改善SAs在样品中的溶解度,并且DMSO在样品中的浓度<0.1%。

表1 实验用化合物性质Table 1 Characteristics of the test chemicals
1.2 培养基
LB培养基:取10 g胰蛋白胨、5 g酵母提取物和10 g NaCl于烧杯中,加入一定量的蒸馏水进行水浴加热,至成分完全溶解后冷却,用蒸馏水定容至1 L,最后将培养基的pH调整至7.1±0.1。之后将培养基分装、灭菌,于4 ℃下保存备用。
MH培养基:取2 g牛肉浸粉、17.5 g酸水解酪蛋白和1.5 g水溶性淀粉于烧杯中,加入一定量的蒸馏水进行水浴加热,至成分完全溶解后冷却,用蒸馏水定容至1 L,最后将培养基的pH调整至7.2~7.4。之后将培养基分装、灭菌,于4 ℃下保存备用。
1.3 毒性实验
首先,在透明96孔板中加入80 μL的SAs(作为实验组)或质量分数为1%的NaCl溶液(作为对照组),80 μL的0.4倍MH培养基(0.4倍为总体积的最终倍数)和40 μL准备好的细菌(约为1×104cells·mL-1),在37 ℃、180 r·min-1培养22 h,所有毒性试验均为一式3份。在酶标仪(Multiskan GO,美国赛默飞世尔科技公司)上测定实验组和对照组的OD600值,毒性结果计算如式(1)所示:
(1)
式中:Inhibition表示SAs对细菌生长的抑制率(%);ODt和ODc分别表示实验组和对照组的OD600值。使用Weibull函数(Origin8.6)拟合数据。
1.4 突变实验
突变实验的培养条件与毒性试验相同。在37 ℃培养22 h后,收集平行孔中的菌液,将收集的菌液一部分稀释106倍,剩余的部分浓缩3倍。稀释后的菌液在不含有任何抗生素的LB培养基平板上进行培养,对照组和实验组皆为5组平行。计算总菌数(CFU·mL-1),浓缩的菌液充分混匀后在含有25 mg·L-1利福平的LB培养基平板上进行利福平抗性突变体的筛选,计算突变体个数(CFU·mL-1)。
突变次数使用MM法(MSS maximum likelihood)计算[23]。根据式(2)和(3)计算突变频率和变频率促进率:
(2)
(3)
式中:M为暴露于SAs的细菌突变频率;m为突变体个数(CFU·mL-1);Nt表示培养物中活细胞的总数(CFU·mL-1);Promotion1表示突变频率促进率(%);Mt和Mc分别代表实验组和对照组的突变频率。最后,利用Hormesis模型(Origin8.6)对突变数据进行拟合。
1.5 接合转移实验
将E.coli(RP4)菌液和E.coli(Nal)菌液按1∶2的比例混合20 min。接合转移体系的总体积是200 μL,包括40 μL SAs溶液(实验组)或质量分数为1%的NaCl溶液(对照组),60 μL混合菌液和100 μL 2倍LB培养基,充分摇匀在37 ℃下培养8 h,对照组和实验组皆有3组平行。然后用质量分数为1%的NaCl溶液适当稀释混合菌液并摇匀,分别在受体菌筛选平板(含有40 mg·L-1萘啶酮酸)和接合子筛选平板(含有40 mg·L-1萘啶酮酸和40 mg·L-1卡那霉素)倾注,于37 ℃下倒置培养12 h后计算受体菌数(CFU·mL-1)和接合子数(CFU·mL-1)。根据式(4)和式(5)计算接合转移频率和接合转移频率促进率:
(4)
(5)
式中:T为接合转移频率;Nc是接合子数(CFU·mL-1);Nr为受体菌数(CFU·mL-1);Promition2为接合转移频率促进率(%);Tt和Tc分别为实验组和对照组的接合转移频率。最后,利用Hormesis模型(Origin8.6)拟合接合转移数据。
1.6 数据分析
采用SPSS18.0软件进行线性回归分析,通过相关系数(r2)、标准误差(SE)、Fisher统计(F)和显著性水平(P)来评价。
2 结果与讨论(Results and discussion)
2.1 SAs对E. coli生长的毒性作用
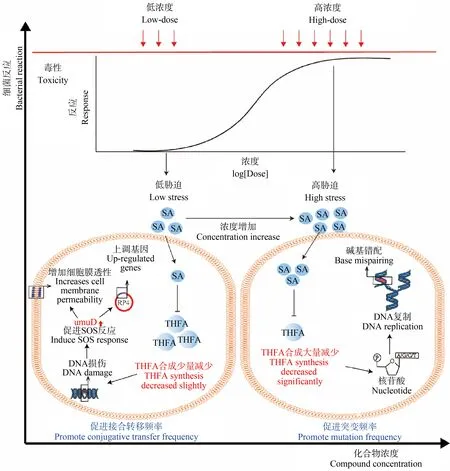
如图1(a)所示,SAs对E.coli生长毒性剂量-效应曲线呈现典型的S型,说明SAs对E.coli生长的抑制率随着SAs浓度的增加而逐渐增大。根据毒性剂量-效应曲线,计算了SAs对E.coli生长的半数抑制浓度(EC50)(表1)。SAs的EC50顺序为:SPY 图1 磺胺类药物(SAs)对E. coli的生长毒性剂量-效应曲线注:(a)毒性;(b)突变频率;(c)接合转移频率。Fig. 1 The concentration-response curves for sulfonamides (SAs) effect on E. coli growthNote: (a) the growth; (b) the mutation frequency; (c) the conjugative transfer frequency. 为了探究SAs胁迫与ARGs在E.coli中产生和传播的关系,根据毒性剂量-效应曲线选择了典型的毒性参数,包括无观察效应浓度(NOEC),EC50和抑制率80%的化合物浓度(EC80)。NOEC、EC50和EC80的对数值如表2所示。 表2 SAs对E. coli生长、突变和接合转移作用的典型参数值Table 2 The typical concentration values of SAs to the growth, mutation, and the conjugative transfer of E. coli 如图1(b)所示,SAs促进E.coli突变频率的剂量-效应曲线呈倒U型,表明SAs对E.coli突变频率的促进率随SAs浓度的增加先升高后降低。最大促进率的顺序为SMZ(83.58%) 根据SAs促进E.coli突变频率的剂量-效应曲线,本研究选取了典型的突变参数,包括促进率为1%时最低可观测突变促进效应浓度(MC0-1)、促进率为50%时突变促进效应浓度(MC50)和促进率最大时突变促进效应浓度(MCmax),并且MC0-1、MC50和MCmax的对数值如表2所示。 由图1(c)可知,SAs促进E.coli接合转移频率的剂量-效应曲线呈现典型的倒J型。随着SAs浓度的增加,接合转移促进率的提升先增大后减小。最大促进率的顺序为SMZ(29.18%) 图2 SAs对E. coli的作用机理注:(a)抑制生长;(b)促进突变频率;(c)促进接合转移频率;PABA表示对氨基苯甲酸,DHPS表示二氢蝶酸合成酶,DHFR表示二氢叶酸还原酶,DHFA表示二氢叶酸,THFA表示四氢叶酸。Fig. 2 The mechanistic hypothesis for SAs effect on E. coliNote: (a) the growth inhibition; (b) the promotion of the mutation frequency; (c) the promotion of the conjugative transfer frequency; PABA stands for para-aminobenzoic acid; DHPS stands for dihydropteroate synthase; DHFR stands for dihydrofolate reductase; DHFA stands for dihydrofolic acid; THFA stands for tetrahydrofolic acid. 典型的接合转移参数包括促进率为1%时最低可观测接合转移促进效应浓度(RC0-1)、促进率最大时接合转移促进效应浓度(RCmax)和促进率为1%时最高可观测接合转移促进效应浓度(RC0-2),RC0-1、RCmax和RC0-2的对数值如表2所示。 通过毒性参数(NOEC、EC50和EC80)与突变参数(MC0-1、MC50和MCmax)的线性回归,探讨SAs胁迫与E.coli突变频率之间的关系,回归方程如式(6)~(14)。 logMC0-1=0.391logNOEC-3.369 n=5,r2= 0.437, SE=0.174,F=2.327,P=0.225 (6) logMC50=0.152logNOEC-4.755 n=5,r2=0.351, SE=0.081,F=1.624,P=0.292 (7) logMCmax=0.109logNOEC-4.767 n=5,r2=0.050, SE=0.185,F=0.159,P=0.717 (8) logM0-1=0.346logEC50-3.886 n=5,r2=0.529, SE=0.158,F=3.367,P=0.164 (9) logMC50=0.156logEC50-4.820 n=5,r2=0.577, SE=0.065,F=4.094,P=0.136 (10) logMCmax=0.045logEC50-5.221 n=5,r2=0.014, SE=0.188,F=0.041,P=0.852 (11) logM0-1=0.313logEC80-4.180 n=5,r2=0.635, SE=0.139,F=5.214,P=0.107 (12) logMC50=0.125logEC80-5.047 n=5,r2=0.544, SE=0.068,F=3.578,P=0.115 (13) logMCmax=0.027logEC80-5.344 n=5,r2=0.027, SE=0.189,F=0.021,P=0.895 (14) 根据以上的回归结果可知,EC80与MC0-1回归的r2为0.64,是这些方程中最高的,说明EC80与MC0-1的相关性更好。结合图2(a)和图2(b),分析EC80与MC0-1之间相关的可能机理如下(图3):较高的SAs胁迫作用可能会导致THFA的合成大大减少,从而限制了核苷酸碱基的产生;同时,碱基对错配的概率可能由于核苷酸碱基的减少而大大增加,最终导致E.coli突变频率的提高[29]。此外,任何细菌在接近抗生素最低抑菌浓度(MIC)时,可以获得突变的最大选择压力,这说明突变在高压力下发生得更多[16]。此外,大多数细菌的染色体中都含有丰富的毒素-抗毒素(TA)系统[37]。在低SAs胁迫下,TA系统可能为细菌种群提供耐受性,并保护细菌免受基因突变的影响[38]。因此,只有当SAs对E.coli施加更大的压力时,SAs才可能导致E.coli突变频率促进率增加。 2.4.2 SAs的胁迫与E.coli中ARGs接合转移频率的关系 通过毒性参数(NOEC、EC50和EC80)与接合转移参数(RC0-1、RCmax和RC0-2)的线性回归,探讨SAs胁迫与E.coli接合转移频率之间的关系,回归方程如式(15)~(23)。 logRC0-1=- 1.052logNOEC-16.240 n=5,r2=0.532, SE=0.386,F= 3.410,P=0.162 (15) logRCmax=-0.732logNOEC-12.319 n=5,r2=0.115, SE=0.793,F=0.391,P=0.576 (16) logRC0-2=-0.967logNOEC-11.949 n=5,r2=0.276, SE=0.612,F=1.146,P=0.363 (17) logRC0-1=- 0.621logEC50-12.953 n=5,r2=0.286, SE=0.476,F=1.204,P=0.353 (18) logRCmax=-0.179logEC50-8.486 n=5,r2= 0.011, SE=0.839,F=0.032,P=0.869 (19) logRC0-2=-0.428logEC50-8.058 n=5,r2=0.084, SE=0.689,F=0.275,P=0.636 (20) logRC0-1=- 0.448logEC80- 11.761 n=5,r2=0.218, SE=0.499,F=0.837,P=0.428 (21) logRCmax=-0.023logEC80-7.525 n=5,r2=0.000, SE=0.843,F=0.001,P=0.980 (22) logRC0-2=-0.260logEC80-6.949 n=5,r2=0.045, SE= 0.703,F=0.142,P=0.731 (23) 由以上回归方程可知,NOEC与RC0-1回归的r2值最高,为0.53,说明NOEC与RC0-1的相关性较好。根据图2(a)和图2(c),分析了NOEC与RC0-1之间的密切关系如下(图3):在低SAs胁迫下,THFA合成受阻可能导致DNA损伤,从而触发细胞SOS反应,最终促进RP4质粒的接合转移[39]。此外,umuDC操纵子被认为是维持SOS应答的关键因素,高SAs胁迫可能导致umuD蛋白和umuC的损伤,从而抑制SOS反应[39]。因此,只有当SAs对E.coli施加较低的压力时,才会导致其对接合转移频率的提升率增加。 图3 SAs胁迫与突变和接合转移的关系Fig. 3 The relationship of mutation and conjugative transfer with the SAs stress 综上所述,本研究认为ARGs的产生和传播可能受到不同水平的抗生素胁迫的调控(图3):当高浓度抗生素胁迫引起突变频率的初始提升时,低浓度抗生素胁迫引起接合转移频率的初始提升。然而,正如引言中提到的,一些研究人员对ARGs和抗生素之间的关系得出了不同的结论。环境中ARGs与抗生素浓度之间关系的不一致性可能是由2个因素造成的: (1)不同的抗生素浓度。不同的环境条件下,抗生素浓度可能有很大的差异,这导致抗生素对细菌的胁迫大小不同,从而导致环境中ARGs的产生和传播存在差异。 (2)在环境中可能的影响因素。在实际环境中,有许多因素影响抗生素胁迫与ARGs的产生和传播的关系:①真实环境中存在许多抗生素外的其他种类的化合物可以影响ARGs的产生和传播。例如,重金属的亚抑制浓度,包括Cu(Ⅱ)、Ag(Ⅰ)、Cr(Ⅵ)和Zn(Ⅱ)都可以促进ARGs的产生和传播[34]。②传播介质的不同可能导致ARGs的传播发生变化。例如,SMX促进的pB10质粒在活性污泥中的传播速率远远高于其促进pB10质粒在细菌之间的传播速率[40]。此外,还有研究表明,低温和高盐度会阻碍ARGs的产生和传播[15]。③不同菌种ARGs的产生和传播可能相互干扰。例如,有研究发现,来自其他细菌物种的水平基因转移也会增加E.coli对抗生素的耐药性[41]。 本研究发现,ARGs产生与传播和抗生素胁迫之间是密切相关的。然而,在真实环境中也存在许多其他因素影响ARGs产生与传播,例如,其他种类化合物、环境介质以及细菌种类等。因此,建议在探究ARGs产生与传播时,应考虑这些影响因素和抗生素胁迫的综合作用。本研究为研究抗生素胁迫下ARGs的产生和传播提供了新的思路,为寻找ARGs污染的防治方法提供了一定的指导。 ◆

2.2 SAs对E. coli突变频率的影响
2.3 SAs对E. coli接合转移频率的影响

2.4 SAs的胁迫与ARGs在E. coli中产生和传播的关系2.4.1 SAs的胁迫与E. coli中ARGs突变频率的关系
2.5 影响抗生素胁迫与ARGs产生和传播关系的因素
