高效液相色谱法测定食用植物油中6种真菌毒素
2020-11-13徐洪文孙嘉笛孙秀兰
徐洪文,朱 瑜,徐 华,孙嘉笛,纪 剑,孙秀兰,张 瑶
(1.江南大学 食品科学与技术国家重点实验室,食品安全与营养协同创新中心,江苏 无锡 214122;2.广州广电计量检测股份有限公司,广州 510627; 3.汉中市质量技术检验检测中心,陕西 汉中 723000)
食用植物油因油料作物生长、收获及油脂精炼、储存和消费过程中受到异常气候、储藏环境和运输条件等影响造成的真菌污染而容易产生有害的真菌毒素[1]。食用植物油中常见的真菌毒素有黄曲霉类毒素、单端孢霉烯族类毒素、伏马类毒素、赭曲霉类毒素等[2-4]。大多数的真菌毒素具有肝毒性、致畸性、致癌性、肾毒性、出血性、破坏免疫系统及生殖系统等危害[5],摄入量超过一定限量后,会危害人类及其他生物健康,甚至危害生命[6]。因此,检测食用植物油中真菌毒素对食品安全监管及疾病预防控制具有重要意义。
目前,食用植物油中真菌毒素的检测方法主要有薄层层析色谱法[7]、高效液相色谱法(HPLC)[8]、液相色谱-质谱联用[9-12]、气相色谱-质谱联用[13-14]、酶联免疫吸附法和胶体金免疫层析法[15]等。薄层层析色谱法灵敏度低、重现性较差,其应用受到一定的限制;酶联免疫吸附法半定量筛查检测,其假阳性率高,不能作为确证实验;相对来说HPLC方法较为简便实用,仪器普及易于推广。
真菌毒素样品前处理方法主要有液液萃取法、固相萃取法(SPE)、免疫亲和层析法、QuEChER法、直接稀释法、分散液液微萃取法(OLLME)[16-17]。其中,SPE(包括IAC和MFC)是应用最广泛、技术最成熟的一种前处理方法,但通常SPE操作过程烦琐、所需时间较长,材料成本较高。目前,这些前处理方法对一种或一类真菌毒素提取效果好,但对食用植物油中多种真菌毒素同步提取的研究较少,因此需要建立一种能够有效、同步检测食用植物油中多种真菌毒素的方法。本研究建立了一种能够同时测定食用植物油中多种真菌毒素的高效液相色谱-荧光检测分析方法(HPLC-FLD),在样品前处理方面,对分散液液微萃取技术(DLLME)进行改进和条件优化,以增加其在食用植物油中的适用性,为完善食用植物油的真菌毒素检测和质量控制提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
5种食用植物油(大豆油、玉米油、菜籽油、花生油以及食用调和油)共28个样,市售。黄曲霉毒素B1(AFB1)标准品(纯度≥99%)、黄曲霉毒素B2(AFB2)标准品(纯度≥99%)、黄曲霉毒素G1(AFG1)标准品(纯度≥99%)、黄曲霉毒素G2(AFG2)标准品(纯度≥99%)、赭曲霉毒素A(OTA)标准品(纯度≥99%)、赭曲霉毒素B(OTB)标准品(纯度≥99%),购于Sigma-Aldrich公司;乙腈、甲醇,色谱纯,购于上海国药集团;正己烷、三氯甲烷、石油醚、乙酸,分析纯,购于上海国药集团;甲酸,色谱级,购于阿拉丁公司;三氟乙酸,分析纯,购于上海麦克林公司。
1.1.2 仪器与设备
Agilent 1260高效液相色谱仪(荧光检测器(FLD),美国Agilent公司;Lab Dancer旋涡仪;SCIENTZ-10LS真空离心浓缩仪;SCIENTZ-10N普通型冷冻干燥机; Centrifuge 5424 R高速冷冻离心机,美国Eppendorf公司;SCIENTZ-5200 DTD超声波清洗机;Milli-Q超纯水纯化系统,美国Millipore公司;DZF-6096真空干燥箱;LC-DCY-24G干式氮吹仪;电热恒温鼓风干燥箱。
1.2 实验方法
1.2.1 色谱条件
Agilent XDB-C18色谱柱(4.6 mm×150 mm, 3.5 μm);柱温40℃;流动相流速0.6 mL/min;进样量10 μL;荧光检测器。
1.2.2 标准溶液的制备
用甲醇将各标准品配制成一定质量浓度的储备液,分别准确吸取6种标准储备液适量,用甲醇-乙腈(体积比50∶50)稀释得AFB1、AFB2、AFG1和AFG2质量浓度均为1.00、2.00、5.00、10.00、25.00、50.00 μg/L,OTA和OTB质量浓度均为2.00、4.00、10.00、20.00、50.00、100.00 μg/L的混合标准工作液。
1.2.3 样品前处理
1.2.3.1 样品提取
参考吴宇等[18]的样品提取方法。准确称取5.0 g(精确至0.01)油样放入50 mL离心管中,再加入10 mL石油醚,涡旋混匀1 min,加提取液乙腈-水-乙酸(体积比84∶15∶1)10 mL,涡旋1 min后,超声提取20 min,静置,室温下8 000 r/min离心10 min,取下层提取液置于15 mL离心管中,待用。取上述提取液1 mL于10 mL离心管中,加等体积的水,涡旋1 min,静置,4℃、12 000 r/min下离心10 min,取上清液过膜备用。
1.2.3.2 DLLME步骤
取1 mL三氯甲烷(用作萃取剂)加入1 mL 1.2.3.1 过膜后的提取液(用作分散剂),充分混匀。将混合物迅速注入装有5 mL超纯水(pH 3)的离心管中,萃取剂、分散剂与水相充分混合,将混合溶液涡旋振荡1 min,然后6 000 r/min、室温离心10 min后,将离心管底部三氯甲烷取出,重复上述操作,反复萃取3次,萃取液经氮气(40℃,1 mL/min)吹干后,供柱前衍生化。
1.2.3.3 柱前衍生化
在1.2.3.2盛有残留物的离心管中加入衍生试剂200 μL正己烷和100 μL三氟乙酸,振荡30 s,40℃烘箱条件下衍生化15 min。衍生化后的溶液经氮气(40℃,1 mL/min)吹干,残留物用200 μL乙腈复溶,涡旋混匀后供高效液相色谱仪分离检测。
2 结果与分析
2.1 色谱条件的优化
2.1.1 流动相的选择
A相选择甲醇、乙腈,B相选择0.05%甲酸、0.05%乙酸、0.05%三氟乙酸,设计6组实验。根据6组实验结果比较可知,乙腈作为流动相A时,由于具有强洗脱能力使得各组分保留时间较短,分离度较差,而甲醇的洗脱能力较弱,6种真菌毒素都能进行基线分离,各组分保留时间适中,同时分别对含相同比例不同酸的水溶液流动相进行比较,发现0.05%乙酸作为B相时,OTA和OTB分离度较低,并且目标峰的峰形不佳,而0.05%三氟乙酸作为B相时,基线扰动较大,且存在拖尾的现象,选择0.05%甲酸作为B相时各组分能够很好地分离,且基线扰动较小,因此选择甲醇作为A相,0.05%甲酸作为B相时,6种真菌毒素能够达到很好的分离效果。为了提高分析检测效率,缩短检验时间,本研究进一步考虑采用梯度洗脱,经过实验确定最佳的流动相梯度洗脱程序见表1。

表1 流动相梯度洗脱程序
2.1.2 检测波长的选择
取200 μL质量浓度为25 μg/L的AFB1、AFB2、AFG1、AFG2和200 μL质量浓度为50 μg/L的 OTA和OTB标准品溶液,分别进行各毒素全波长扫描,优化确定同步检测的波长。AFB1、AFB2、AFG1、AFG2最佳激发波长360~380 nm,AFB1和AFB2最佳发射波长450 nm,AFG1和AFG2最佳发射波长470 nm,确定4种黄曲霉毒素的激发波长为365 nm,发射波长为460 nm;OTA和OTB激发波长为327 nm,发射波长为460 nm,有利于提高分析的灵敏度。
2.2 提取过程的优化
以下优化实验样品AFB1、AFB2、AFG1和AFG2加标量5 μg/kg、OTA和OTB加标量10 μg/kg。
2.2.1 提取液的选择及比例优化
多数的真菌毒素易溶于甲醇、乙腈等极性有机溶剂[19],因此植物油中真菌毒素的提取溶剂一般选用甲醇或乙腈或两种溶剂的混合溶液。以玉米油为例,本研究考察了甲醇-水-乙酸(体积比84∶15∶1)、甲醇-水-甲酸(体积比84∶15∶1)、乙腈-水-乙酸(体积比84∶15∶1)、乙腈-水-甲酸(体积比84∶15∶1)、甲醇-水(体积比84∶16)、乙腈-水(体积比84∶16)6种常见的提取液对玉米油中6种真菌毒素加标回收率的影响,结果见图1。

图1 不同提取液对食用植物油中6种真菌毒素加标回收率的影响
由图1可知,乙腈-水-乙酸(体积比84∶15∶1)对食用植物油中6种真菌毒素的加标回收率均较好,因此选择乙腈-水-乙酸(体积比84∶15∶1)作为最佳提取液。然后,进一步对乙腈-水-乙酸的比例进行了优化,真菌毒素加标回收率结果见表2。

表2 提取液比例对食用植物油中6种真菌毒素加标回收率的影响
由表2可以看出,当采用乙腈-水-乙酸(体积比84∶15∶1)提取时,6种真菌毒素的加标回收率在82.25%~92.85%之间,因此实验采用乙腈-水-乙酸(体积比84∶15∶1)作为油样中真菌毒素检测的提取液。
2.2.2 提取方式的选择
以玉米油为例,考察高速均质(12 000 r/min,5 min)、涡旋振荡(10 min)、超声(20 min)、摇床(20 min)4种提取方式对玉米油中6种真菌毒素加标回收率的影响,以确定最佳的提取方式,结果如图2所示。

图2 不同提取方式对食用植物油中6种真菌毒素加标回收率的影响
由图2可知,超声提取对食用植物油中6种真菌毒素加标回收率均在80%以上,加标回收率高于涡旋振荡、摇床和高速均质。对于油样中真菌毒素的提取,高速均质难以操作,且会造成样品量损失,摇床和涡旋振荡两种提取方式效率较低,超声提取加标回收率高,因此本研究选取超声作为样品中真菌毒素的提取方式。
2.3 DLLME条件的优化
在DLLME萃取过程中,萃取剂种类显著影响萃取效率,通常要求萃取剂有适合的极性、对待测物有良好的溶解度。因此,以玉米油为例,对几种不同密度、极性的卤代烃的萃取效果进行了考察,包括CH2Cl2、CHCl3和CCl4。对玉米油进行加标实验,AFB1、AFB2、AFG1和AFG2加标量5 μg/kg、OTA和OTB加标量10 μg/kg。1.0 mL提取液中加入5.0 mL水(pH 3)和1.0 mL待评估有机溶剂(萃取剂),每组实验设置3次平行,真菌毒素加标回收率结果如图3所示。
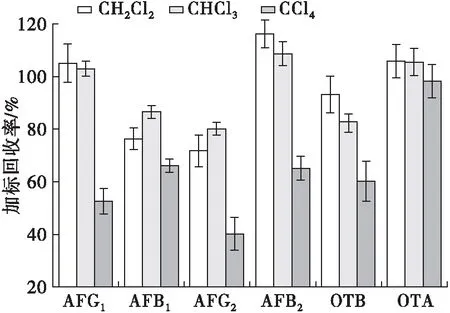
图3 DLLME不同萃取剂对食用植物油中6种真菌毒素加标回收率的影响
由图3可知:CCl4作为萃取剂时各真菌毒素的加标回收率除OTA高于80%外,其余均低于80%,可不予考虑;尽管CH2Cl2作为萃取剂时AFB2、AFG1、OTB和OTA回收率较高, 但与CHCl3萃取效果比较不显著,CHCl3作为萃取剂时AFB1、AFG2的加标回收率优于CH2Cl2的。因此,本实验采用CHCl3作为DLLME过程的萃取剂。
2.4 柱前衍生化对真菌毒素检测信号响应的影响
对6种混合真菌毒素进行柱前衍生化,AFB1、AFB2、AFG1和AFG2质量浓度为25 μg/L,OTA和OTB质量浓度为50 μg/L,6种真菌毒素在衍生化前后的标准品色谱图比较见图4。
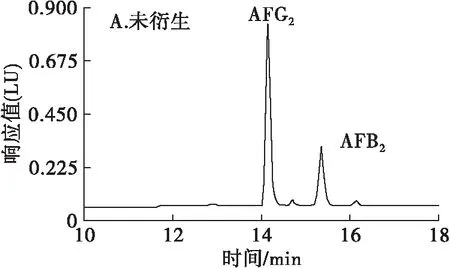

由图4A和图4B可知,6种真菌毒素标准溶液未进行柱前衍生化直接检测时得到的色谱图中,AFG2、AFB2、OTA和OTB均有较高的荧光响应,而AFG1和AFB1荧光响应非常弱,在色谱图中几乎看不到二者的色谱峰。由图4C和图4D可知,6种真菌毒素的标准溶液进行柱前衍生化后,AFB1和AFG1的荧光信号大幅增强,其他4种真菌毒素的荧光信号除了AFB2有增加外,其余3种没有明显变化。AFB1和AFG1在紫外光照射下能发生光化学反应产生具有强荧光的产物,从而使荧光信号大幅度的增强,实现10-9级的定量检测[20]。本实验利用这一特性,采用柱前衍生化对AFB1和AFG1进行处理,从而能对其进行有效的测定。
2.5 线性范围、检出限和定量限
用HPLC-FLD在最优条件下测定配制的系列质量浓度标准溶液并绘制标准曲线。结果见表3。

表3 6种真菌毒素的线性回归方程、相关系数、检出限及定量限
由表3可知,AFB1、AFB2、AFG1、AFG2及OTA、OTB分别在1~50 μg/L、2~100 μg/L范围内线性关系良好,R2均大于0.999,方法检出限(以信噪比≥3计)为0.2~0.5 μg/kg,定量限(以信噪比≥10计)为0.6~1.5 μg/kg。
2.6 回收率与精密度
在空白玉米油、空白大豆油、空白菜籽油、空白调和油、空白花生油样品中加入高、中、低3个加标量的混合标准溶液,在最优条件下对加标样品进行提取、萃取、衍生化处理等,经HPLC-FLD进行分析,每个加标水平进行6次重复实验,计算加标回收率和精密度,结果见表4。由表4可知,5种油样中6种真菌毒素3个添加水平下的回收率在75.88%~105.25%之间,相对标准偏差(RSD)在0.5%~9.5%之间,说明该方法对AFB1、AFB2、AFG1、AFG2、OTA和OTB有良好的准确度和精密度。

表4 5种油样中6种真菌毒素加标回收率及相对标准偏差(n=6)
2.7 实际样品的测定
2019年实验室采用该方法对食品安全风险监测中28个食用油样品(包括玉米油、花生油、大豆油、菜籽油和调和油)进行6种真菌毒素测定,结果见表5。由表5可知,在9个食用油样品中检出AFB1、AFB2、AFG1、AFG2、OTA和OTB 6种真菌毒素(并不是每个油样都同时检出6种真菌毒素),检出率达到32.14%。其检出样品中AFB1的检出率为14.29%,含量为0.601~2.620 μg/kg;AFB2的检出率为3.57%,含量为0.745 μg/kg;AFG1的检出率为3.57%,含量为0.751 μg/kg;AFG2的检出率为10.71%,含量为0.618~0.775 μg/kg;OTA的检出率为7.14%,含量为3.330~4.387 μg/kg;OTB的检出率为25.00%,含量为1.519~4.644 μg/kg。
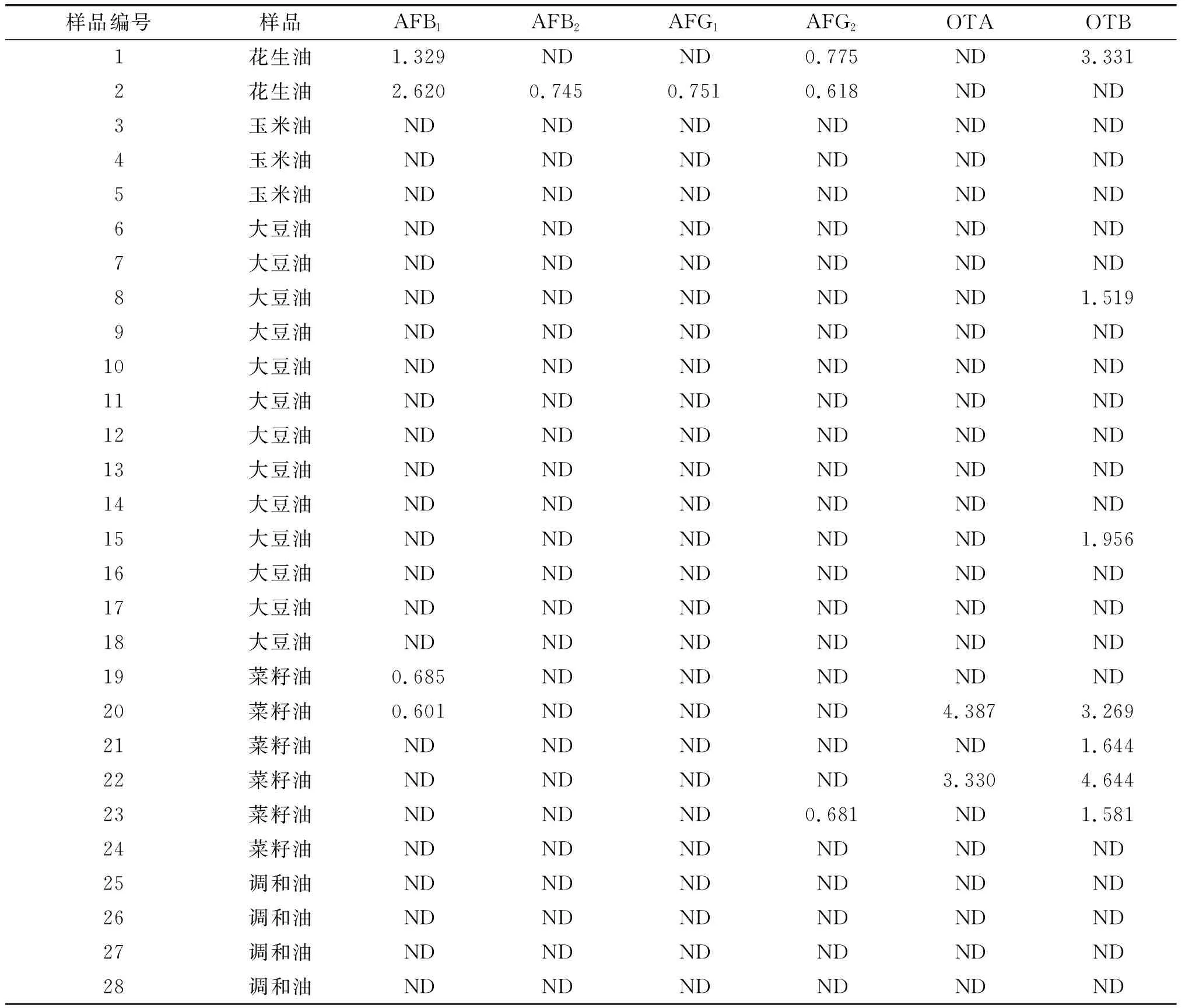
表5 28个食用油样品中真菌毒素AFB1、AFB2、AFG1、AFG2、OTA和OTB的含量 μg/kg
3 结 论
以加标回收率为指标,优化了6种真菌毒素HPLC同步检测的分析条件,探究了前处理步骤中提取液及比例、萃取剂、提取方式以及流动相梯度洗脱条件、流动相等对真菌毒素HPLC检测的影响。前处理最优条件为:乙腈-水-乙酸(体积比84∶15∶1)作为提取液、超声作为提取方式以及CHCl3作为DLLME过程的萃取剂。HPLC分析最优条件为:流动相A甲醇,流动相B 0.05%甲酸,采用梯度洗脱,流速0.6 mL/min, AFB1、AFB2、AFG1和AFG2激发波长为365 nm,发射波长为460 nm,OTA 和OTB激发波长为327 nm,发射波长为460 nm。在最优条件下6种真菌毒素线性关系良好,R2均大于0.999,方法检出限为0.2~0.5 μg/kg,定量限为 0.6~1.5 μg/kg;样品的平均加标回收率为75.88%~105.25%,相对标准偏差为0.5%~9.5%。该方法可有效同步检测6种真菌毒素。
采用该方法对市售的28个食用植物油样品进行了检测,检出含有AFB1的样品4个,含有AFB2和AFG1的样品各1个,含有AFG2的样品3个,含有OTA和OTB的样品分别为2个和7个。本方法可有效、准确地定性定量分析食用植物油中的6种真菌毒素。
