母乳脂肪在早产儿体外胃肠道消化特性研究
2020-11-13李靖雯赵自宽翁加玉徐亚华王兴国
李靖雯,陈 嫣,赵自宽,刘 威,崔 箫,翁加玉,徐亚华,韦 伟,王兴国
(江南大学 食品学院,食品安全与营养协同创新中心,江苏 无锡 214122)
母乳含有婴幼儿发育必需的各种营养成分,对婴幼儿的生长、发育非常重要。母乳中的脂肪为婴儿提供了约50%的能量[1]。在模拟母乳脂肪配方中,脂肪酸组成一直是研究的热点,国内外的研究不仅聚焦于母乳脂肪酸组成、含量以及其中的长链多不饱和脂肪酸对婴幼儿健康的影响,也关注母乳中脂肪酸在甘油三酯中的位置分布不同对婴幼儿消化吸收的影响。
目前,国内外对于母乳中脂肪消化特性的研究尚不全面。体内消化实验存在费用高、周期长、结果重现性差、伦理谴责等问题[2],体外模型用于模拟体内消化能够体现消化过程中的一些细节,能够与体内数据进行验证,并且具有灵活性、准确性和可重复性的优点[3]。国内已有学者采用体外消化模型对乳脂肪球结构、初始粒径与界面结构等物理因素对于消化特性的影响进行了研究[4],这对于婴儿配方奶粉的加工过程控制具有重要意义。同时,配方奶粉的成分控制也是十分必要的,通过研究母乳脂肪的消化特性以改善奶粉中的脂肪球结构与成分,并提升其功能性。对于早产儿这一群体,为使配方奶粉更具针对性,应使脂肪球结构与成分满足早产儿的相应需求。本实验旨在通过模拟早产儿体外消化母乳脂肪的过程来分析人乳脂肪的脂肪酸组成,并研究消化过程中成分的变化,从而为早产儿配方奶粉的开发提供基础。
1 材料与方法
1.1 实验材料
兔胃脂肪酶,从6~8周的安哥拉长毛兔的兔胃中提取,安哥拉长毛兔在江苏大丰市春喜兔毛加工厂宰杀后立即摘取兔胃,放置于干冰中运输,在实验室中于-80℃冰箱中储存,直至进一步脂肪酶提取纯化[5],酶活为0.35 U/mg。猪胰脂肪酶与牛胆汁盐均购于上海Sigma-Aldrich公司,以三丁酸甘油酯为底物,pH 6.2下测得猪胰脂肪酶的酶活为2.7 U/mg。
母乳取自5名在无锡妇幼保健院分娩健康早产儿的产后1个月的母亲,研究对象排除标准为:高血压,糖尿病,烟、酒、毒麻药嗜好者,甲状腺患者,素食者,遗传或肿瘤家族史人群,在2个月内使用抗生素者。将收集的母乳于-80℃保存,实验时放于4℃冰箱中保持16 h以上解冻,将所有母乳混合,然后分装成35 mL/袋,于-20℃下储存直至用于消化实验。
分析纯乙醚、石油醚、丙酮、乙醇、甲醇、氨水、氢氧化钾、氢氧化钠、盐酸、硫酸、氯化钠、氯化钙、酚酞指示剂,均购于国药化学试剂有限公司;色谱纯正己烷,美国Fisher公司;37种脂肪酸甲酯标准品,美国Sigma-Aldrich公司。
Agilent 7820气相色谱仪,美国安捷伦公司; MixPlus旋涡振荡仪,合肥艾本森仪器有限公司;AR2140电子天平和FE20实验室pH计,梅特勒-托利多仪器(上海)有限公司; WHY-2数显恒温振荡器,上海梅香仪器有限公司;三口夹层反应釜,玻璃厂定制;RT 10多点磁力搅拌器,德国IKA公司;BQ 100-1A蠕动泵驱动器,慧宇伟业(北京)流体设备有限公司;Waters 1525高效液相色谱仪,美国Waters公司。
1.2 实验方法
1.2.1 早产儿体外动态消化模型

肠转运和胃排空速度遵循由数学模型拟合的指数模型[9],由母乳喂养的早产新生儿的拟合数据决定[10],Oliveira等[6]预估早产儿胃排空和肠转运进行一半的时间分别为36 min和220 min。在Elashoff模型基础上设定早产儿消化的胃排空梯度,见表1。同时对早产儿消化的小肠转运梯度划分进行参数重置,见表2。随着消化时间的推移,早产儿的胃室pH不断改变,根据Mason[11]在临床上测得的新生儿空腹及摄食2 h内的胃室pH变化曲线对其进行梯度划分,结果见表3。
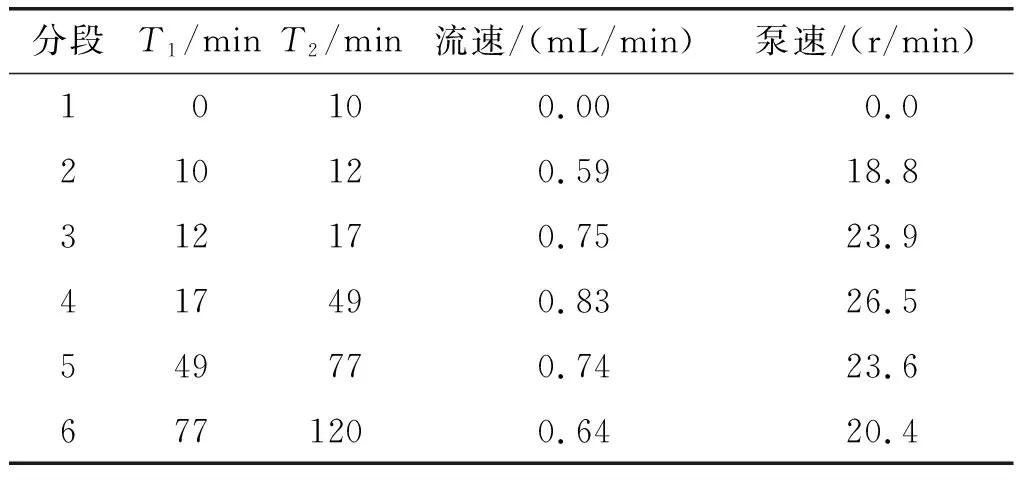
表1 早产儿消化的胃排空梯度
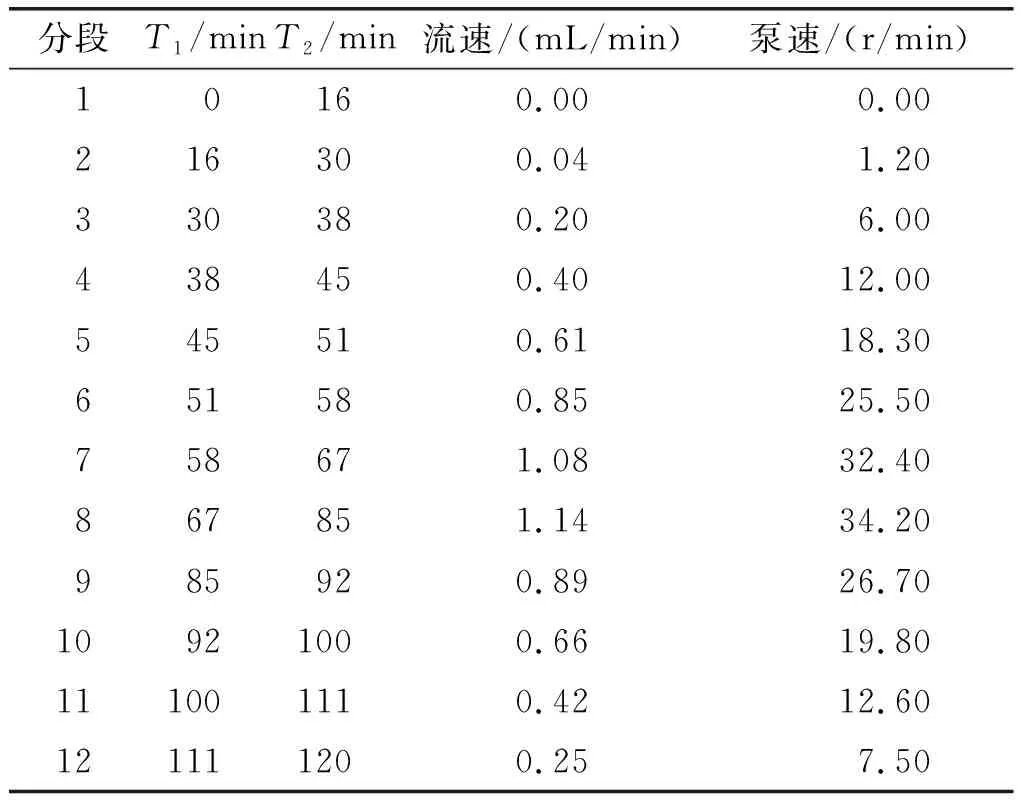
表2 早产儿消化的小肠转运梯度

表3 早产儿消化的胃室pH梯度
1.2.2 母乳脂肪的消化
体外模拟早产儿胃-小肠消化流程如图1所示。

注:1~9.蠕动泵;201.胃液试剂瓶;202.胰液试剂瓶;203.胆汁试剂瓶;204.盐酸试剂瓶;205.氢氧化钠试剂瓶;206.乙醇试剂瓶;301.胃消化室;302.小肠消化室;306.循环水浴锅;400、401.磁力搅拌器;600.系统控制器;801、802.pH计。
如图1所示:母乳脂肪在早产儿体外模拟胃-小肠消化,具体操作为,开启恒温水浴锅,使整个消化体系温度恒定于37℃;初始时胃、小肠消化室内pH与所加溶液参考前述空腹状态各项参数。将35 mL早产儿母乳加入到胃消化室,同时设置部分设备参数:①将磁力搅拌器设置为间歇模式,转速为100 r/min;②开启酸泵和碱泵,在维持小肠消化室pH 6.2的同时实时调节胃消化室的pH;③开启胃液泵并调节加入胃液与脂肪酶的混合液的速度为1 mL/min,保持上述条件10 min。真正的消化过程为食物经胃排空后经肠转运,因此设置: ①将胃液泵速调至0.5 mL/min;②分别设置胆汁泵和胰液泵加液速度为0.5 mL/min和0.25 mL/min。在母乳样品被消化0、30、60、90 min和120 min之后,分别收集胃液和肠液样本,每次取样后立即用适量6 mol/L的浓盐酸灭酶,并立即提取脂肪以防止各类脂质相互转化。每个母乳样品重复进行上述操作3次。
1.2.3 脂肪提取
参照Barbano等[12]在AOAC 995.19基础改进的方法。具体如下:将5 mL母乳和1 mL氨水混合后于(65±5)℃水浴中,振荡均匀后取出。依次加入5 mL乙醇、12.5 mL乙醚和12.5 mL石油醚,摇匀,静置分层。倒出上清液后,加入剂量减半的乙醇、石油醚和乙醚进行第二次提取。将两次得到的提取液合并,用氮气吹至恒重以获取脂肪。将获取的脂肪在-20℃条件下储存以待下一步分析。
1.2.4 脂类组成的测定及脂解程度的计算
参照徐亚华[5]的方法测定消化液的脂类组成。
消化液中含有的脂质包括残余的甘油三酯(TAG)、水解产物甘油二酯(DAG)、甘油单酯(MAG)以及游离脂肪酸(FFA),通过对相应时刻下母乳脂肪酸组成的检测可得到各脂肪酸的质量数据,计算出相应的平均摩尔质量,将其转化成摩尔数。消化过程某一时刻的脂解程度(D)用FFA占残余甘油酯中总酰基链及FFA的摩尔分数表示,即:
D=cFFA/(3×cTAG+2×cDAG+cMAG+cFFA)×100%
(1)
式中:cFFA、cTAG、cDAG和cMAG为各类脂质的浓度,mol/mL。
1.2.5 脂肪酸组成的测定
快速甲醇法甲酯化[13]:取一定油样,加入正己烷,充分振荡使其溶解。加入氢氧化钾-甲醇溶液,用旋涡振荡仪使其充分混合后,将溶液转移至离心管中,在10 000 r/min的条件下离心3 min,取上层清液,进行气相色谱测定。
气相色谱条件参考梁丽[4]的方法:FID检测器;色谱柱为Trace TR-FAME毛细管柱(60 m×0.25 mm×0.25 μm);升温程序为初始柱温60℃,维持3 min,先以5℃/min升至175℃后维持15 min,再以2℃/min升至220℃,保持10 min;分流比100∶1;载气为氮气,流速1.2 mL/min;检测器与进样口温度均为250℃。
通过比较样品中包含的脂肪酸甲酯与37种脂肪酸甲酯标准品出峰的保留时间确定脂肪酸的组成,通过面积归一化法定量。
1.2.6 FFA和sn-2位MAG组成的测定
采用硅胶薄层层析板分离消化所得的脂类混合物,sn-2 MAG(2-MAG)展开剂采用正己烷-乙醚-乙酸(体积比50∶50∶1),FFA展开剂采用正己烷-乙醚-乙酸(体积比70∶30∶2)。分别刮下2-MAG和FFA条带,用无水乙醚提取两遍后进行氮吹,然后进行甲酯化处理与气相色谱测定,方法同1.2.5。
2 结果与讨论
2.1 脂解动力学
在整个模拟母乳脂肪体外消化过程中的脂解动力学情况如图2所示。
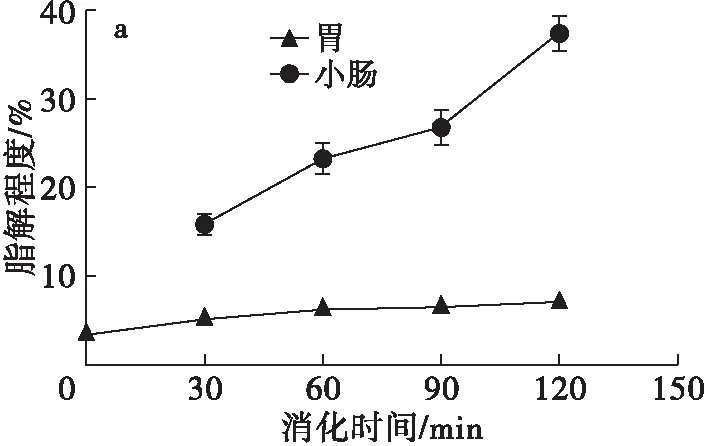
由图2a可知,母乳在胃中进行的脂解过程与在小肠中进行的脂解过程速率差异明显。在胃环境中,脂解程度仅表现出轻微上升,且到60 min后脂解程度基本不再变化,120 min时脂解程度为(7.03±0.15)%,这种现象是由于母乳在脂解过程中会释放出大量长链脂肪酸,其会在乳状液的外表面形成包裹脂肪酶的颗粒,进而对脂肪酶产生抑制作用,直接影响母乳的脂解速率。与胃环境中的平缓变化趋势相比,母乳在小肠中的脂解程度成急剧上升趋势,在120 min时脂解程度为(37.22±1.43)%,增幅超20个百分点。以上结果表明,肠道为母乳脂质在婴儿消化道的主要消化器官。
由图2b可知,体外消化过程中,母乳的脂解产物中TAG、DAG、MAG和FFA的含量变化与脂解程度的变化趋势相符。在2 h的胃环境消化过程中,脂类组成无明显变化,未产生MAG。然而在小肠环境中,随着消化过程的进行,TAG含量不断降低,以FFA为主的产物含量不断增加。肠道消化2 h后仍会保留15%左右的TAG形式的脂质。
2.2 母乳样品的脂肪酸组成
母乳样品的主要脂肪酸组成如表4所示。由表4可知,C16∶0与C18∶1n-9总含量大于50%,另外C18∶2n-6、C18∶0、C14∶0和C12∶0含量也较高。

表4 母乳样品主要脂肪酸组成
2.3 模拟胃和小肠消化母乳脂肪过程中释放出的FFA组成
母乳脂肪中的初始脂肪酸组成与经过模拟胃与小肠的消化环境消化后得到的FFA组成之间的差异如图3所示。
由图3可知,在整个模拟胃肠道体外消化过程中,C18∶1n-9与C18∶2n-6是脂解的主要产物。C18∶1n-9与C18∶2n-6的含量远高于其在初始母乳脂肪中含量,其中在胃消化阶段,分别增加了13.11、12.63个百分点,在小肠消化阶段,分别增加了17.4、12.63个百分点,且C16∶1n-7、C18∶3n-3、C20∶3n-6和C20∶4n-6的含量均显示出相同变化趋势。另外两种次主要脂解产物C16∶0和C18∶0的含量在胃消化阶段则分别下降了16.05、2.84个百分点,C10∶0、C12∶0、C14∶0和C22∶6n-3的含量与C16∶0、C18∶0的变化趋势大体相同。
在小肠消化环境中,呈游离态存在的C16∶0含量低于胃环境,相反,游离态的C10∶0含量高于胃环境,其他的脂肪酸产物在小肠环境中的释放量的变化趋势则与胃环境中的大致相同。

2.4 模拟小肠消化母乳脂肪过程中释放出的2-MAG脂肪酸组成
母乳脂肪中的初始脂肪酸组成与经过模拟小肠消化母乳脂肪过程中释放出的2-MAG脂肪酸组成见图4。

由图4可知,母乳脂肪初始脂肪酸组成和肠内脂解产物2-MAG的脂肪酸组成存在较大差异。在小肠阶段释放出2-MAG的主要成分为C16∶0、C14∶0、C18∶1n-9和C18∶2n-6。小肠内脂解产物2-MAG中的C14∶0、C16∶0、C20∶0以及C22∶6n-3的含量均明显高于其在母乳脂肪初始脂肪酸中的含量,其中C16∶0的含量最高,变化也最为明显,差值在30个百分点左右,再结合胃脂肪酶(sn-3位)和胰脂肪酶(sn-1,3位)的作用位点特异性,可得到C16∶0主要分布在sn-2位的结论,而C10∶0、C18∶1n-7、C18∶1n-9、C18∶2n-6、C18∶3n-3以及C20∶3n-6等脂肪酸的含量均明显低于其在母乳脂肪初始脂肪酸中的含量,即这些脂肪酸主要分布在sn-1,3位。
另外,结合图3和图4可知,消化时间不作为影响母乳脂肪在体内消化过程中释放出产物FFA或2-MAG 的脂肪酸组成变化的主要因素,对于整个脂解过程,酶依旧是起主要调控作用的物质,与酶自身具有的特性一致,脂肪酶的专一性和特异性在该过程中尤为重要,不仅仅体现在作用物质上,还包括作用位点的绝对控制,即胃脂肪酶对sn-3位的作用和胰脂肪酶对sn-1,3位的作用。
3 结 论
小肠是婴儿进行脂类物质消化的主要器官,从早产儿胃环境至小肠环境,母乳脂肪120 min时脂解程度从(7.03±0.15)%增加至(37.22±1.43)%。母乳脂肪在胃肠消化过程中释放出FFA的主要成分是C18∶1n-9和C18∶2n-6,其次是C16∶0,在小肠消化阶段释放出2-MAG的主要成分为C16∶0、C14∶0、C18∶1n-9和C18∶2n-6。模拟早产儿胃肠道消化环境的体外消化模型的建立,有助于研究随着时间变化,早产儿胃肠道的消化进程以及相关物质组分及其含量,为更多针对性的早产儿配方食品的研发提供基础。
