酸法制取大豆皮可溶性膳食纤维
2020-11-13李晓宁郭咪咪段章群
李晓宁,郭咪咪,段章群
(国家粮食和物资储备局科学研究院,北京 100037)
我国是世界上大豆消耗大国,年消耗量已超亿吨,其中大豆榨油消耗量占85%[1],大豆皮作为油脂加工过程中的副产物,质量约占大豆质量的8%[2],产量也近700万t。大豆皮细胞壁不溶性碳水化合物组分包含50%半纤维素、30%果胶和20%纤维素[3],可观的产量和丰富的纤维组成使得大豆皮成为理想的膳食纤维来源。
膳食纤维依据溶解性不同可分为水溶性和水不溶性两大类,天然的膳食纤维多为水不溶性的,而水溶性的含量较低。但是相较而言,水溶性膳食纤维具有更强的生理活性和保健功能,对于预防心脑血管疾病[4-5]、结肠癌[6],降低血糖[7],减肥[8]等具有重要作用。目前大豆可溶性膳食纤维多以豆渣为原料进行研究开发[9-11],而对于大豆皮中可溶性膳食纤维的研究和利用却很有限。从大豆皮中制取膳食纤维的方法有酶法[12-13]、高压蒸汽法[14]和微波辅助法[15]。酶法提取条件温和,但是成本较高,存在提取时间长、得率不高等问题,高压蒸汽法和微波辅助法虽可以有效缩短提取时间,但均需添加特殊辅助设备,增加成本。酸法制取大豆皮可溶性膳食纤维提取剂成本低廉,操作简便,且不会在体系中引入新的离子。因此,本文采用酸法制取大豆皮可溶性膳食纤维,以期为大豆皮有益成分的开发利用和大豆皮深加工产品附加值的提升提供简便思路。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
大豆皮,取自大豆油加工厂;总膳食纤维检测试剂盒、三羟甲基氨基甲烷(Tris)、2-(N-吗啉基)乙磺酸(MES);石油醚、95%乙醇、乙酸、盐酸,均为分析纯。
1.1.2 仪器与设备
JSP-100型高速多功能粉碎机,AB204-S电子天平,DHG-9076A型电热鼓风干燥箱,FE20实验室pH计,C-MAG HS 7加热磁力搅拌器,HPD-25无油真空泵,RJ-LD-IIB低速大容量多管离心机,SOXTEC8000脂肪测定仪,Rapid N cube全自动杜马斯定氮仪。
1.2 实验方法
1.2.1 大豆皮基本成分的测定
水分的测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;脂肪的测定参照GB/T 14488.1—2008《植物油料 含油量测定》;蛋白的测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;灰分的测定参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》;总膳食纤维、可溶性膳食纤维、不溶性膳食纤维的测定参照GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》。
1.2.2 大豆皮可溶性膳食纤维的制取
大豆皮粉碎后过40目筛,称取10 g(m)加入去离子水,室温下使用1 mol/L盐酸调节pH,放入水浴中平衡15 min后计时提取。提取结束后冷却至室温,4 000 r/min离心15 min取上清液,按比例加入95%乙醇沉淀2 h,4 000 r/min离心10 min,将沉淀置于40℃烘箱中恒重,即得到大豆皮可溶性膳食纤维(m1)。按下式计算可溶性膳食纤维得率(Y)。
Y=m1/m×100%
(1)
1.2.3 数据处理
采用Origin 8.5软件进行作图,SPSS22.0软件进行方差分析。
2 结果与讨论
2.1 大豆皮的基本成分(见表1)

表1 大豆皮的基本成分 %
由表1可知,膳食纤维是大豆皮最主要的组成部分,其中不溶性成分比例高达95.5%,可溶性成分不足5%。而高膳食纤维低蛋白的比例关系与大豆皮的获得方式有关,在预处理环节直接对大豆进行脱皮处理,极少混入高蛋白的子叶部分,使得大豆皮中蛋白含量较低[16]。
2.2 酸法制取大豆皮可溶性膳食纤维单因素实验
2.2.1 pH的影响
在料液比1∶16、提取温度80℃、提取时间1.0 h、乙醇沉淀比例1∶4的条件下,考察pH对可溶性膳食纤维得率的影响。考虑到水溶性蛋白及与水溶性膳食纤维共价结合的蛋白在可溶性膳食纤维提取的过程中,也一同被溶解富集,对于可溶性膳食纤维的纯度有较大影响,一定程度上可以反映提取的可溶性膳食纤维的纯度,因此同时监测提取物中蛋白含量的变化。结果分别见图1、图2。
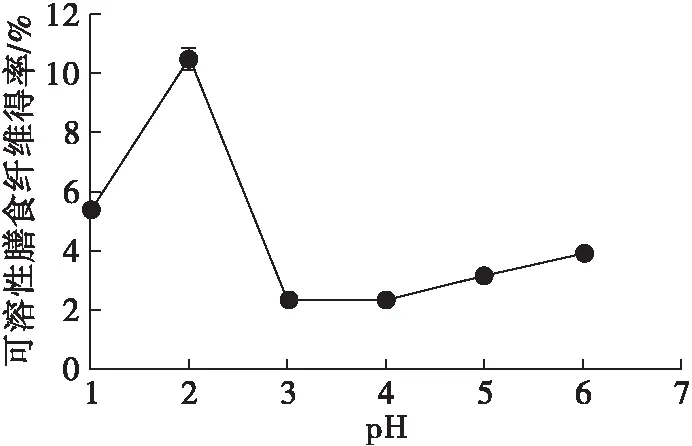
图1 pH对可溶性膳食纤维得率的影响
酸处理可以有效破坏分子间的部分氢键,暴露更多极性基团,从而增加膳食纤维的溶解性[17]。由图1可知,pH 2.0时可溶性膳食纤维得率最高,pH 3.0时可溶性膳食纤维得率最低。
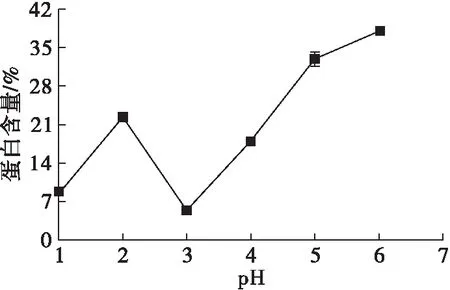
图2 pH对蛋白含量的影响
由图2可知,pH 3.0时可溶性膳食纤维中的蛋白含量最低。分析认为:pH 3.0时可能恰好处于豆皮蛋白的等电点附近,因此较多的游离蛋白沉淀下来;可能有部分纤维与蛋白处于共价结合状态[18],因处于等电点附近而一并被沉淀下来,造成“双低”的结果。综合考虑,在pH 2.0进行可溶性膳食纤维的提取最为适宜。
2.2.2 提取温度的影响
在料液比1∶16、pH 2.0、提取时间1.0 h、乙醇沉淀比例1∶4的条件下,考察提取温度对可溶性膳食纤维得率的影响,同时监测提取物中蛋白含量的变化。结果分别见图3、图4。
由图3可知,随着提取温度的升高,豆皮可溶性膳食纤维得率逐渐提高,在70~90℃区间内可溶性膳食纤维得率升高缓慢。高温使得纤维分子间化学键更容易断裂,降低了纤维相对分子质量,从而使其更易溶解。
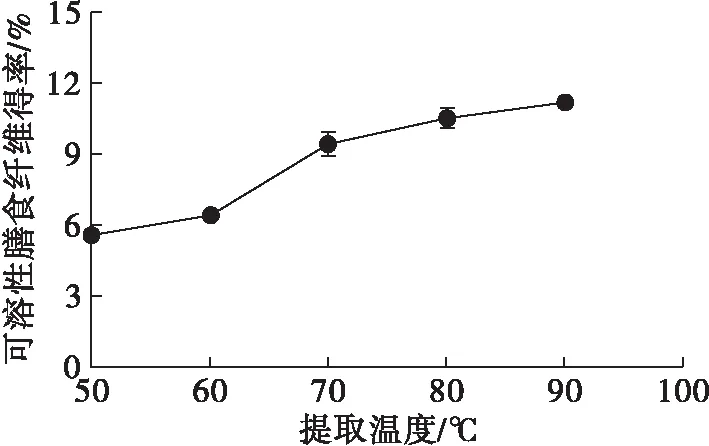
图3 提取温度对可溶性膳食纤维得率的影响
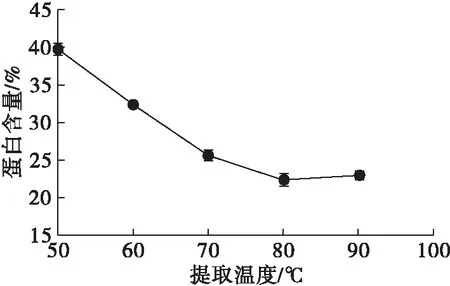
图4 提取温度对蛋白含量的影响
由图4可知,随着提取温度的升高,可溶性膳食纤维中蛋白含量显著减少。分析认为高温酸性环境可能在一定程度上破坏了纤维与蛋白的共价结合状态,因此在乙醇沉淀时膳食纤维-蛋白质共同沉淀的情况有所减少。综合考虑,80℃是适宜的提取温度。
2.2.3 料液比的影响
在提取温度80℃、pH 2.0、提取时间1.0 h、乙醇沉淀比例1∶4的条件下,考察料液比对可溶性膳食纤维得率的影响,同时监测提取物中蛋白含量的变化。结果分别见图5、图6。

图5 料液比对可溶性膳食纤维得率的影响
由图5可知,随料液比增大,可溶性膳食纤维得率缓慢增加直至趋于平稳。提取剂体积增大时,表现为更多的可溶性膳食纤维溶于提取剂中;但是当可溶性膳食纤维溶解较为完全时,即使再加大提取剂体积也不会使得率有所提升,反而还会造成提取剂的浪费,进而造成后期乙醇沉淀时乙醇消耗量的增大。
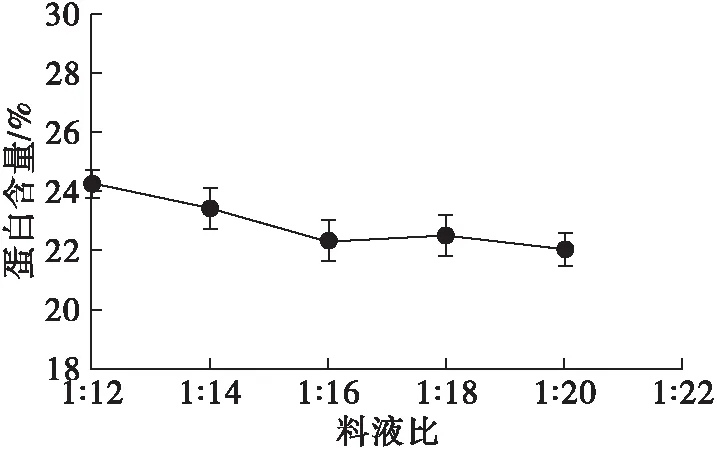
图6 料液比对蛋白含量的影响
由图6可知,随着料液比增大,蛋白含量缓慢下降直至趋于平缓。低料液比时,溶于水中的蛋白和可溶性膳食纤维量虽不高,但是浓度却都较高,乙醇沉淀时可能由于二者的间距较小,缠绕在一起而共同沉淀下来;而当料液比较大时,可溶性成分分子间距离较远,减少了共同沉淀的情况。综合考虑,1∶18为适宜的料液比。
2.2.4 提取时间的影响
在料液比1∶16、提取温度80℃、pH 2.0、乙醇沉淀比例1∶4的条件下,考察提取时间对可溶性膳食纤维得率的影响,同时监测提取物中蛋白含量的变化。结果分别见图7、图8。
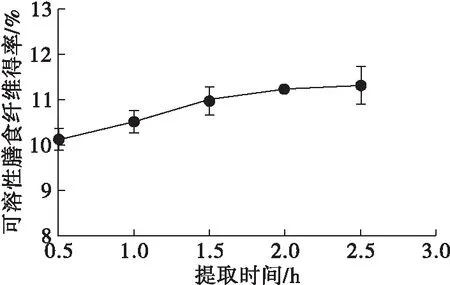
图7 提取时间对可溶性膳食纤维得率的影响
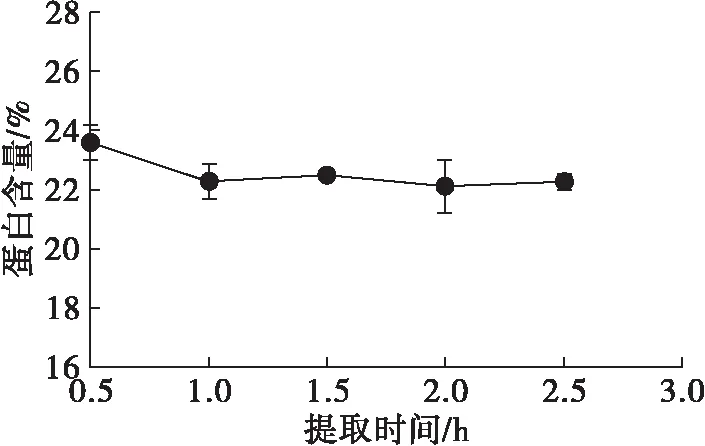
图8 提取时间对蛋白含量的影响
由图7可知,随提取时间延长,可溶性膳食纤维得率缓慢上升,1.5 h后趋于稳定。由图8可知,蛋白含量在提取时间自0.5 h延长到1.0 h时下降,之后变化不大。分析认为提取时间的延长为高相对分子质量纤维分子的化学键、纤维-蛋白共价键的断裂提供了机会,但较难断裂的化学键不会因为作用时间的延长而发生断裂,因此继续延长时间也不会再对得率有改善。因此,1.5 h为适宜的提取时间。
2.2.5 乙醇沉淀比例的影响
在料液比1∶16、提取温度80℃、pH 2.0、提取时间1.0 h的条件下,考察乙醇沉淀比例对可溶性膳食纤维得率的影响,同时监测提取物中蛋白含量的变化。结果分别见图9、图10。
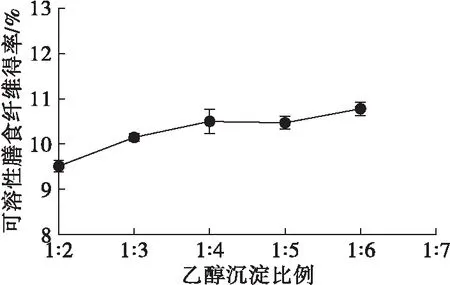
图9 乙醇沉淀比例对可溶性膳食纤维得率的影响
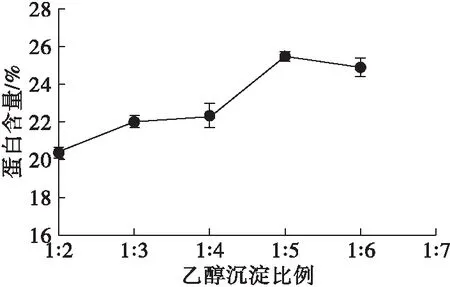
图10 乙醇沉淀比例对蛋白含量的影响
乙醇沉淀的原理在于通过降低多糖水溶液的介电常数,使多糖“脱水”从而形成聚合沉淀。由图9可知,随着乙醇沉淀比例增大,可溶性膳食纤维得率逐渐增大,当乙醇沉淀比例达到1∶4后,可溶性膳食纤维得率没有明显提高。同时增大乙醇沉淀比例也会造成试剂的浪费。
由图10可知,随着乙醇沉淀比例的增大,蛋白含量增大,在乙醇沉淀比例为1∶5时蛋白含量最大,之后变化不大。分析认为可能的原因为蛋白质因高比例乙醇造成变性而出现沉淀,造成可溶性膳食纤维中的蛋白含量升高。因此,1∶4为适宜的乙醇沉淀比例。
2.3 酸法制取大豆皮可溶性膳食纤维正交实验
根据单因素实验的结果,固定乙醇沉淀比例1∶4、pH 2.0,考察提取温度、提取时间、料液比对大豆皮水溶性膳食纤维提取的影响,正交实验因素水平见表2,正交实验结果与分析见表3,方差分析见表4。
由表3、表4可知,各因素对大豆皮可溶性膳食纤维得率影响由大到小排序为提取温度 > 提取时间 > 料液比,其中提取温度对可溶性膳食纤维得率有显著影响。最优工艺组合为A3B3C3,即提取温度90℃、料液比1∶20、提取时间2.0 h。在最优工艺条件下进行验证实验,大豆皮可溶性膳食纤维得率为12.49%,纯度为60.13%,蛋白含量为18.33%。
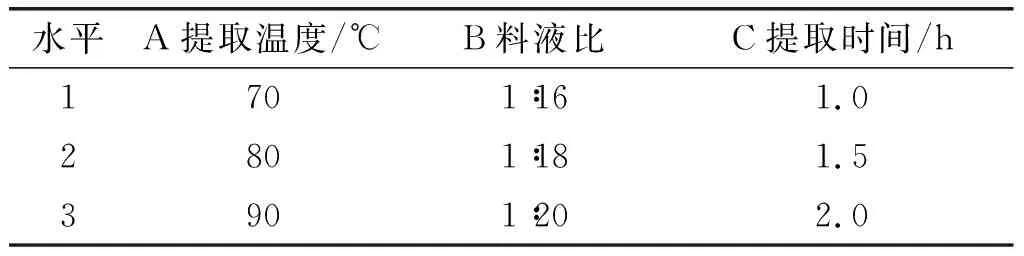
表2 正交实验因素水平
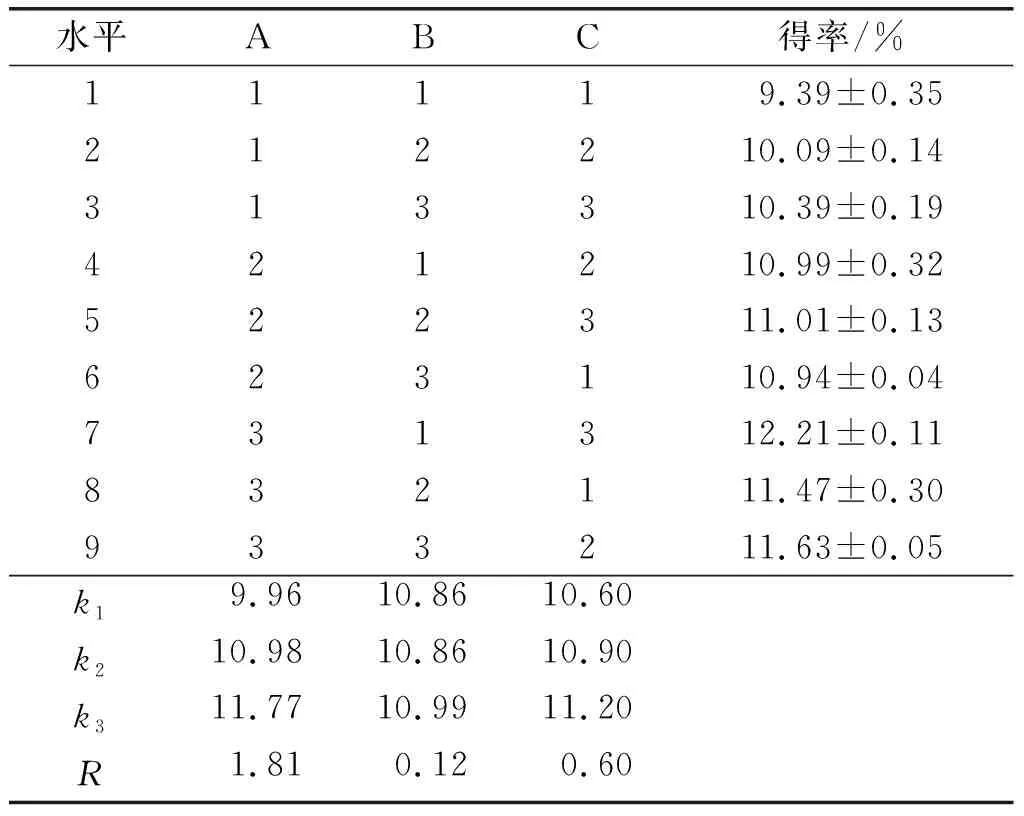
表3 正交实验结果与分析

表4 方差分析
3 结 论
本实验通过酸法制取大豆皮可溶性膳食纤维,通过单因素实验结合正交实验得到最优的大豆皮可溶性膳食纤维制取工艺条件为:pH 2.0,提取温度90℃,料液比1∶20,提取时间2.0 h,乙醇沉淀比例1∶4。在最优工艺条件下,可溶性膳食纤维得率为12.49%,纯度为60.13%,蛋白含量为18.33%。相较原料中的可溶性膳食纤维含量(3.10%)显著提高。
