心外膜脂肪组织厚度与左房室瓣环钙化的关系研究
2020-11-13屈文涛马静康亚宁许磊范丽平张拓伟
屈文涛,马静,康亚宁,许磊,范丽平,张拓伟
左房室瓣环钙化是一种以脂质沉积、纤维化、钙化为特征的退行性病变,属于心血管动脉粥样硬化的表现形式,好发于女性及70岁以上老年人,且与冠心病、心房颤动、心力衰竭、脑卒中及死亡风险增加密切相关[1]。近年研究发现,内脏脂肪组织增加是动脉粥样硬化性疾病的重要危险因素,尤其是包裹在心脏和冠状动脉表面的心外膜脂肪组织(epicardial adipose tissue,EAT),其可分泌脂肪因子,参与心脏生理活动[2-3],且病理状态下还会分泌炎性递质[4]。但EAT厚度与左房室瓣环钙化的关系目前尚未明确,本研究探讨了两者的关系,旨在为左房室瓣环钙化发病机制研究提供一定参考。
1 对象与方法
1.1 研究对象 选取2018年2月—2019年6月在西安市中医医院就诊的左房室瓣环钙化患者50例作为病例组,均经超声心动图检查确诊;另选取同期在西安市中医医院的体检健康者40例作为对照组。排除合并冠心病、高尿酸血症、左心室射血分数(LVEF)<50%、风湿性心脏病、肺动脉高压、慢性肾脏病及左房室瓣大量反流者。本研究经西安市中医医院医学伦理委员会审核批准,患者及其家属对本研究知情并签署知情同意书。
1.2 观察指标 (1)收集所有受试者一般资料,主要包括性别、年龄、体质指数(BMI)、腰围及血压,其中血压测量采用鱼跃电子血压计。(2)收集所有受试者实验室检查指标,主要包括血脂指标〔三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)及低密度脂蛋白(LDL)〕、空腹血糖(FBG)及白细胞计数(WBC),所用仪器为迈瑞全自动生化分析仪。(3)所有受试者进行超声心动图检查,所用仪器为飞利浦EPIQ5彩色多普勒超声诊断仪,使用S5-1心脏超声探头,并应用QLab 8.0工作软件进行后处理。检查方法:受检者取左侧卧位,平静呼吸后连接胸导联心电图,采用二维超声心动图检测左心室舒张末期内径(LVEDD)、室间隔厚度(IVST)、左心房内径(LAD)及LVEF,采用多普勒超声测量左房室瓣口舒张早期峰值流速(E)、左房室瓣口舒张晚期峰值流速(A)、左房室瓣环舒张早期流速(e'),并计算E/A比值、E/e'比值,Tei指数=(心室等容舒张时间+心室等容收缩时间)/射血时间。取胸骨旁左心室长轴切面,选择收缩末期右心室前壁垂直测量EAT最厚处厚度,连续测量3次取其平均值。超声心动图显示,左房室瓣环强回声光斑附着,提示左房室瓣环钙化,见图1。
1.3 统计学方法 采用SPSS 23.0统计学软件进行数据处理。计量资料以(±s)表示,组间比较采用独立样本t检验;计数资料分析采用χ2检验;EAT厚度与左房室瓣环钙化患者LDL、FBG、LAD、E/e'比值及Tei指数的相关性采用Pearson相关分析;左房室瓣环钙化影响因素分析采用多因素Logistic回归分析,并绘制受试者工作特征曲线(ROC曲线)以评价EAT厚度对左房室瓣环钙化的诊断价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组受试者一般资料及实验室检查指标比较两组受试者性别、年龄、BMI、腰围、收缩压、舒张压、TG、TC、HDL及WBC比较,差异无统计学意义(P>0.05);病例组患者LDL、FBG高于对照组,差异有统计学意义(P<0.05,见表1)。
图1 患者超声心动图检查结果Figure 1 Results of echocardiography of patient
2.2 两组受试者超声心动图检查结果比较 两组受试者LVEDD、IVST、LVEF、E/A比值比较,差异无统计学意义(P>0.05);病例组患者LAD、EAT厚度大于对照组,E/e'比值、Tei指数高于对照组,差异有统计学意义(P<0.05,见表2)。
2.3 EAT厚度与左房室瓣环钙化患者LDL、FBG、LAD、E/e'比值及Tei指数的相关性分析 Pearson相关分析结果显示,EAT厚度与左房室瓣环钙化患者LDL(r=0.40,P<0.01)、FBG(r=0.36,P<0.01)、LAD(r=0.42,P<0.01)、E/e'比值(r=0.43,P<0.01)、Tei指数(r=0.34,P=0.02)均呈正相关,见图2。
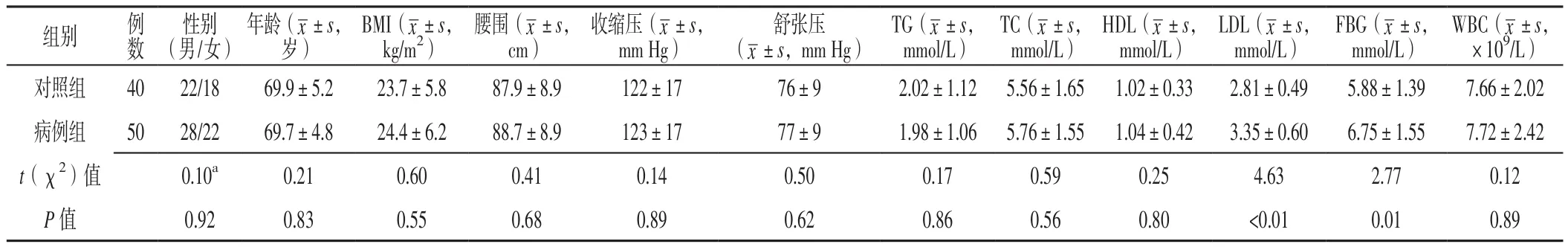
表1 两组受试者一般资料及实验室检查指标比较Table 1 Comparison of general information and laboratory examination indexes between the two groups
表2 两组受试者超声心动图检查结果比较(±s)Table 2 Comparison of echocardiography results between the two groups
注:LVEDD=左心室舒张末期内径,IVST=室间隔厚度,LAD=左心房内径,LVEF=左心室射血分数,E=左房室瓣口舒张早期峰值流速,A=左房室瓣口舒张晚期峰值流速,e'=左房室瓣环舒张早期流速,EAT=心外膜脂肪组织
组别 例数 LVEDD(mm) IVST(mm) LAD(mm) LVEF(%) E/A比值 E/e'比值 Tei指数 EAT厚度(mm)对照组 40 44.07±2.74 9.80±1.45 35.30±3.82 63.52±3.08 0.72±0.22 10.90±1.76 0.39±0.03 5.18±1.12病例组 50 45.14±3.01 10.34±1.32 37.40±3.51 62.88±2.85 0.69±0.12 12.36±2.11 0.41±0.03 7.62±1.63 t值 1.73 1.84 2.71 1.02 0.82 3.56 2.56 6.21 P值 0.09 0.07 0.01 0.31 0.41 <0.01 0.01 <0.01
2.4 左房室瓣环钙化影响因素分析 将LDL、FBG、LAD、E/e'比值及Tei指数作为自变量,左房室瓣钙化作为因变量(变量赋值见表3)进行多因素Logistic回归分析,结果显示,EAT厚度是左房室瓣环钙化的独立影响因素(P<0.05,见表4)。

表3 左房室瓣环钙化影响因素的多因素Logistic回归分析的变量赋值Table 3 Variable assignment of multivariate Logistic regression analysis on influencing factors of mitral annulus calcification

表4 左房室瓣环钙化影响因素的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis on influencing factors of mitral annulus calcification
2.5 EAT厚度对左房室瓣环钙化的诊断价值 ROC曲线分析结果显示,EAT厚度诊断左房室瓣环钙化的曲线下面积为0.811〔95%CI(0.724,0.898)〕,最佳截断值为6.2 mm,灵敏度为88%,特异度为63%,见图3。
3 讨论
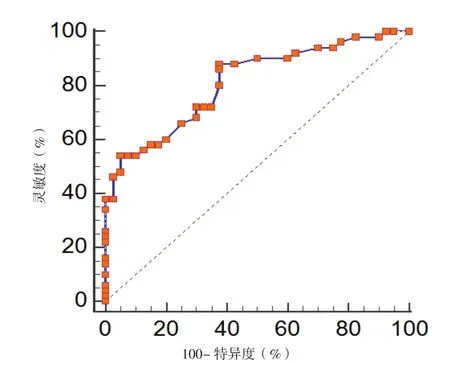
图3 EAT厚度对左房室瓣环钙化诊断价值的ROC曲线Figure 3 ROC curve for diagnostic value of EAT thickness in diagnosing mitral annulus calcification
EAT是一种内脏脂肪组织,主要集中在右心室、房室间沟和心房的游离壁上,可分泌多种具有生理生化功能的生物活性因子[5],如脂肪因子(脂联素)、炎性因子(如肿瘤坏死因子、单核细胞趋化蛋白1、白介素6、神经生长因子、抵抗素、纤溶酶原激活物抑制剂1、血管紧张素原)等[6]。病理状态下,EAT可分泌多种炎性递质,进而影响冠状动脉粥样硬化形成并导致心肌缺血[7]。左房室瓣环钙化是一种退行性病变,与动脉粥样硬化部分病理特征相同,如脂质沉积、巨噬细胞和T淋巴细胞浸润及成骨细胞样表型诱导[8]。据报道,左房室瓣环钙化患病率为8%~12%,其中严重冠状动脉粥样硬化疾病患者左房室瓣环钙化发生率更高,约为 35%[9]。
本研究结果显示,病例组患者EAT厚度大于对照组,提示左房室瓣环钙化患者EAT增厚。FOX等[10]研究发现,左房室瓣环钙化患者炎性因子标志物(包括C反应蛋白、白介素6、单核细胞趋化蛋白1、可溶性细胞间黏附分子1)明显升高。IACOEBLLIS等[11]从冠心病患者分离的EAT中发现脂联素表达明显降低。PARISI等[12]研究发现,EAT厚度与主动脉瓣狭窄密切相关。分析EAT增厚与左房室瓣环钙化的相关机制可能如下:EAT增厚使炎性细胞因子增多,病理状态下浸润左房室瓣环胶原纤维,加上血流不断冲击,导致胶原纤维断裂,游离钙离子与暴露位点胶原纤维结合,进而引起钙盐沉积并渗透到左房室瓣环间质中,导致左房室瓣环钙质沉积、纤维化[13]。
本研究结果显示,病例组患者LAD、EAT厚度大于对照组,E/e'比值、Tei指数高于对照组,且EAT厚度与左房室瓣环钙化患者LAD、E/e'比值、Tei指数均呈正相关,提示EAT增厚与左房室瓣环钙化患者心脏结构和功能受损有关,其机制可能为EAT分泌的炎性递质渗透到心肌细胞并导致心肌细胞肥大、间质纤维化,加之左房室瓣环钙化引起左房室瓣环运动负荷增加及左心室充盈压升高,进而导致心脏结构和功能受损。MASSERA等[14]通过对左房室瓣环钙化标本组织学研究发现,随着年龄增长胶原间的密度越来越大,之后脂质沉积区域出现钙化,而左房室瓣环钙化患者则表现为胶原基质内嵌有钙化、坏死的组织碎片并被炎性细胞浸润在内的肉芽组织所包围;此外,在另一组标本中还观察到间质细胞的肌成纤维细胞分化,甚至还存在板层骨,提示骨的钙磷酸盐代谢相关因素可能是左房室瓣环钙化、形成的主要原因之一。本研究结果显示,病例组患者LDL、FBG高于对照组,且EAT厚度与左房室瓣环钙化患者LDL、FBG呈正相关,提示血糖、LDL水平过高可能是左房室瓣环钙质沉积的影响因素,分析其原因可能如下:氧化的LDL浸润心肌内膜表面、胰岛素抵抗及血液高凝状态导致血管内皮细胞损伤等因素引起心脏左房室瓣环间质细胞变性、坏死、纤维化[15]并转化为成骨细胞,而成骨细胞形成板层骨的过程中钙质沉积在左房室瓣环。既往研究发现,左房室瓣环钙化还与传导系统延迟增加有关,包括房室传导阻滞和束支传导阻滞,瓣环钙化或纤维化直接延伸到心室传导系统,可能影响局部左心室心肌传导功能[16]。本研究结果显示,EAT厚度是左房室瓣环钙化的独立影响因素,其诊断左房室瓣环钙化的曲线下面积为0.811,提示EAT增厚对左房室瓣环钙化具有一定诊断价值。
综上所述,EAT厚度与左房室瓣环钙化患者的左心房结构与功能有关,是左房室瓣环钙化的危险因素,且对左房室瓣环钙化具有一定的临床诊断价值。此外,采用超声心动图检测EAT厚度简单、可重复性好[17]。但本研究纳入样本量较小,且未能明确EAT厚度增加与左房室瓣环钙化的因果关系及左房室瓣环钙化对左心室心肌形变功能的影响,均有待于进一步探究。
作者贡献:屈文涛进行文章的构思与设计,数据收集、整理、分析,进行结果分析与解释,负责撰写论文;许磊进行研究的实施与可行性分析;康亚宁、马静和范丽平进行论文的修订;张拓伟负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
