玉米生育期优势污染真菌及其与真菌毒素积累相关性研究
2020-11-13张娜娜张守梅郭玉秋陈利容王兴亚龚魁杰
张娜娜,张守梅,郭玉秋,陈利容,王兴亚,龚魁杰
(山东省农业科学院作物研究所,山东济南 250100)
玉米是我国第一大农作物,国家统计局统计数据显示,2019年我国玉米总产量为26 077.89万吨,占粮食总产量的39.28%。当前玉米栽培研究的目标已由产量为主向高产、优质、高效、生态、安全等多目标协同发展[1],因此对玉米质量安全提出了严峻的挑战,特别是受全球极端气候变化影响,病虫害加速发展严重影响玉米质量和产量[2]。
穗腐病是目前玉米最严重的病害之一,主要由镰刀属(Fusarium)、青霉属(Penicillium)、曲霉属(Aspergillus)和交链孢属(Alternaria)真菌侵染导致[3,4]。玉米种子、生长期、采收过程和储藏过程中均可产生真菌污染。Mannaa等[5,6]对玉米收获前和收获后污染真菌的种类进行统计分析并提出,在收获前有害真菌的种类更多,应该从收获前便开始采取措施控制真菌污染和真菌毒素的产生;Payne等[7]发现从吐丝期就有病原真菌从花丝侵入玉米穗中;王伟等[8]发现扬花期接种黄曲霉菌的玉米发病率为25%,到灌浆期发病率为100%,说明玉米生育期是控制玉米籽粒真菌和毒素污染的关键阶段。目前还没有对玉米生育期病原真菌污染和真菌毒素积累的相关调查或报道。本研究选择三个常见玉米种植品种为研究对象,对每个生育阶段的污染真菌进行分离和鉴定,并对真菌毒素进行检测,以确定优势污染真菌的类型及相关产毒真菌与真菌毒素的关系,为进一步科学合理地保障玉米采收和储藏期间质量安全奠定基础。
1 材料与方法
1.1 材料与试剂
试验所用玉米样品采自山东省农业科学院试验示范基地济阳基地,玉米品种为郑单958、青农11和宇玉268。
马铃薯葡萄糖琼脂培养基(PDA),青岛高科园海博生物技术有限公司;1%青霉素(10 000 U/mL)、硫酸链霉素(10 mg/mL),Biological Industries公司;丙三醇(甘油)、乙二胺四乙酸、无水磷酸二氢钠(均为分析纯),国药集团化学试剂有限公司;2×Taq DNA Master Mix、ITS通用引物,北京擎科生物技术有限公司;DNA Marker、6×DNA Loading Buffer、DNA Dye 10000×,GenStar生物公司;呕吐毒素、黄曲霉毒素B1、玉米赤霉烯酮ELISA检测试剂盒,北京华安麦科生物技术有限公司。
1.2 仪器与设备
SW-CJ-2FD净化工作台,苏州净化设备有限公司;IX51倒置显微镜,奥林巴斯(中国)有限公司;立式高压灭菌器,上海申安医疗器械厂;台式高速离心机,上海安亭科学仪器厂;PHS-3E酸度计,上海佑科仪器仪表有限公司;数显恒温振荡水浴器,天津赛得利斯实验仪器制造厂;恒温金属浴,杭州米欧仪器有限公司;全波长多功能酶标仪,Thermo Fisher科技(中国)有限公司;台式高速离心机,Eppendorf(中国)有限公司;PCR仪,力康生物医疗科技控股有限公司;水平电泳仪,Bio-Rad公司;NU Genius凝胶成像系统,Gene Company Limited;分析天平,德国赛得利斯有限公司;XW-80A旋涡混合仪,宁波新芝生物科技股份有限公司。
1.3 真菌分离和鉴定
1.3.1 真菌分离、纯化 玉米花期套袋后进行人工授粉,根据玉米籽粒发育程度,分别于授粉后0、12、23、35、44、55 d进行采样。采样时,每个品种选择生长发育一致的植株,无病虫害或明显霉变,每个品种取30~50个带苞叶果穗,装入无菌自封袋中,当天取样当天进行污染真菌的分离。
在超净工作台中,取1 g样品于含有10 mL灭菌蒸馏水的离心管中,涡旋振荡10 s。采用稀释平板法[9],取1 mL混合液于9 mL灭菌蒸馏水中依次稀释成 10-2、10-3、10-4浓度梯度的混合液。取100μL稀释液涂布于含有1%青霉素和硫酸链霉素的无菌PDA培养基中,每个浓度梯度做3个重复。将接种后的培养皿28℃左右培养3 d后统计菌落数并对真菌进行纯化,于无菌保种管4℃保存。
1.3.2 形态学鉴定 将分离纯化的菌株接种于PDA培养基上28℃进行培养,待菌落长至平板2/3时,观察菌落大小、气生菌丝状态、菌落颜色和纹理等。
在超净工作台中,用无菌接种针挑取菌丝至滴有无菌水的载玻片上,于光学显微镜(40×10)下观察菌丝和孢子形态。
1.3.3 分子生物学鉴定 选取形态不同的代表性菌株,采用热裂解法[10]进行真菌DNA基因组提取。利用引物 ITS1∶5′-TCCGTAGGTGAACCTGCGG-3′和 ITS4∶5′-TCCTCCGCTTATTGATATGC-3′对18S rDNA的 ITS序列进行 PCR扩增[11],扩增体系(25μL):2×Taq PCR Master Mix 12.5 μL、ITS1和 ITS4引物各 1μL、DNA模板 1μL、ddH2O 9.5μL。扩增程序:95℃ 3 min;94℃ 1 min,55℃ 1 min,72℃ 1 min,共 35个循环;72℃10 min,4℃保存备用。将扩增产物用1%琼脂糖凝胶电泳进行检测,送至北京擎科生物技术有限公司进行测序。
测序结果用Geneious 8.0.3软件进行分析和校正,得到的高质量DNA序列上传到NCBI数据库的GenBank中进行同源序列Blast比对,寻找具有较高同源性的核苷酸序列。将各类菌株序列导入Mega 7.0软件进行多序列比对(alignment)分析,采用最大似然法构建系统发育树。
1.4 真菌毒素检测
1.4.1 样品处理 黄曲霉毒素B1:粉碎并称取鲜食玉米样品5.0 g,置入100 mL具塞三角瓶中,加入60%甲醇溶液25 mL于振荡器200 r/min振荡10 min;4 000 r/min离心 5 min,取上清液 1 mL,加入4 mL去离子水后涡旋混合5 s,调节pH值至7~8之间。
呕吐毒素:粉碎并称取鲜食玉米样品5.0 g,置入100 mL具塞三角瓶中,加入25 mL去离子水,于 150 r/min振荡器上振荡 10 min;4 000 r/min离心5 min,取上清液 1 mL,加入 4 mL去离子水后涡旋混合5 s。
玉米赤霉烯酮:粉碎并称取鲜食玉米样品5.0 g,置入100 mL具塞三角瓶中,加入60%甲醇溶液 50 mL于振荡器150 r/min振荡 10 min;4 000 r/min离心 5 min,取上清液 0.5 mL,加入4.5 mL去离子水涡旋振荡5 s以充分混匀。
1.4.2 检测步骤 每孔加入样品或标准品50 μL,再分别加入对应的酶标物50μL,抗试剂50 μL,轻轻振荡混匀,盖板膜盖板置25℃避光反应30 min。揭开盖板膜,甩干液体,用对应的毒素洗涤液250μL洗涤4~5次,每次间隔10 s,并用吸水纸拍干。依次加入底物显色A液50μL和底物显色B液50μL,轻轻振荡混匀,盖板膜盖板25℃避光反应15 min。加入终止液50μL,振荡混匀,设定酶标仪分别于450 nm和630 nm进行双波长检测,测定每孔OD值。
1.4.3 结果判定

式中,B表示标准品或样品的吸光度值;B0表示0 μg/kg标准品的吸光度值。
以标准品百分吸光率为纵坐标,以对应毒素标准品浓度(μg/kg)的对数为横坐标,绘制标准曲线图。将样品的百分吸光率代入标准曲线中,从标准曲线上读出样品所对应的浓度,乘以稀释倍数即为样本中真菌毒素实际含量。
1.5 数据处理与分析
每个处理均测定3次,取3次平均值作为测定结果。采用Origin 8.5和Microsoft Excel进行统计分析和作图;运用Duncan’s检验进行差异显著性分析(P<0.05);产毒真菌与毒素积累相关性采用SPSS 17.0软件进行Pearson相关分析。
2 结果与分析
2.1 玉米籽粒发育期间污染真菌分离与鉴定
2.1.1 形态鉴定 参考《真菌鉴定手册》[12]对玉米籽粒主要污染真菌菌落颜色、菌落质地和分生孢子形态进行初步鉴定。镰刀菌在PDA培养基中产生大量棉絮状气生菌丝,并产生紫红色色素;大型孢子多细胞,两端尖而弯曲呈镰刀型(图1 A)。黄曲霉菌落初略带黄色,后渐变黄绿色,终成褐色;分生孢子圆形,呈串珠状(图1 B)。青霉菌落绿色、青绿色或灰绿色;分生孢子梗聚成孢梗束,顶端生排列成帚状的间枝;分生孢子串呈不分枝的链状,单个孢子球形、卵圆形或椭圆形(图1 C)。毛霉气生菌丝发达,在PDA培养基横向生长,呈棉絮状或羊毛状,初为白色渐变为灰黑色或灰褐色;孢子囊较大,孢子球形、椭圆形或不规则(图1 D)。

图1 污染真菌的菌落和孢子形态
2.1.2 分子鉴定 对菌株18S rDNA的ITS序列进行扩增,获得长约500 bp的片段,通过Blast比对,并进行系统发育分析,结果(图2)表明,Fungus 1#与 Fusarium fujikuroi同源性最高,Fungus 2#与Fusarium oxysporum同源性最高,Fungus 3#与Fusarium verticillioides同源性最高,Fungus 4#与Penicillium oxalicum同源性最高,Fungus 5#与Aspergillus flavus同源性最高,Fungus 6#与Mucor irregularis同源性最高。因此可以鉴定Fungus 1#~6#依次为藤仓镰刀菌、尖孢镰刀菌、轮枝镰刀菌、草酸青霉、黄曲霉和多变根毛霉。

图2 基于18SrDNA序列构建的优势真菌菌株系统进化树
2.2 玉米籽粒发育期间优势污染真菌分析
如表1所示,污染真菌以镰刀菌和青霉为主,其次是黄曲霉和毛霉,还有极少量其他类型真菌。从各发育期来看,授粉后0~23 d,玉米籽粒处于授粉、灌浆和乳熟阶段,真菌污染率较低,在0.1% ~1.3%之间;授粉后35~55 d,玉米处于蜡熟期和完熟期,真菌污染率比授粉初期明显增加,镰刀菌和黄曲霉在授粉后45 d的污染率最高。从品种角度分析,郑单958和宇玉268籽粒均在授粉后45 d真菌污染率达到最大值,青农11在授粉后55 d真菌污染率达到最大值。

表1 三个玉米品种籽粒发育期间污染真菌及菌相分布
2.3 玉米籽粒发育期间毒素积累分析
三个玉米品种随籽粒发育呕吐毒素含量变化情况如图3A所示。青农11在授粉后45 d呕吐毒素含量达到最大值,为(33.33±2.75)μg/kg,与其他两个品种差异显著(P<0.05);郑单958呕吐毒素含量在授粉后55 d达到最大值,为(28.99±1.91)μg/kg,与其他两个品种差异显著(P<0.05);宇玉268在授粉后23 d达到最大值,为(25.68±1.8)μg/kg,与其他两个品种差异不显著(P>0.05)。说明玉米籽粒发育期间呕吐毒素含量的变化受品种和生育期影响较大。
郑单958、青农11和宇玉268黄曲霉毒素B1含量最大值均出现在授粉后0 d,分别为(0.190±0.036)μg/kg、(0.203±0.033)μg/kg、(0.171±0.006)μg/kg。黄曲霉毒素 B1含量在授粉后先下降,之后呈现平稳上升的趋势,青农11和宇玉268在授粉后第45 d再次达到峰值,分别为(0.195±0.018) μg/kg和 (0.152±0.02)μg/kg,郑单 958在第 55 d再次达到峰值,为(0.172±0.02)μg/kg,且三者与授粉期相比略有减少但差异不显著(P>0.05)(图3 B),说明玉米籽粒发育期间黄曲霉毒素B1含量是动态变化的,受真菌污染和外界环境因素影响较大。
郑单958和宇玉268玉米赤霉烯酮含量均在授粉后第55 d达到最高值,青农11在第45 d达到最高值。与呕吐毒素和黄曲霉毒素B1相比,玉米赤霉烯酮含量变化比较平稳,籽粒各个发育阶段之间差异不显著(P>0.05),但品种之间具有一定差异。青农11玉米赤霉烯酮含量高于郑单958,除第23 d外,其他时间均差异不显著(P>0.05);宇玉268玉米赤霉烯酮含量在各个阶段均显著低于其他两个品种(P<0.05)(图3C)。
2.4 玉米籽粒发育期间主要产毒真菌与真菌毒素相关性分析
呕吐毒素和玉米赤霉烯酮的产毒真菌主要是镰刀属真菌[13],黄曲霉毒素 B1的产毒真菌主要是黄曲霉等真菌[14,15]。Pearson相关系数反映了两个变量之间的亲密度和方向,绝对值在0~0.1之间表示没有相关性,0.1~0.3之间表示弱相关,0.3~0.5之间表示中等相关,大于0.5表示强相关[16]。根据分析结果(表2),呕吐毒素和玉米赤霉烯酮与镰刀菌含量之间相关系数绝对值均小于0.5,且不具有显著差异(P>0.05),说明呕吐毒素和玉米赤霉烯酮含量与镰刀菌之间弱相关或不相关;黄曲霉毒素B1与黄曲霉的相关系数绝对值均大于0.4,且具有显著(P<0.05)或极显著差异(P<0.01),说明黄曲霉毒素 B1含量与黄曲霉具有一定的相关性。

图3 玉米籽粒发育期间真菌毒素含量变化
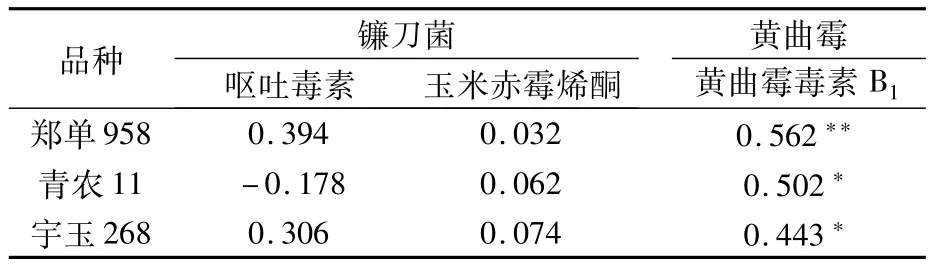
表2 主要产毒真菌与真菌毒素相关性分析
3 讨论与结论
研究玉米籽粒发育期间污染真菌和真菌毒素积累规律,可以更好地控制真菌在玉米收获时和仓储期间生长,保障玉米质量安全。本试验在玉米籽粒发育期间分离出的优势污染真菌多为玉米穗腐病的致病菌,经形态鉴定和基于18S rDNA的ITS测序序列,确定污染真菌分别是轮枝镰刀菌、尖孢镰刀菌、藤仓镰刀菌、草酸青霉、黄曲霉和多变根毛霉,与丁梦军等[17]对山东省玉米穗腐病优势病原菌的分离鉴定结果基本一致。镰刀菌在玉米籽粒发育期间污染率最高,与孙华等[18]从黄淮海夏玉米主产区分离的优势真菌类型一致。本研究发现玉米籽粒在授粉后0~23 d即有真菌污染,授粉后35~55 d真菌污染率明显增加,金柳艳等[19]在对夏玉米籽粒乳熟期到完熟期带菌检测分析过程中发现,表面无症状的玉米籽粒在乳熟期即携带大量病原真菌,且完熟期带菌量显著高于乳熟期,与本研究结果一致。
对玉米籽粒发育期间真菌毒素含量变化进行分析发现,不同品种的玉米真菌毒素的变化趋势基本一致,黄曲霉毒素B1含量变化在品种之间差别不显著,但宇玉268玉米赤霉烯酮含量显著低于郑单958和青农11,这可能与不同品种玉米穗苞叶长度、紧实程度、花丝强度等玉米本身的特性有关[20]。不同毒素含量的变化趋势有所不同,呕吐毒素和玉米赤霉烯酮含量在籽粒发育后期均大于授粉期,而呕吐毒素积累量更高,说明两种毒素均处于动态积累过程,且与产毒真菌镰刀菌不具有相关性;黄曲霉毒素B1含量在授粉后下降,之后逐渐升高,籽粒发育后期低于授粉期,且与产毒真菌黄曲霉具有一定的相关性。可能是因为镰刀菌毒素与镰刀菌类型、温度、氧、水分活度等[21-23]条件有关;黄曲霉孢子发达,在吐丝期即可通过气流或水滴从花丝进入玉米穗,具有更有利的产毒条件[8];呕吐毒素最适产生温度是15~25℃,玉米赤霉烯酮和黄曲霉毒素B1的最适产生温度均在 30℃左右[24,25],玉米籽粒发育处于九、十月份,气温凉爽,更适合呕吐毒素的积累。本次调查可为调节玉米采收后的储藏条件、控制真菌毒素的生成、保障玉米质量安全提供技术依据。
