M2型丙酮酸激酶对瘢痕疙瘩成纤维细胞功能的影响
2020-11-13杨怡圆周仁鹏候家琳王麒瑞梁奕敏王丹茹
杨怡圆 周仁鹏 候家琳 王麒瑞 梁奕敏 王丹茹
瘢痕疙瘩是以细胞外基质(Extracellular matrix,ECM)过度沉积于真皮,以及成纤维细胞过度增殖为特征的过度纤维化疾病[1-3],具体的病因学和形成机制尚未明确。目前,临床上采用手术切除后进行放疗的方法进行治疗[4-5]。根据瘢痕疙瘩形成机制,针对有效靶点设计药物进行治疗是当前的研究热点。
瘢痕疙瘩与肿瘤有一定的相似性[6-7],在生物能量代谢方面,瘢痕疙瘩成纤维细胞也表现出与肿瘤细胞相似的代谢特征:以糖酵解方式为主进行糖代谢。这种代谢方式使得瘢痕疙瘩成纤维细胞无论在常氧或缺氧环境下都能保证其增殖和存活[8]。M2型丙酮酸激酶(Pyruvate kinase M2,PKM2)是糖代谢中的关键酶之一,是调控有氧糖酵解的关键因子,并具有蛋白激酶活性和调控基因表达等其他功能[9-12]。但PKM2在瘢痕疙瘩成纤维细胞中的表达和作用尚未得到关注。本研究旨在初步评估PKM2对瘢痕疙瘩成纤维细胞功能的影响。
1 材料和方法
1.1 实验试剂及仪器
DMEM高糖培养基(Hyclone公司,美国);胎牛血清、0.25%EDTA-胰蛋白酶(Gibco公司,美国);Ⅰ型胶原酶(SERVA公司,德国);Trizol(Invitrogen公司,美国);逆转录试剂盒、Real-time PCR试剂盒(TaKaRa公司,日本);Ki67抗体(迈新公司);PKM2抗体(CST公司,美国);β-actin抗体(Affinity公司,美国);羊抗鼠/兔二抗(Jackson公司,美国);酶标羊抗小鼠/兔IgG(福州迈新生物技术开发有限公司);Collagen Ⅰ抗体、Collagen Ⅲ抗体(Abcam公司,美国);CCK - 8 细胞增殖检测试剂盒(同仁化学,日本);EdU-555荧光细胞增殖检测试剂盒(上海碧云天生物技术有限公司);PKM2-IN-1(MCE公司,美国);Seahorse XF分析仪(安捷伦公司,美国);Citation 5成像仪(BioTek公司,美国);StepOnePlus PCR仪(Life Technologies公司,美国)。
1.2 瘢痕疙瘩与正常皮肤成纤维细胞培养
经患者知情同意后,收集我科手术获取的未经任何药物或激素治疗的瘢痕疙瘩组织及手术切除部位周围无瘢痕存在的正常皮肤组织,将这些组织取部分全层皮肤进行石蜡包埋,制备成石蜡块保存备用。余下组织在修剪表皮及多余皮下组织后用眼科剪剪成肉糜样,加入0.3%胶原酶溶液,37 ℃消化4~6 h;经两次离心、弃上清、培养基重悬后,将细胞接种于10 cm培养皿,放入37 ℃、5%CO2细胞培养箱。24 h后换液,镜下观察细胞生长情况。当细胞生长面积达培养皿80%~90%时,加入适量的0.25%EDTA-胰蛋白酶,37 ℃消化3 min。细胞变圆、部分细胞漂起时,加入2~3 mL完全培养基终止消化。1 000 r/min离心3 min,弃上清,加入适量完全培养基,此为第一代瘢痕疙瘩成纤维细胞或正常皮肤成纤维细胞,记为P1。后续实验取P1~4成纤维细胞进行实验。
1.3 免疫组化染色检测组织中PKM2及增殖相关标志物(Ki67)的表达
以3~4 μm厚度制备瘢痕疙瘩组织和正常皮肤组织切片,二甲苯脱蜡,梯度乙醇脱水,柠檬酸钠高温高压修复抗原2 min;4%H2O2去除内源性过氧化物酶;孵育一抗(PKM2、Ki67)和二抗(酶标羊抗小鼠/兔IgG);显色、复染、返蓝;无水乙醇脱水,晾干后用中性树胶封片。根据文献[13-14]的方法,采用免疫组化染色快速评分(Q)法:每张切片至少评价5个高倍镜视野,评估其阳性细胞与染色强度;阳性细胞评分(P)按照阳性细胞数(N)占同类细胞数(M)的百分比评估,P=N/M×100%;染色强度评分(I)按照切片中细胞着色深浅评分,0分为细胞不着色,浅黄色为1分,棕黄色为2分,棕褐色为3分。根据Q=P×I计算免疫组化染色快速评分。
1.4 Real-time PCR检测成纤维细胞中PKM2及纤维化指标的表达
以每皿4×105个细胞将瘢痕疙瘩成纤维细胞和正常皮肤成纤维细胞分别接种于6 cm培养皿中,待细胞生长至90%后,用Trizol充分裂解细胞,按说明书提取细胞RNA,Nano Drop分光光度计测RNA浓度。使用逆转录试剂盒逆转录为cDNA,步骤参照试剂盒使用说明书。引物均由上海生工公司合成:β-actin(F 5′-TCCTCCTGAGCGCAAGTACTCT-3′、R 5′-GCTCAGTAACAGTCCGCCTAGA-3′;PKM1(F 5′- TTGTGCGAGCCTCAAGTCACT -3′、R 5′- CTGACGAGCTGTCTGGGGAT -3′;PKM2(F 5′-CGCATGCAGCACCTGATTG -3′、R 5′- CCACTGCAGCACTTGAAGGA -3′);COL1A1(F 5′- AGTGGTTTGGATGGTGCCAA -3′、R 5′- GCACCATCATTTCCACGAGC -3′);COL1A2(F 5′- TGGTCTCGGTGGGAACTTTG -3′、R 5′- CACCCTGTGGTCCAACAACT -3′);COL3A1(F 5′-CTTCTCTCCAGCCGAGCTTC -3′、R 5′- TAGTCTCACAGCCTTGCGTG -3′)。使用StepOnePlus PCR仪及Real-time PCR试剂盒进行荧光定时定量PCR扩增,以管家基因 β-actin的mRNA水平作为对照,通过2-△△Ct法来进行相对定量。
1.5 Western-blot检测成纤维细胞中PKM2的表达
按每皿9×105个细胞将瘢痕疙瘩成纤维细胞和正常皮肤成纤维细胞分别接种于10 cm培养皿中,待细胞生长至90%后,用全细胞裂解液充分裂解细胞提取总蛋白,以每个样品30 μg蛋白量进行SDS-PAGE。转膜:按照阳极-海绵-滤纸-PVDF膜-凝胶-滤纸-海绵-阴极固定后进行湿转;封闭:5%脱脂牛奶PBST溶液室温封闭PVDF膜;加入相应一抗(PKM2、β-actin),4 ℃孵育过夜;洗膜后加入相应二抗(羊抗鼠/兔二抗),37 ℃孵育2 h。将显影液均匀加到PVDF膜上,等待1 min后,暗室曝光。
1.6 Seahorse XF技术检测糖酵解功能
提前24 h将两种成纤维细胞分别接种于96孔板中,每孔细胞数约为2.5×104个,每组至少6个复孔;水化探针:在水化96孔板里加入细胞培养级的水200 μL,将探针板放在水化孔板上,置于37 ℃无CO2培养箱过夜后吸出。清洗细胞,保留每孔20 μL原始培养基,缓慢贴壁加入200 μL分析培养基,探针板每孔加入200 μL的XF校准液,置入37 ℃无CO2培养箱45~60 min备用。检测用试剂按产品说明书配置,按顺序在孔道A、B、C中依次加入glucose、oligomycin、2-DG相应试剂,使用Seahorse XF分析仪检测,探针板与水化孔板组装、校准后,将水化孔板替换成细胞培养板开始检测。
1.7 PKM2抑制剂处理瘢痕疙瘩成纤维细胞后检测其增殖、糖酵解功能及胶原合成
1.7.1 PKM2抑制剂处理瘢痕疙瘩成纤维细胞
PKM2抑制剂(PKM2-IN-1)购自MCE公司(美国),按照说明书用细胞培养级的DMSO溶解药物配制成10 mmol/L储存液。使用时用DMSO稀释储存液至不同药物浓度后,加入完全培养基,配制成含所需药物浓度的培养液后用于后续实验。
1.7.2 EdU-555荧光标记检测细胞增殖
按每孔约2×104个细胞将瘢痕疙瘩成纤维细胞接种于24孔板中,预培养过夜。更换含不同浓度(0、0.5、2 μmol/L)PKM2抑制剂的完全培养基处理后,吸去1/2体积培养液,按EdU检测试剂盒说明书配置2倍的EdU工作液并预热,与剩余培养基等体积加入24孔板中,使24孔板中的EdU终浓度为10 μmol/L;继续孵育细胞3 h进行EdU标记;4%多聚甲醛室温固定15 min后洗涤细胞,每孔用500 μL的含0.3%Triton X-100的PBS(通透液)进行通透,室温10~15 min;洗涤细胞1~2次。EdU染色:按说明书配制Click反应液,每孔加入300 μL的Click反应液,均匀覆盖孔底,室温避光30 min;细胞核染色:按说明书配制 Hoechst染色液,洗涤后每孔加300 μL,室温避光孵育10 min;洗涤后使用Citation 5成像仪检测。
1.7.3 CCK-8法检测细胞增殖情况
按每孔约2 000个细胞将瘢痕疙瘩成纤维细胞接种至96孔板,在37 ℃、5%CO2培养箱中预培养24 h后更换为含PKM2抑制剂(浓度2 μmol/L)的完全培养基,每组至少3个复孔。继续培养培养 24、48、72 h。PBS清洗细胞后,每孔加入90 μL的DMEM完全培养基与10 μL的CCK-8溶液,培养箱中继续孵育2 h,酶标仪检测450 nm处的光密度值。
1.7.4 Seahorse XF技术检测细胞糖酵解功能
提前24 h将瘢痕疙瘩成纤维细胞接种于96孔板中,每孔细胞数约为2.5×104个,待细胞贴壁生长后,更换含不同浓度(0、0.5、1、2 μmol/L)PKM2抑制剂的完全培养基;后续步骤同1.6。
1.7.5 Western-blot检测细胞中Ⅰ、Ⅲ型胶原的表达
按每皿4×105个细胞将两种成纤维细胞分别接种于6 cm培养皿中,待细胞贴壁生长后,用含不同浓度(0、0.5、1、2 μmol/L)PKM2抑制剂的完全培养基处理瘢痕疙瘩成纤维细胞24 h。待细胞长满至90%后,收集细胞,以全细胞裂解液提取细胞总蛋白,后续步骤同1.5,其中一抗为Collagen Ⅰ、Collagen Ⅲ、β-actin,二抗为羊抗鼠/兔二抗。
1.8 统计学分析
2 结果
2.1 两种组织及其相应的成纤维细胞中PKM2的表达
如图1所示,PKM2在正常皮肤组织中阳性强度更弱、阳性范围更少;在瘢痕疙瘩组织中,阳性产物呈棕黄色,主要定位在成纤维细胞内。免疫组化快速评分结果表明,PKM2在瘢痕疙瘩组织中的表达较正常皮肤组织明显升高(P<0.001)。

A:免疫组化染色(蓝色箭头:染色阴性;红色箭头,染色阳性);B:免疫组化快速评分(***: P<0.001)A: Immunohistochemical staining (Blue arrow: negative staining; Red arrow: positive staining); B: Statistical results of immunohistochemistry score(***: P<0.001)图1 免疫组化染色检测PKM2在瘢痕疙瘩组织及正常皮肤组织中的表达Fig. 1 Expression of PKM2 in keloid tissue and normal skin tissue detected by immunohistochemistry
如图2所示,mRNA水平检测结果表明,瘢痕疙瘩成纤维细胞中的PKM2表达水平显著高于正常皮肤成纤维细胞,且差异具有统计学意义(P<0.01),由同一基因编码的不同转录本PKM1的表达两种细胞无显著差异(P>0.05);Western-blot结果提示瘢痕疙瘩成纤维细胞的PKM2蛋白表达显著高于正常皮肤成纤维细胞(P<0.05)。

A:Western-blot检测PKM2蛋白表达;B:灰度值分析;C:Real-Time PCR检测PKM2的mRNA水平(*: P<0.05; **: P<0.01)A: Expression of PKM2 by Western blot; B: Grayscale analysis; C: Expression of PKM2 mRNA by Real-time PCR (*: P<0.05; **: P<0.01)图2 正常皮肤成纤维细胞和瘢痕疙瘩成纤维细胞PKM2表达Fig. 2 Expression of PKM2 in KFs and NFs
2.2 两种组织中增殖相关标志物检测及其相应成纤维细胞中纤维化指标检测
Ki67是常用的增殖相关标志物。图3表明,Ki67蛋白免疫组化阳性染色定位于细胞核,阳性产物呈棕黄色;Q值统计显示瘢痕疙瘩真皮层中Ki67表达明显高于正常皮肤组织(P<0.01)。
瘢痕疙瘩成纤维细胞中COL1A1与COL1A2的mRNA表达水平明显高于正常皮肤成纤维细胞,两者差异具有显著性(P<0.001),而COL3A1的mRNA表达未见明显差异(P>0.05);相比正常皮肤成纤维细胞,瘢痕疙瘩成纤维细胞中Ⅰ型胶原与Ⅲ型胶原mRNA的比例发生改变(图4)。

A:免疫组化染色(蓝色箭头:染色阴性;红色箭头,染色阳性);B:免疫组化快速评分A: Immunohistochemical staining (Blue arrow: negative staining; Red arrow: positive staining); B: Statistical results of immunohistochemistry score图3 免疫组化检测Ki67在瘢痕疙瘩组织及正常皮肤组织中的表达(**: P<0.01)Fig. 3 Expression of Ki67 in keloid tissue and normal skin tissue detected by immunohistochemistry (**: P<0.01)

A:COL1A1、COL1A2及COL3A1的mRNA表达;B:Ⅰ型胶原与Ⅲ型胶原mRNA比例(***: P<0.001)A: The relative mRNA expression of COL1A1,COL1A2 and COL3A1; B: Expression ratio of collagen Ⅰ and collagen Ⅲ (***: P<0.001)图4 Real-time PCR 检测正常皮肤成纤维细胞和瘢痕疙瘩成纤维细胞中COL1A1、COL1A2及COL3A1的mRNA表达Fig. 4 The relative mRNA expression of COL1A1, COL1A2 and COL3A1 detected by Real-time PCR
2.3 正常皮肤成纤维细胞及瘢痕疙瘩成纤维细胞糖酵解水平检测
实验以细胞外基质酸化率(Extra-cellular acidification rate,ECAR)为指标进行记录。加入葡萄糖前的ECAR水平为非糖酵解酸化,加入葡萄糖后增加的ECAR水平为糖酵解水平,加入寡霉素后继续增加的ECAR值代表糖酵解储备,在加入2-DG之前所测得的最大ECAR值与非糖酵解酸化之差反映了细胞的糖酵解最大能力。瘢痕疙瘩成纤维细胞的非糖酵解酸化、糖酵解水平、糖酵解储备、糖酵解最大能力分别比正常皮肤成纤维细胞高出约1.9倍、2.3倍、1.6倍和2.1倍(图5)。
2.4 抑制PKM2后瘢痕疙瘩成纤维细胞增殖活性
应用PKM2抑制剂(PKM2-IN-1)处理瘢痕疙瘩成纤维细胞后,其增殖受到抑制,且呈浓度依赖性。分别用0、0.5、2 μmol/L的PKM2抑制剂处理细胞24 h后,统计成纤维细胞EdU阳性率。结果显示,空白对照组与条件对照组中瘢痕疙瘩成纤维细胞EdU阳性率无统计学差异,实验组EdU阳性率相比条件对照组(0 μmol/L)明显下降,低浓度(0.5 μmol/L)时即表现出了明显的抑制作用,中浓度(2 μmol/L)时细胞增殖率下降超过50%;选用药物浓度2 μmol/L的PKM2抑制剂分别作用于瘢痕疙瘩成纤维细胞24 h、48 h、72 h后,CCK-8结果显示瘢痕疙瘩成纤维细胞生长曲线显著下降(图6)。
2.5 抑制PKM2后瘢痕疙瘩成纤维细胞糖酵解功能
如图7所示,应用PKM2抑制剂(PKM2-IN-1)处理瘢痕疙瘩成纤维细胞后,其产酸水平显著降低,且随PKM2抑制剂浓度增加,而逐渐下降。其中瘢痕疙瘩成纤维细胞的非糖酵解酸化并未表现出明显变化;糖酵解水平分别下降至对照组(0 μmol/L)的0.77倍(0.5 μmol/L)、0.37倍(1 μmol/L)、0.23倍(2 μmol/L);糖酵解储备分别下降至对照组(0 μmol/L)的0.72倍(0.5 μmol/L)、0.12倍(1 μmol/L)、0.002倍(2 μmol/L);糖酵解的最大能力分别下降至对照组(0 μmol/L)的0.76倍(0.5 μmol/L)、0.33倍(1 μmol/L)、0.19倍(2 μmol/L)。

A:ECAR曲线;B:非糖酵解酸化;C:糖酵解水平;D:糖酵解最大能力;E:糖酵解储备(*:P<0.05)A: ECAR curve; B: Non-glycolysis acidification; C: Glycolysis; D: Glycolytic maximum capacity; E: Glycolysis reserve(*: P<0.05)图5 瘢痕疙瘩成纤维细胞与正常皮肤成纤维细胞糖酵解压力测试Fig. 5 Glycolysis stress test of KFs and NFs

A:EdU荧光染色;B:EdU阳性细胞比例统计;C:CCK-8法测定细胞生长曲线(*:P<0.05;***: P<0.001)A: EdU staning; B: Quantitative EdU positive cell rates; C: CCK-8 showed the proliferation vitality of KFs(*:P<0.05;***: P<0.001)图6 PKM2-IN-1对瘢痕疙瘩成纤维细胞增殖的影响Fig. 6 Effect of PKM2-IN-1 on proliferation in KFs
2.6 抑制PKM2后瘢痕疙瘩成纤维细胞胶原蛋白表达水平
加入不同浓度PKM2抑制剂后,瘢痕疙瘩成纤维细胞Ⅰ型胶原蛋白表达水平随着PKM2抑制剂浓度增加而显著减少,Ⅲ型胶原蛋白表达水平并无明显变化(图8)。

A:ECAR曲线;B:非糖酵解酸化;C:糖酵解水平;D:糖酵解最大能力;E:糖酵解储备(P-IN-1:PKM2-IN-1;**: P<0.01;***: P<0.001)A: ECAR curve; B: Non-glycolysis acidification; C: Glycolysis; D: Glycolytic maximum capacity; E: Glycolysis reserve (P-IN-1: PKM2-IN-1; **: P<0.01; ***: P<0.001)图7 PKM2-IN-1对瘢痕疙瘩成纤维细胞糖酵解的影响Fig. 7 Effect of PKM2-IN-1 on glycolysis metabolism in KFs
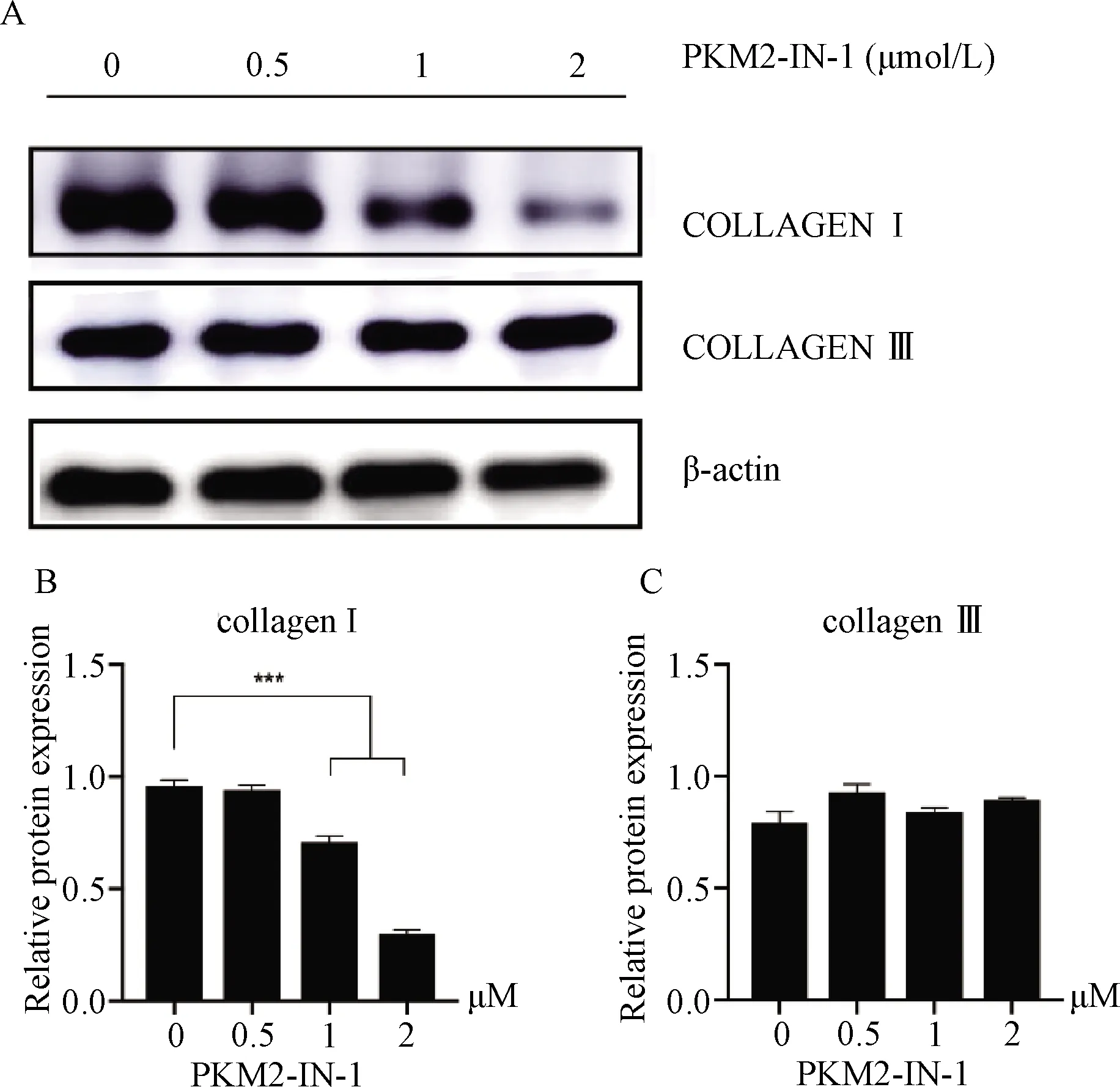
A:Western-blot检测Ⅰ、Ⅲ型胶原蛋白表达; B:Ⅰ型胶原灰度值分析;C:Ⅲ型胶原灰度值分析(***: P<0.001)A: Expression of collagen Ⅰ and collagen Ⅲ by Western blot; B: Grayscale analysis of collagen Ⅰ; C: Grayscale analysis of collagen Ⅲ (***: P<0.001)图8 PKM2-IN-1对瘢痕疙瘩成纤维细胞胶原合成的影响Fig. 8 Effect of PKM2-IN-1 on collagen synthesis in KFs
3 讨论
近年来,瘢痕疙瘩的治疗取得了极大的进展,但其形成机制仍未完全阐明。“肿瘤”类型瘢痕疙瘩具有明显的肿瘤临床特征,同时伴有癌基因激活,提示瘢痕疙瘩具有肿瘤相关特性。既往的研究显示,瘢痕疙瘩具有与肿瘤相似的糖代谢相关改变[8,15-16],但目前研究成果较少,且未针对某一特定靶点进行阐述。
本研究发现,瘢痕疙瘩成纤维细胞糖酵解功能上调,其糖酵解水平与糖酵解最大能力也显著增高。PKM2在瘢痕疙瘩成纤维细胞中高表达;在抑制PKM2后瘢痕疙瘩成纤维细胞糖酵解功能下调,并随抑制剂浓度增高,其糖酵解功能的下调作用越明显。意味着瘢痕疙瘩成纤维细胞中高表达的糖酵解关键基因PKM2可调控其糖代谢改变。寡霉素是ATP合成抑制剂,可抑制线粒体呼吸并将能量更多地转移进糖酵解通路。经寡霉素处理后出现糖酵解储备意味着在模拟线粒体氧化通路阻断后,糖酵解的代偿能力增加。本研究中,瘢痕疙瘩成纤维细胞的糖酵解储备增高并未显示出显著性,可能是瘢痕疙瘩患者具有个体差异及样本量有限所致。考虑到其糖酵解水平及糖酵解最大能力均显著高于正常皮肤成纤维细胞,我们仍认为瘢痕疙瘩成纤维细胞的糖酵解活性是上调的。细胞非糖酵解酸化中包括其他生化途径产生的酸性物质,例如CO2溶于水形成的酸。瘢痕疙瘩成纤维细胞非糖酵解酸化率显著性增高,说明在糖酵解之外,其他代谢途径可能也存在上调情况。抑制PKM2对瘢痕疙瘩成纤维细胞的非糖酵解酸化率影响没有显著改变,进一步说明PKM2是糖酵解关键基因,对其他代谢通路没有显著影响。
PKM1与PKM2都由PKM基因编码,通过PKM前体mRNA可变剪接,产生含有特异性外显子9的PKM1和特异性外显子10的PKM2[11]。瘢痕疙瘩成纤维细胞与正常皮肤成纤维细胞PKM1表达并无差异,PKM2表达显著上调,说明PKM基因中PKM2尤为关键。
Ki67是一种增殖细胞相关蛋白,定位于细胞核内,其功能与有丝分裂密切相关。在细胞周期中的分裂间期其表达水平很低,而在有丝分裂期表达水平达到峰值。Ki67作为增殖相关标志物之一,在临床病理分析中应用十分广泛,因此本实验对瘢痕疙瘩及正常皮肤组织切片进行了Ki67的免疫组化染色及半定量分析。EdU是一种胸腺嘧啶核苷酸类似物,代替胸腺嘧啶参与DNA的复制。后续体外实验中,CCK-8生长曲线可直观显示细胞数量变化,EdU掺入法可准确反映DNA的复制水平,充分说明瘢痕疙瘩成纤维细胞具有更高的增殖活性且通过抑制PKM2可抑制其增殖。
Ⅰ、Ⅲ型胶原与伤口愈合关系密切。早期研究发现,瘢痕疙瘩组织Ⅰ、Ⅲ型胶原中的mRNA水平分别上调19.2倍和20.1倍[17],而近期相关组织学研究显示瘢痕疙瘩组织中Ⅰ、Ⅲ型胶原比例为17∶1,远高于普通瘢痕的6∶1[18-19]。这说明Ⅰ型胶原的异常增多在瘢痕疙瘩形成中尤为关键。本研究显示,随着PKM2抑制剂浓度增高,Ⅰ型胶原纤维蛋白表达逐渐减少,Ⅲ型胶原纤维蛋白无明显差异,两者的比值下降。我们推测在瘢痕疙瘩中PKM2可能主要影响Ⅰ型胶原的合成,而两者比例下降更是一个积极的结果。
本研究显示,PKM2可以影响瘢痕疙瘩成纤维细胞的增殖、糖代谢及胶原合成,但其在瘢痕疙瘩发病机制中的作用还有待于进一步阐明。
综上所述,PKM2在瘢痕疙瘩成纤维细胞中高表达,抑制PKM2可抑制瘢痕疙瘩成纤维细胞的糖酵解功能、增殖以及胶原合成。本研究为揭示瘢痕疙瘩发病相关机制与治疗药物开发提供了新的思路及研究基础。
