羊毛甾醇对X射线照射后大鼠晶状体混浊形成的影响及机制
2020-11-12石圆圆仇长宇聂闯宫玉波李雨心罗灵
石圆圆,仇长宇,聂闯,宫玉波,李雨心,罗灵
战略支援部队特色医学中心,北京100101
晶状体是人体中对放射最敏感的组织之一[1]。既往研究认为,放射性白内障产生的阈值为2 Gy,近年研究认为,放射性白内障的发生可能低于此阈值,甚至是随机事件[2,3]。而随着电离辐射技术的广泛应用,职业性放射性白内障仍不时发生[4~6],但放射性白内障发病机制仍不明确。既往研究提示,γ-射线照射可致大鼠晶状体中多种晶状体蛋白发生过氧化,可溶性蛋白含量减少[7~12]。目前普遍认为晶状体蛋白异常聚合形成不溶的复合物从而形成混浊是先天和老年性白内障发生的主要原因[13]。因此晶状体蛋白的异常聚合可能存在于放射性白内障的形成过程中。羊毛甾醇可在体外抑制晶状体上皮细胞(LEC)内多种已知的先天性白内障突变基因编码的蛋白聚集,从而抑制甚至逆转白内障的形成。并且玻璃体腔注射羊毛甾醇可逆转自然发生的狗的白内障,增加透明性[14]。羊毛甾醇能否在X射线引起的放射性晶状体损伤中发挥抑制晶状体蛋白的聚集作用,从而抑制白内障形成,目前尚无相关研究。2017年1月—2018年7月,我们探讨了羊毛甾醇对X射线照射后大鼠晶状体混浊形成的影响及机制。
1 材料与方法
1.1 材料 8周龄雄性SD大鼠[350~400 g,许可证号SCXK(京)2019-0010];SRA01/04 人LEC细胞株(美国 ATCC);M199培养液(美国Gibco),羊毛甾醇(美国Sigma),DMSO(上海Solarbio),RIPA裂解液试剂盒(北京雷根生物技术有限公司),BCA试剂盒(北京雷根生物技术有限公司),胎盘蓝(美国Sigma);体式显微镜(德国Catl Zeiss Stemi 305),Clinac 600C/D直线加速器(美国Varian),离心机(美国 Beckman),酶标仪(美国Rio-Rad)。
1.2 大鼠晶状体体外培养 选取8周龄SD大鼠,以颈椎脱臼法处死后,摘除眼球,剔除肌肉、筋膜等组织,安尔碘浸泡5 min,生理盐水冲洗3次,将眼球浸于M199培养液中,体式显微镜下自后极部剪开巩膜壁,取出晶状体,尽量去除晶状体表面的玻璃体,将晶状体放入24孔板中培养,每孔加入1 mL 的含有5×104U/L青霉素和5×104U/L链霉素的M199培养液。于37 ℃、5%CO2温箱中培养,培养1 d后弃去混浊晶状体,留取透明晶状体备用。
1.3 晶状体X射线照射及分组 晶状体于培养板中用X线加速器进行X射线照射,根据照射剂量分为分为0 Gy组、2 Gy组、4 Gy组、8 Gy组,每组3枚晶状体。于照射后1、3、5、7 d在体式显微镜下观察晶状体变化,并拍照记录。每48小时换液。另设8 Gy-羊毛甾醇组,于照射后即刻加入羊毛甾醇溶液(羊毛甾醇预先用DMSO溶解成混悬液,终浓度为40 μmol/L)。同时为除外渗透压或DMSO本身的影响,设立8 Gy-DMSO对照组,即照射后加入与羊毛甾醇组相同量的DMSO。
1.4 晶状体混浊度观察及计算 晶状体于培养板中,在体式显微镜下照相,照相背景为黑色,照相时使用相同放大倍率。图片中黑色代表晶状体透明,灰白色代表混浊。为定量分析羊毛甾醇干预效果,对8 Gy各组各时间点使用Image Pro Plus(IPP)软件计算灰度值,灰度数值越高,代表晶状体的混浊程度越重。
1.5 晶状体总可溶性蛋白浓度测定 对0 Gy组、8 Gy组、8Gy-DMSO组和8Gy-羊毛甾醇组于培养第1、3、5、7天进行蛋白抽提,每组3枚晶状体。按照裂解液试剂盒说明提取蛋白。主要步骤:将晶状体用300 μL裂解液于1.5 mL EP管中匀浆裂解,其后加入200 μL裂解液,冰上静置10 min。置离心机中(4 ℃下,15 000 r/min,15 min)离心取上清。按照BCA试剂盒方法,制作标准曲线。将上述上清液稀释40倍后加入96孔板中,各孔加入BCA工作液后,37 ℃下温浴30 min。用酶标仪测定各样品孔在540 nm处的吸光度,根据标准曲线计算各孔蛋白浓度。
1.6 人LEC培养及X射线照射 采用SRA01/04 LEC细胞株以8.0×104/孔细胞密度接种于24孔培养板,培养36 h后达到90%融合,分为实验组与对照组;于室温下用X线加速器照射,照射总剂量分别为0 Gy、2 Gy、4 Gy、8 Gy,照射后更换新完全培养液,置于37 ℃培养箱培养。照射后实验组立即加入1%DMSO溶解的羊毛甾醇,羊毛甾醇终浓度为40 μmol/L,对照组仅加入等量的DMSO。实验组及对照组各为4个复孔。
1.7 LEC细胞形态学观察及活细胞百分率计算 倒置相差显微镜下观察细胞生长状态及死亡情况,照射后72 h每组选一孔行台盼蓝染色检查计算活细胞百分率。
1.8 人LEC中总可溶性蛋白浓度测定 照射后72 h对各孔细胞进行蛋白抽提及进行总的可溶性蛋白浓度测定。主要步骤:吸去培养液,每孔细胞加4 ℃预冷的PBS 0.01 mol/L(pH 7.2~7.3),洗涤2次。将PBS弃净后每孔细胞加50 μL的RIPA裂解液,摇匀后于冰上裂解10 min。将细胞碎片和裂解液移至0.5 mL离心管中。于4 ℃下12 000 r/min离心5 min,将上清液提取用于蛋白浓度测定。按照BCA试剂盒说明进行。主要步骤:首先制作标准曲线。然后将10 μL样品加入96孔板的样品孔中,补加PBS至20 μL。各孔加入BCA工作液,37 ℃放置30 min。用酶标仪测定各样品孔在540 nm处的吸光度,根据标准曲线计算出各孔蛋白浓度。
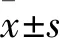
2 结果
2.1 体外培养晶状体变化 随着培养时间延长,未经照射即0 Gy组大鼠晶状体基本保持透明,至第7天仅出现轻微皮质混浊;2 Gy组晶状体于照射后第5天开始出现轻度皮质混浊;4 Gy组晶状体于照射后第3天开始出现部分的轻度皮质混浊,第5天出现较为明显的不均匀皮质混浊;8 Gy组晶状体及8 Gy-DMSO组于照射后部分晶状体于第1天即开始出现局部的轻度皮质混浊,第3天不均匀混浊继续加重,第5天至第7天出现明显的弥漫皮质混浊。8 Gy-羊毛甾醇组照射后第1天及第3天混浊不明显,第5天出现弥漫混浊,第7天混浊进一步加重。因此,随照射剂量的增加,晶状体混浊出现更早,程度更重;8 Gy-羊毛甾醇组较8 Gy组及8 Gy-DMSO组出现混浊时间延迟。8 Gy组、8 Gy-DMSO组、8 Gy-羊毛甾醇组各时点灰度值比较见表1。
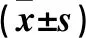
表1 8 Gy组、8 Gy-DMSO组、8 Gy-羊毛甾醇组不同时点灰度值比较
2.2 各组照射后不同时点晶状体总可溶性蛋白含量比较 0 Gy组、8 Gy组、8 Gy-DMSO组及8 Gy羊毛甾醇组不同时点晶状体总可溶性蛋白含量比较见表2。

表2 各组不同时点晶状体总可溶性蛋白含量比较
2.3 照射72 h后LEC细胞形态及活细胞百分率 照射72 h后细胞形态无明显改变,台盼蓝染色计算活细胞百分率为90%。照射后细胞在96 h开始出现明显死亡。
2.4 两组不同照射剂量晶状体上皮细胞中总可溶性蛋白含量比较 经0、2、4、8 Gy照射后72 h晶状体上皮细胞中总可溶性蛋白含量比较见表3。

表3 两组不同照射剂量晶状体上皮细胞中可溶性蛋白含量比较
3 讨论
白内障形成的机制一直未阐明,有观点认为先天性、老年性白内障发生的机制为各种原因导致晶状体蛋白聚合成不溶的大分子量复合物,从而形成晶状体内光散射和混浊[7]。晶状体蛋白是人类晶状体细胞浆中主要的结构蛋白,在晶状体可溶性蛋白中约占90%。它与周围的细胞骨架蛋白相互结合,整齐排列,保持晶状体的透明性[8]。近来研究发现羊毛甾醇通过抑制晶状体蛋白聚集或解聚已聚集的晶状体蛋白,可以预防或治疗白内障[14~16],是白内障药物治疗的重大突破。并且在人白内障标本中亦发现羊毛甾醇合酶活性与皮质性白内障的严重程度有相关性[15]。
研究显示放射也可引起动物晶状体内蛋白含量和结构的改变。Abdelkawi[7]发现,用γ射线对8周龄Wistar大鼠行单次或分次总剂量为4 Gy全身照射时,24 h后即可观察到总可溶性蛋白含量降低40%左右,其中α、β和γ晶状体蛋白均出现含量和分子质量的改变。在蛋白结构上,射线照射会造成晶状体蛋白的氨基酸位点发生氧化,分子伴侣功能发生下降,从而促进蛋白的聚集[10,12]。此外,基于羊毛甾醇及羊毛甾醇合酶已被证实存在于大鼠晶状体组织中[17],即具有作用于晶状体组织的分子基础,我们设计观察了羊毛甾醇在X射线照射大鼠晶状体或人LEC中的作用。
为能够连续并直观地观察晶状体混浊变化情况,我们选用了体外培养晶状体的方法。实验观察到X射线可促进体外培养的大鼠晶状体混浊的发生发展,且随照射剂量的增加,晶状体混浊发生越早,混浊愈重。其中,8 Gy剂量下在照射后第1天晶状体就会发生局部轻度混浊,第3天就开始出现较为明显的混浊,并且在7 d的观察时间框内发展为严重的晶状体全混浊。而2 Gy和4 Gy剂量时晶状体混浊出现时间较晚,且程度发展不一。为便于观察羊毛甾醇的抑制效果,我们选择予8 Gy剂量照射的晶状体加入羊毛甾醇溶液。结果显示,加入羊毛甾醇的晶状体在照射后第3天时明显较对照晶状体的透明度高,即混浊发生时间延迟2 d。此外,对晶状体内可溶性蛋白含量测定显示,羊毛甾醇组可溶性蛋白含量,高于对照组,并且羊毛甾醇组可溶性蛋白在第5天方出现明显降低,而对照组在第3天已出现明显降低,即可溶性蛋白含量降低羊毛甾醇组迟于对照组。这提示羊毛甾醇可抑制晶状体混浊的发展,并可以抑制放射性晶状体损伤中可溶性蛋白含量的减少。但同时,应注意到羊毛甾醇组可溶性蛋白含量仍低于0 Gy组,并且羊毛甾醇组在照射后第5天和第7天晶体混浊程度与对照组差异无统计学意义,提示羊毛甾醇并不能完全阻止晶状体混浊的发展。我们认为这可能与放射性白内障损伤的复杂性有关。晶状体透明性的维持,除了需细胞内晶状体蛋白保持可溶性以外,尚需要细胞的规则排列。既往研究发现射线除造成蛋白的氧化损伤以外,还会直接造成晶状体上皮细胞的DNA破坏,造成细胞分化异常及细胞死亡,从而破坏晶状体细胞的规则排列[8];此外放射可造成自由基产生,谷胱甘肽降低,使得氧化和抗氧化失衡,亦会加重细胞膜的损害[7,9]。这些复杂的因素共同促进了放射性白内障的形成。我们在实验中曾设置加入400 μmol羊毛甾醇的观察组,但因羊毛甾醇易溶于有机溶剂[18],水溶性极差,高浓度羊毛甾醇溶液形成混悬液,有明显较大颗粒物质。将其加入晶状体培养液后,培养液亦呈混浊外观,有大颗粒悬浮,影响晶体外观的观察。并且也并未发现其有明显的抑制混浊形成的作用。分析原因,考虑较高的药物浓度可能带来渗透压改变,并且在转运或移动培养板过程中,大颗粒物质与晶状体之间可能发生机械性摩擦,从而可能反而产生促进白内障的发生的作用。
进一步我们分析了X射线照射人LEC后72 h的可溶性晶状体蛋白含量。结果显示随照射剂量的增加,可溶性晶状体蛋白含量逐渐降低。而羊毛甾醇可抑制LEC中可溶性蛋白含量的减少。此外我们观察到照射细胞后96 h开始出现细胞死亡,联系在晶状体体外培养模型中照射3 d后晶状体混浊可见加速发展的现象,细胞死亡可能参与这一过程。
综上所述,羊毛甾醇可抑制X射线照射诱导的晶状体混浊的发生,其机制可能为通过降低晶状体可溶性蛋白的丢失实现。
