LncRNA SNHG5、miR-26b在NSCLC组织中的表达及意义
2020-11-12李倩杨在亮贺炜
李倩,杨在亮,贺炜
1重庆市第六人民医院,重庆 400060;2重庆市中医院
肺癌是全球人类癌症死亡的主要原因之一。据统计,2018年美国肺癌死亡人数约为15万余人[1]。肺癌主要分为两类,小细胞肺癌和非小细胞肺癌(NSCLC)。NSCLC又分为鳞癌、腺癌和大细胞癌。据报道,美国每年新发现23万病例中,有84%为NSCLC[2],其主要临床表现为咳嗽、痰中带血。长链非编码RNA(LncRNAs)是一个长度为200 bp的转录本,其编码蛋白质的能力较低,与多种癌症的生物学标志物活性相关,如LncRNA-TDRG1在宫颈癌中高表达,并且在细胞生长周期、细胞分化过程中发挥重要作用[3]。最近研究证实,LncRNAs参与多种肿瘤疾病的发生发展,如卵巢癌、胃癌[4]。核仁小RNA宿主基因5(SNHG5)被证实与多种肿瘤的发生发展有关,如胃癌[5]。Damas等[6]发现,在结直肠癌组织中SNHG5表达上调,并且与肿瘤的恶性进展和不良生存呈正相关。微小RNA(miRNA)是长度为20~22个核苷酸的非编码RNA,与多种肿瘤的发生发展有关,如食管癌[7]。通常情况下,miRNA可与靶基因的3′-UTR结合,从而促进癌细胞的增殖、迁移[8]。研究发现,miR-26b靶向作用于岩藻糖基转移酶FUT4,从而抑制癌细胞的侵袭和迁移[9]。目前,LncRNA SNHG5与miR-26b在NSCLC中的具体作用机制尚不清楚。2013年1月—2016年12月,我们检测了NSCLC组织中LncRNA SNHG5与miR-26b表达,探讨其意义。
1 资料与方法
1.1 临床资料 选取同期于重庆市第六人民医院住院治疗的NSCLC患者88例。纳入标准:①经活检病理或术后病理检查明确诊断为NSCLC;②均为首次诊断,既往未接受过抗肿瘤治疗;③临床病理资料完整,且均通过患者及家属的同意并签署知情同意书。排除标准:①合并其他呼吸系统疾病,如肺炎、肺气肿;②合并其他系统疾病或恶性肿瘤,如胃癌、乳腺癌;③合并免疫功能缺陷疾病。88例患者中男59例、女29例,年龄38~73(55.34±3.7)岁,≥55岁者40例、<55岁者48例,吸烟68例。癌组织病理检测结果:中低分化55例,高分化33例;TNM分期:Ⅰ期45例,Ⅱ期27例,Ⅲ期10例,Ⅳ期6例;有淋巴结转移34例;肿瘤直径≥3 cm 38例,<3 cm 50例。本研究通过重庆市第六人民医院伦理委员会批准。
1.2 NSCLC组织及癌旁组织中LncRNA SNHG5与miR-26b表达检测 应用TRIzol法提取新鲜(离体30 min以内)NSCLC及癌旁组织(距肿瘤边缘﹥5 cm)中总RNA(试剂盒购自美国Invitrogen公司),使用微量核酸蛋白检测仪测RNA浓度,将符合标准的RNA冻存,备用。使用TaqMan miRNA反转录试剂盒(美国Invitrogen公司)将RNA反转录合成cDNA,反应条件:37 ℃ 60 min、95 ℃ 5 min。反应体系:1 μL dNTP,1 μL逆转录酶,1.5 μL 10×RT缓冲液,0.2 μL RNase抑制剂,1 μL RNA,3 μL miRNA-155/U6 RT引物和8 μL H2O。qPCR反应条件:95 ℃ 5 min,95 ℃ 30 s,55 ℃ 1 min,72 ℃延伸10 s,共40个循环。反应体系:10 μL 2×SYBR Green,1 μL 20×TaqDNA聚合酶,1 μL miRNA-155/U6 RT产物和8 μL H2O。SNHG5 正向引物:5′-TACTGGCTGCGCACTTCG-3′,反向引物:5′-CAGTAAAAGGGGAACACCA-3′;内参基因U6正向引物:5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物:5′-GGCTGAGAACTGAATTCCA-3′。miR-26b 正向引物:5′-UCCUUCAUUCCACCGGAGUCUC-3′,反向引物:5′-GACUCCGGUGGAAUGAAGGAUU-3′;以GAPDH作为内参照,正向引物:5′-CGGATTTGGT-CGTATTGGG-3′,反向引物:5′-TGCTGGAAGATGGTGATGGGATT-3′。每个样本至少重复3次试验,最后采集荧光信号,结果以2-ΔΔCt计算和标准化LncRNA SNHG5与miR-26b的相对表达量。
1.3 随访 自患者出院起,每1~3个月随访1次,随访包括门诊和电话两种方式,随访时间3~60个月,随访至终止时间或患者死亡,随访时间截至2019年12月,收集患者生存数据。
2 结果
2.1 NSCLC组织与癌旁组织中LncRNA SNHG5、miR-26b表达比较 LncRNA SNHG5在NSCLC组织及癌旁组织中的相对表达量分别为1.63±0.62、1.95±0.52,NSCLC组织中LncRNA SNHG5的相对表达量低于癌旁组织(t=3.71,P<0.05)。miR-26b在NSCLC组织及癌旁组织中的相对表达量分别为0.76±0.14、1.60±0.45,NSCLC组织中miR-26b的相对表达量低于癌旁组织(t=16.72,P<0.05)。Spearman相关分析结果显示,LncRNA SNHG5与miR-26b表达呈正相关(r=0.328,P<0.05)。
2.2 NSCLC组织中LncRNA SNHG5、miR-26b表达与患者临床病理特征的关系 NSCLC组织中LncRNA SNHG5、miR-26b相对表达量与TNM分期、组织分化程度、淋巴结转移有关(P均<0.05),见表1。
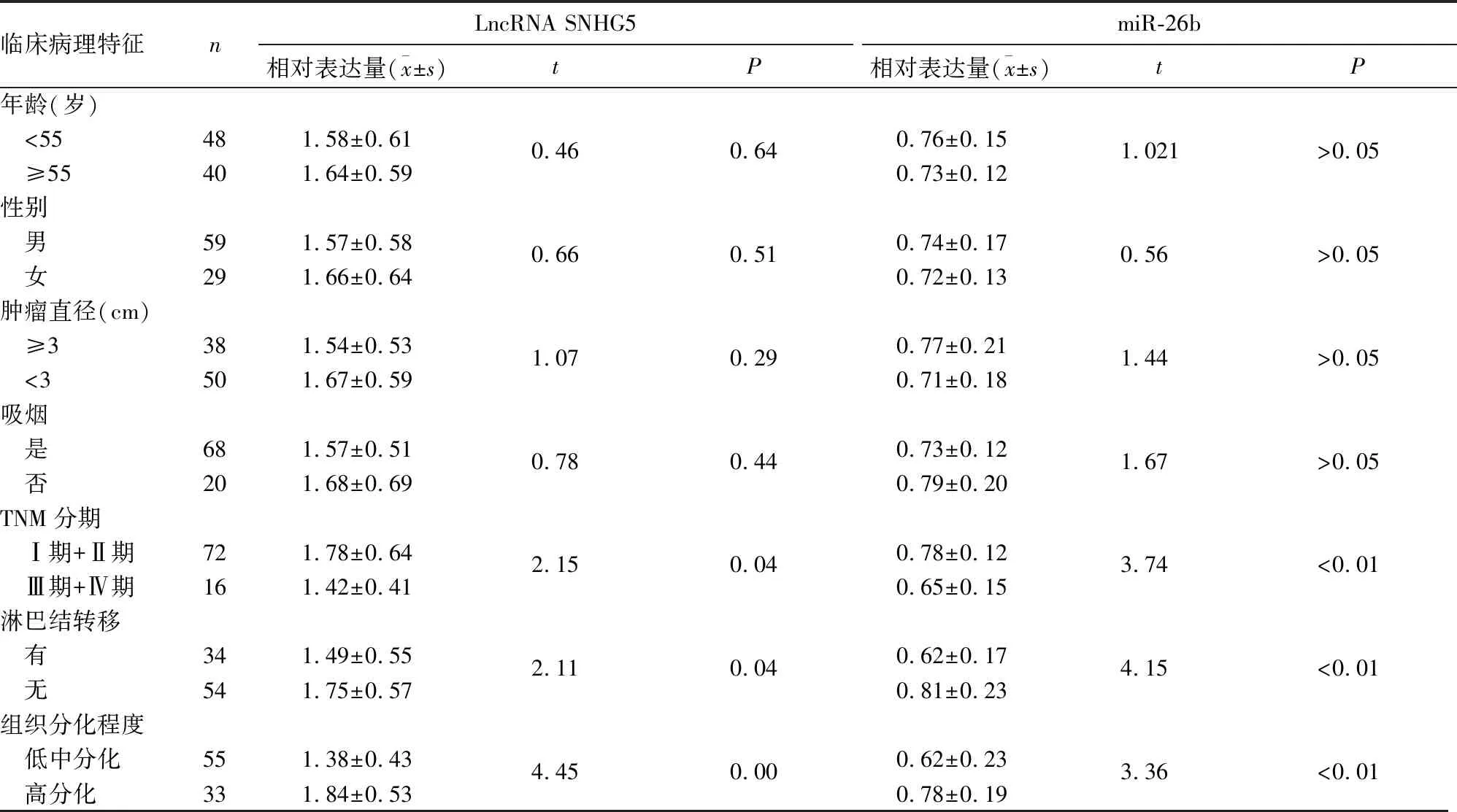
表1 NSCLC组织中LncRNA SNHG5、miR-26b表达与患者临床病理特征的关系
2.3 NSCLC组织中LncRNA SNHG5、miR-26b表达与患者预后的关系 88例NSCLC患者均获随访,无失访病例。随访3年内,共有39例患者死亡。NSCLC癌组织中LncRNA SNHG5相对表达量以中位数1.56为临界值,分为高表达组43例、低表达组45例,LncRNA SNHG5高表达组3年总体生存率(OS)65.1%(28/43),LncRNA SNHG5低表达组3年OS为46.7%(21/45)。Kaplan-Meier分析(Log-rank检验)结果显示,LncRNA SNHG5高表达组3年总体生存率高于LncRNA SNHG5低表达组(χ2=4.265,P=0.038)。
miR-26b相对表达量以中位数0.72为临界值,分为高表达组42例和低表达组46例。miR-26b高表达组3年OS为71.4%(30/42),miR-26b低表达组3年OS为41.3%(19/46)。Kaplan-Meier分析(Log-rank 检验)结果显示,miR-26b高表达组3年总体生存率低于miR-26b低表达组(χ2=3.862,P=0.049)。
3 讨论
NSCLC早期临床表现不明显,一旦出现呼吸困难、胸痛、咳血等临床症状时已为晚期,患者预后较差[2]。淋巴结转移是影响NSCLC预后的最重要因素之一。
LncRNA是一组非编码RNA。近年来,LncRNA已被证实是细胞代谢过程中的调节剂[3],如通过调节miRNA来促进mRNA 的转录及转录后翻译,进而影响蛋白质表达。LncRNA SNHG5是LncRNA家族中的一员,其在前列腺癌、肾细胞癌及乳腺癌中均表达下调[10],在乳腺癌的发生发展中通过调节NF-κB信号通路发挥抑癌或致癌作用。本研究结果显示,NSCLC组织中LncRNA SNHG5表达低于癌旁组织,且差异有统计学意义。其机制可能是当LncRNA SNHG5表达下调时,细胞凋亡率下降,促进癌细胞的增殖及分化,肿瘤的恶性程度增加[11]。本研究发现,LncRNA SNHG5表达与NSCLC患者TNM分期、组织分化程度及淋巴结转移有关。有文献报道,LncRNA SNHG5通过调节上皮间充质转化(EMT)来调节肿瘤的发生发展[11]。EMT是指上皮细胞恶变过程中逐渐失去上皮细胞的部分特征,如上皮属性蛋白E-cadherin表达下调,使得细胞之间的黏附力降低、而运动能力逐渐增强,增强恶性变细胞的转化过程。LncRNA SNHG5表达下调,对细胞EMT过程的抑制能力减弱,间接促进了肿瘤细胞的恶性进展。此外,LncRNA SNHG5还可通过抑制转移相关蛋白2来促进细胞质中蛋白合成,加速细胞的生长周期,进而促进癌细胞的增殖分化及转移过程[12]。LncRNA SNHG5还可靶向抑制miR-32/Kruppel样因子4轴的活性,激活其调节上调靶基因的功能,SNHG5的降低间接加快肿瘤细胞的生长,加速肿瘤的恶性进展[13]。
miRNA是非编码的单链RNA,占人类基因组序列的1%~3%,虽然数量较少,但却具有较多生物学功能,如促进细胞增殖、胚胎发育等[14]。miR-26家族是一个高度保守的小分子非编码RNA,主要表达于心肌细胞,且在肿瘤细胞增殖、分化及凋亡过程中发挥重要作用[14]。miR-26b是miR-26家族的成员之一,其染色体位置为2号染色体基因CTDSP1第4个内含子上,在肝癌、神经胶质瘤、胃癌中呈异常表达[15]。研究证实,乳腺癌组织中,miR-26b通过靶向调节下游靶基因(如CDK8、SLC7A11)来抑制癌细胞的生长及分化过程[15]。本研究结果显示,NSCLC组织中miR-26b表达低于癌旁组织,且差异有统计学意义。研究发现,miR-26b具有抑癌基因的作用,其通过抑制NF-κB信号通路进而抑制肿瘤细胞增殖[16]。当NSCLC中miR-26b表达降低时,其抑制癌细胞生长的作用减弱,间接地对肺癌细胞的增殖及分化过程起到促进作用,增加癌细胞的恶性程度。本研究结果显示,miR-26b表达与NSCLC患者TNM分期、组织分化程度及淋巴结转移有关。研究发现,miR-26b可通过抑制细胞的增殖、诱导细胞凋亡及停滞细胞的生长周期来实现抑制癌组织的生长分化过程[16]。另外,miR-26b可靶向调节蛋白酶氨酸磷酸酶IVA1来抑制肺癌细胞的增殖及迁移过程,因此,当肺癌组织中miR-26b表达下调时,其抑制癌细胞增殖、诱导癌细胞凋亡及迁移的作用减弱,对癌细胞的增殖及侵袭过程起到一定程度促进作用,miR-26b表达越低,癌组织的恶性程度越高。miR-26b可通过激活Wnt/β-catenin信号通路,进而刺激下游靶基因ZNRD1的表达,对肿瘤细胞的生长起到积极促进作用,加速肿瘤细胞的增殖及分化过程,进一步增加肿瘤的恶性程度[17]。
本研究中LncRNA SNHG5和miR-26b的高表达组3年生存率均高于低表达组,说明LncRNA SNHG5和miR-26b低表达很可能与NSCLC患者的不良预后相关,并有可能成为NSCLC预后不良的肿瘤标志物。LncRNA SNHG5与miR-26b表达呈正相关,两者在肿瘤发生发展过程中发挥协同作用,共同促进肿瘤细胞的增殖、分化过程,但二者在NSCLC中的具体作用机制还需进一步研究。
综上所述,NSCLC组织中LncRNA SNHG5和miR-26b表达均降低,与肿瘤组织分化程度、TNM分期、淋巴结转移及患者预后相关;检测二者表达有助于NSCLC病情判断及预后评估。
