养殖密度对墨吉明对虾肠道和生物絮团菌群的影响
2020-11-11王博秦海鹏廖栩峥胡世康赵吉臣何子豪韩学明陈兆明孙成波
王博,秦海鹏,廖栩峥,胡世康,赵吉臣,何子豪,韩学明,陈兆明,孙成波
养殖密度对墨吉明对虾肠道和生物絮团菌群的影响
王博,秦海鹏,廖栩峥,胡世康,赵吉臣,何子豪,韩学明,陈兆明,孙成波*
(广东海洋大学水产学院,广东 湛江 524088)
运用Miseq高通量测序技术,分析高、中、低3种养殖密度(700、300、100尾/m3)下墨吉明对虾肠道和其养殖系统中生物絮团的菌群结构。结果显示:对虾肠道菌群中,高密度组的丰富度和多样性均最高,丰富度随放养密度的增大而增加,而在生物絮团菌群中,高密度组的丰富度最低;在门水平上,肠道和絮团样本菌群均以变形菌门(相对丰度49.25%~80.33%)、放线菌门、拟杆菌门、绿弯菌门为主,但丰度差异较大;在属水平上,优势菌属的组成和所占比例明显不同,梭菌属、、、、仅在肠道样本中存在,仅在絮团样本中存在;肠道样本中,中密度组弧菌属的相对丰度最小,为5.23%,高密度组弧菌属的相对丰度最大,为23.39%,絮团样本中,低密度组弧菌属的相对丰度最大,为16.15%,中、高密度弧菌属的相对丰度均较小,分别为5.51%和4.20%;随养殖密度增大,肠道样本中拟杆菌属的相对丰度减小,分别为1.36%、0.41%、0.02%,而不同密度絮团样本拟杆菌属的相对丰度差异不明显。可见,生物絮团养殖模式下,养殖密度对墨吉明对虾的肠道和絮团菌群的影响较大。
墨吉明对虾;密度胁迫;生物絮团;肠道;菌群结构
墨吉明对虾()俗称为大明虾、黄虾,为广盐性、暖水性种类,在南方沿海地区的捕捞和养殖业中具有十分重要的经济地位。
生物絮团包括藻类、真菌、原生动物、轮虫和线虫的聚集体,在生物絮团培养系统中,化学自养和异养细菌参与生物絮团的形成[1-3]。此外,微生物絮凝物也被用作动物的食物,诱导虾生长性能的提高[4-5]。除了控制水质和作为养殖生物的补充食物来源外,在生物絮凝系统中建立的细菌群落可通过竞争食物和空间来抑制病原体的增殖[6]。然而,微生物群落也可能由致病菌和机会性细菌组成[7],而水生环境可影响微生物群的组成和丰度[8]。对于生物絮团培养系统来说,了解絮凝过程中涉及的微生物机制,对控制病原微生物非常重要。
由于拥挤引起的应激反应,高放养密度会影响虾的生长和存活[9],导致成活率低、产量低、水质差和病原体暴发等[10-13]。放养密度的增加,意味着饲用的饲料增加[14],随之而来的是培养水中颗粒有机物质的增加,这将影响微生物的形成和聚集。对于采用生物絮团培养系统的生产系统,更有必要确定合适的养殖密度和系统的负载能力。
本研究中,以墨吉明对虾为试验对象,研究不同养殖密度对生物絮团养殖系统中墨吉明对虾的肠道和絮团菌群结构的影响,现将结果报告如下。
1 材料与方法
1.1 材料
供试对虾为广东海洋大学东海岛海洋生物研究基地自行繁育的墨吉明对虾。选取附肢完整、健康无损伤的活泼个体进行试验。对虾平均体长(5.85±0.35) cm,体质量(2.46±0.39) g。
1.2 养殖试验
试验前,将选好的墨吉明对虾置于预先充氧的桶内暂养7 d。生物絮团为笔者自行构建的以当地水体中菌群为主的硝化型生物絮团。试验前,将絮团水体用孔径48 μm的滤网滤水浓缩,然后按试验要求添加到试验桶中。供试海水从海区抽取,通过沉淀、砂滤、消毒处理后使用,保持水温(29.4±0.71) ℃,溶解氧质量浓度大于5 mg/L,盐度28.5±0.26,水体持续均匀充气。试验在容积0.3 m3的养殖桶进行,每桶设置气石2个。
试验设低(A)、中(B)、高(C)3个养殖密度梯度,分别为100、300、700尾/m2。每个密度梯度重复3次。每个养殖桶中的实际水体为270 L,生物絮团的添加量为20 mg/L。投喂人工配合饲料,每天定时投喂4次。试验期间不添加有机碳源、不换水。试验周期30 d。
1.3 样品采集
第30天喂食后,分别于每个养殖桶随机选择5只虾,用无菌水和75%乙醇洗涤虾的体表,解剖后将虾肠分离,置于1.5 mL离心管中,于-80 ℃冰箱保存,备用。用0.45 μm膜滤器收集生物絮团样品,于-80 ℃冰箱保存,备用。低、中、高密度的对虾肠道样本分别编号为SIA、SIB和SIC,生物絮团样本分别编号为FA、FB和FC。
1.4 DNA提取
采用E.Z.N.A. ®土壤试剂盒(OMEGA,US),按说明书提取虾肠腔内容物和絮团的总细菌DNA。用NanoDrop分光光度计(Thermo Fisher Scientific)测量DNA产量。通过扩增细菌16S rDNA基因,评估DNA质量(GeneAmp PCR System 9700)。
1.5 PCR扩增和高通量测序
采用引物组341F(CCTAYGGGRBGCASCAG)和806R(GGACTACNNGGGTATCTAAT),PCR扩增16S rDNA的V3-V4区域[15]。反向引物含有每个样品独有的6 bp错误校正条形码。由Novaseq(广州)在Illumina Miseq平台上进行高通量测序。
1.6 生物信息分析
对获得的原始数据进行分析和质量过滤,剩余的高质量数据用于后续分析。使用UCLUST (v1.2.22q)将相似性大于97%的序列聚类为同一个操作分类单位(OTUs)[16]。运用Mothur确定每个文库的分类丰富度估计值和群落多样性(v.1.37.6,http://www.mothur.org/)[17]。基于OTU丰度矩阵估计每个群落的物种丰富度。利用α多样性指数(Chao1、ACE、Shannon和Simpson)评估社区多样性。基于OTU标准化数据,运用QIIME(v1.9.1)进行α和β细菌多样性的后续分析。运用R script (http://www.r- project.org/)和ggplot2(ggplot2.org)进行维恩图和相对丰度分析。利用线性判别分析(LDA)效应大小确定样本组之间差异相对较大的微生物类群。
1.7 数据处理
运用Excel 2010整理数据;运用SPSS 17.0对数据作单因素方差分析(ANOVA)。
2 结果与分析
2.1 供试样品的物种分类
从表1可知,3个养殖密度的18个样品共产生686 521条序列。肠道样品中,SIC中OTUs最多。絮团样本中,FB中OTUs最多。

表1 墨吉明对虾的肠道及其养殖系统中的生物絮团样本的可操作分类单元数
维恩图分析结果表明:3个密度组对虾肠道样品共有的OTUs有333个(占1.8%),SIA独有的OTUs有4 909个(占27.0%),SIB独有的OTUs有4 605个(占25.3%),SIC独有的OTUs有6 555个(占36.1%);3个密度组生物絮团样品共有的OTUs有1 536个(占11.5%),FA独有的OTU有4 841个(占36.3%),FB独有的OTUs有2 553个(占19.1%),FC独有的OTUs有2 496个(占18.7%)。
2.2 供试样品的细菌丰富度和多样性指数
从表2可知,随养殖密度的增大,墨吉明对虾肠道菌群的丰富度Chao 1和Ace指数与多样性Shannon指数均逐渐增加,而多样性Simpson指数呈先减后增的趋势,SIC的4个指数均为最高;生物絮团菌群中,FC的丰富度Chao 1和Ace指数均最小,FB的多样性Shannon和Simpson指数最大。

表2 墨吉明对虾的肠道及其养殖系统中生物絮团的菌群丰富度和多样性指数
2.3 供试样品的微生物菌群结构组成
墨吉明对虾肠道和絮团样品之间的菌群结构相似,组成比例上存在一定的差异,共检测出43个细菌门。从表3可知,菌群主要由13个细菌门组成,其中,变形菌门的相对丰度最高,为49.25%~80.33%,放线菌门和拟杆菌门的相对丰度较高;随养殖密度增大,肠道样本变形菌门的相对丰度增加,而絮团样本中变形菌门的相对丰度减小;随养殖密度增大,肠道样本放线菌门的相对丰度先减后增,絮团样本放线菌门的相对丰度减小,肠道和絮团样本中均是低密度组的相对丰度最大;肠道样本中绿弯菌门、酸杆菌门和拟杆菌门的相对丰度均是低密度组的最大,而絮团样本中这3个门的相对丰度均是高密度组的最大;肠道和絮团样本硝化螺旋菌门的相对丰度都随养殖密度增大而增加。
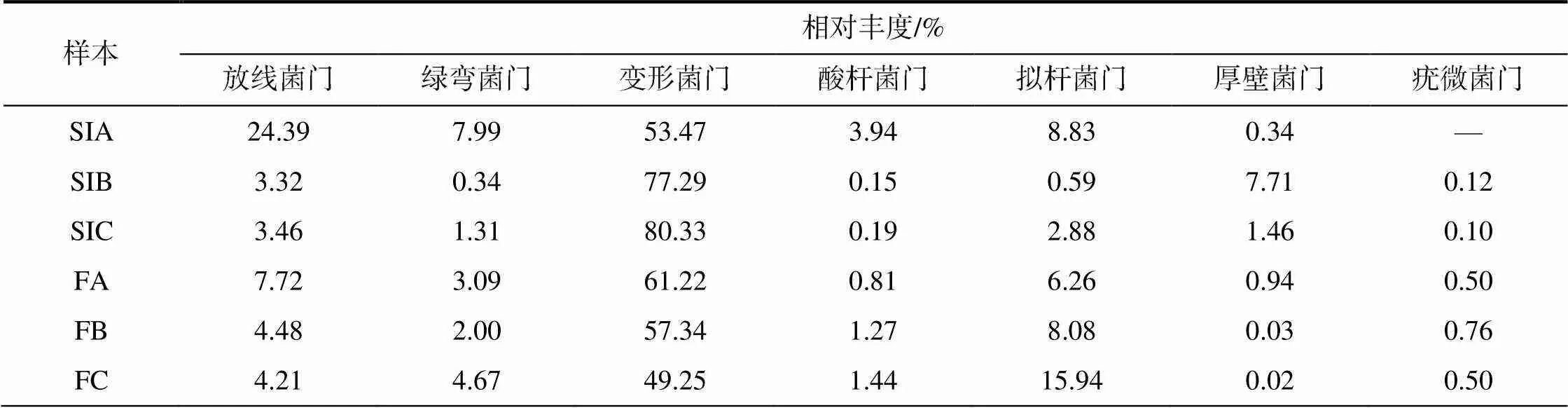
表3 墨吉明对虾的肠道及其养殖系统中生物絮团的优势细菌门及其相对丰度

样本相对丰度/% 衣原体芽单胞菌门硝化螺旋菌门泉古菌门螺旋体蓝藻门浮霉菌门 SIA——0.25——0.4— SIB——0.870.01—3.120.16 SIC—0.351.203.020.030.530.05 FA0.010.571.613.080.041.650.24 FB0.051.002.283.890.082.540.47 FC0.011.122.777.230.281.240.44
属水平上,墨吉明对虾肠道和絮团样本中共检测出193个细菌属。从表4可知,菌群主要由CandidatusAquiluna、拟杆菌属()、大肠埃希菌属()、梭菌属()、链球菌属()、、弧菌属()、、发光菌属()、、、、等细菌属组成,除SIB外,其他样本中均是弧菌属的相对丰度最高;肠道和絮团样本中,优势菌属的组成和所占比例明显不同,梭菌属、、、、只在肠道样本中存在,只在絮团样本中存在;随养殖密度增大,肠道样本拟杆菌属的相对丰度减小,絮团样本拟杆菌属的相对丰度差异不明显;肠道样本中,中密度组的弧菌属的相对丰度最小,高密度组的最大,而絮团样本弧菌属的相对丰度以低密度组的较大,中、高密度组的较小,且两者差异不明显;肠道和絮团样本发光杆菌属的相对丰度的变化趋势相反,肠道样本中、高密度组的发光杆菌属的相对丰度较高,而絮团样本中、高密度组的较低。

表4 墨吉明对虾的肠道及其养殖系统中生物絮团的优势细菌属及其相对丰度

样本相对丰度/% Faecalibacterium发光菌属CoccinimonasRhodovulumBlautiaRuegeria SIA0.01 1.34—2.87—0.27 SIB3.7235.95——0.014.85 SIC0.0210.65——0.981.60 FA— 2.170.02——3.23 FB— 0.690.02——3.56 FC— 0.440.49——2.26
如表5所示,肠道样本中,SIA、SIB、SIC的Lefse的LDA评分显示均为1,与SIA相比,SIB、SIC中各有1个分类群显著增加和1个分类群显著减少(<0.05);絮团样本中,FA、FB、FC的Lefse的LDA评分显示分别为1、5、5,与FA相比,FB、FC中各有5个分类群显著增加和1个分类群显著减少(<0.05)。如图1所示,Lefse的分支图分别聚集在SIA、SIB、SIC、FA、FB、FC组中的分类群为2、2、4、7、13、17个。

表5 墨吉明对虾的肠道及其养殖系统中生物絮团样本的微生物群落相对丰度的群间变异(LDA值)
表中仅展示了LDA值大于4的物种。

图1 墨吉明对虾的肠道及其养殖系统中生物絮团样本微生物群落相对丰度的群间变异(Cladogram)
3 结论与讨论
在生物絮团养殖系统中,以细菌为主的微生物群落具有特殊作用。本研究中,通过高通量测序,从不同养殖密度组的对虾肠道和其养殖系统中的生物絮团样本中共检测出43个细菌门193个细菌属。对虾肠道菌群结构与养殖环境微生物菌群结构密切相关,环境因素决定了微生物群落的结构和功能[18]。研究表明,微生物群落的演替受碳氮比[19]、化学需氧量[20]、盐度胁迫[21-22]的影响。本研究中,墨吉明对虾肠道菌群中,高密度组的丰富度和多样性均最高,且丰富度随放养密度的增大而增加;生物絮团菌群中,以高密度组的丰富度最低。这可能是由于放养密度的增加,饲喂量随之增加,水体中的代谢产物增多,从而导致了生物絮团培养系统的水体中与微生物形成和聚集有关的颗粒状有机物的增加。此外,生物絮团可作为对虾额外的食物来源[4-5],是一种益生菌,对水质和水生动物的健康有益[23-24],进而影响到对虾肠道菌群的丰度。
肠道微生物菌群结构和功能对虾宿主的生理、免疫、代谢和健康起重要作用[25-28],肠道细菌群落的细微变化还会对宿主表型产生影响[29-30]。不同的环境因素,如养殖种类、水质、饮食和种群密度的差异都会影响肠道菌群的多样性[31-34]。裴鹏兵等[35]研究发现,凡纳滨对虾肠道菌群结构及多样性与添加和不添加生物进水栅有着密切关系。本研究中,对虾肠道和絮团样本的细菌群落结构在不同处理之间存在差异,但变形菌门的相对丰度均为最高。从南美白对虾和其他水生动物中也发现了变形菌[36-38]。变形菌和拟杆菌对有机物降解至关重要,它们通常是活性污泥系统和生物絮团养殖系统中的优势细菌门[39-40]。本研究中,絮团样本变形菌门和拟杆菌门的占比也较高。硝化螺旋菌[41]和泉古菌[42]对水体中氨氮的转化起到非常重要的作用。本研究中,对虾肠道和絮团样本中的硝化螺旋菌门和泉古菌门在不同密度组呈现出相同的变化趋势,可能是絮团菌群间接影响对虾肠道菌群所致;对虾肠道和絮团样本中变形菌门、酸杆菌门和拟杆菌门在不同密度组呈现出相反的变化趋势。可见,不能单纯的以环境中菌群相对丰度的高低去判定对虾肠道菌群的相对丰度,对于这种变化还需要进一步深入研究。有研究[43-44]表明,弧菌属是对虾肠道内的优势菌属,不同的养殖模式、对虾品种和养殖环境下均有弧菌属存在。本研究中,弧菌属为对虾肠道和絮团内的优势菌属,中密度组样本中弧菌属的相对丰度较小,表明适当增加养殖密度可以减小对虾肠道中弧菌的相对丰度。发光杆菌属在海水养殖中广泛存在,参与有机物的降解[45-46],且其代谢产物有一定的抗菌活性[47],可能参与养殖生物的有机物消化和病原防御过程。本研究中,肠道样本与絮团样本的发光杆菌属相对丰度的变化趋势相反。低密度组肠道发光杆菌属的相对丰度可能与絮团样本中发光杆菌属的广泛存在有关,而中、高密度组对虾肠道高丰度的发光杆菌可能是机体适应性抵抗环境压力的表现。
[1] DE SCHRYVER P,CRAB R,DEFOIRDT T,et al.The basics of bio-flocs technology:the added value for aquaculture[J].Aquaculture,2008,277(3/4):125-137.
[2] AVNIMELECH Y.Carbon/nitrogen ratio as a control element in aquaculture systems[J].Aquaculture,1999,176(3/4):227-235.
[3] EMERENCIANO M G C,MARTÍNEZ-CÓRDOVA L R, MARTÍNEZ-PORCHAS M,et al.Biofloc technology (BFT):a tool for water quality management in aquaculture [M]//HLANGANANI T.Water Quality.London:InTech,2017:91-109.
[4] BURFORD M A,THOMPSON P J,MCINTOSH R P,et al.The contribution of flocculated material to shrimp () nutrition in a high-intensity,zero- exchange system[J].Aquaculture,2004,232 (1/2/3/4):525-537.
[5] KIM M S,MIN E,KIM J H,et al.Growth performance and immunological and antioxidant status of Chinese shrimp,reared in bio-floc culture system using probiotics[J].Fish & Shellfish Immunology,2015,47(1):141-146.
[6] CRAB R,LAMBERT A,DEFOIRDT T,et al.The application of bioflocs technology to protect brine shrimp() from pathogenic[J].Journal of Applied Microbiology,2010,109(5):1643-1649.
[7] SCHULZE A D,ALABI A O,TATTERSALL SHELDRAKE A R,et al.Bacterial diversity in a marine hatchery:balance between pathogenic and potentially probiotic bacterial strains[J].Aquaculture,2006,256(1/2/3/4):50-73.
[8] WONG S,RAWLS J F.Intestinal microbiota compositionin fishes is influenced by host ecology and environment[J]. Molecular Ecology,2012,21(13):3100-3102.
[9] MENA-HERRERA A,GUTIERREZ-CORONA C,LINAN-CABELLO M,et al.Effects of stocking densities on growth of the Pacific white shrimp() in earthen ponds[J].Israeli Journal of Aquaculture-Bamidgeh,2006,58(3):205-213.
[10] LIN Y C,CHEN J C,CHEN Y Y,et al.Crowding of white shrimpdepresses their immunity to and resistance againstand white spot syndrome virus[J].Fish & Shellfish Immunology,2015,45(1):104-111.
[11] 李玉全,王仁杰,姜令绪.密度胁迫对日本囊对虾生长和水环境的影响[J].海洋科学,2013,37(10):53-57. LI Y Q,WANG R J,JIANG L X.Effects of density-stress on water quality and growth of[J]. Marine Sciences,2013,37(10):53-57.
[12] SHAKIR C,LIPTON A P,MANILAL A,et al. Effect of stocking density on the survival rate and growth performance in[J].Journal of Basic & Applied Sciences,2014,10:231-238.
[13] LI Y Q,LI J,WANG Q Y.The effects of dissolved oxygen concentration and stocking density on growth and non-specific immunity factors in Chinese shrimp,[J].Aquaculture,2006,256(12/3/4):608-616.
[14] KRUMMENAUER D,PEIXOTO S,CAVALLI R O,et al.Superintensive culture of white shrimp,,in a biofloc technology system in southern Brazil at different stocking densities[J].Journal of the World Aquaculture Society,2011,42(5):726-733.
[15] QIN J J,LI R Q,RAES J,et al.A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature,2010,464:59-65.
[16] EDGAR R C,HAAS B J,CLEMENTE J C,et al. UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[17] SCHLOSS P D,WESTCOTT S L,RYABIN T,et al. Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J].Applied and Environmental Microbiology,2009,75(23):7537-7541.
[18] ALLISON S D,MARTINY J B H.Resistance,resilience,and redundancy in microbial communities[J]. Proceedings of the National Academy of Sciences (PNAS),2008,105(Supplement 1):11512-11519.
[19] PANIGRAHI A,SARANYA C,SUNDARAM M,et al.Carbon:Nitrogen(C:N) ratio level variation influences microbial community of the system and growth as well as immunity of shrimp() in biofloc based culture system[J].Fish & Shellfish Immunology,2018,81:329-337.
[20] ZHANG D M,WANG X,XIONG J B,et al. Bacterioplankton assemblages as biological indicators of shrimp health status[J].Ecological Indicators,2014,38:218-224.
[21] YANG J,MA L A,JIANG H C,et al.Salinity shapes microbial diversity and community structure in surface sediments of the Qinghai-Tibetan Lakes[J].Scientific Reports,2016,6:25078.
[22] KIRCHMAN D L,COTTREL M T,DITULLIO G R. Shaping of bacterial community composition and diversity by phytoplankton and salinity in the Delaware Estuary,USA[J].Aquatic Microbial Ecology,2017,78(2):93-106.
[23] MORIARTY D J W.The role of microorganisms in aquaculture ponds[J].Aquaculture,1997,151(1/2/3/4):333-349.
[24] MCINTOSH R P.Changing paradigms in shrimp farming:III.pond design and operation considerations[J]. Global Aquaculture Alliance,2000(2):42-45.
[25] MARTIN F P J,WANG Y L,SPRENGER N,et al. Top-down systems biology integration of conditional prebiotic modulated transgenomic interactions in a humanized microbiome mouse model[J].Molecular Systems Biology,2008,4:205.
[26] YAP I K S,LI J V,SARIC J,et al.Metabonomic and microbiological analysis of the dynamic effect of vancomycin-induced gut microbiota modification in the mouse[J].Journal of Proteome Research,2008,7(9):3718-3728.
[27] RAMAKRISHNA B S.Role of the gut microbiota in human nutrition and metabolism[J].Journal of Gastro- enterology and Hepatology,2013,28:9-17.
[28] XIONG J B,DAI W F,ZHU J Y,et al.The underlying ecological processes of gut microbiota among cohabitating retarded,overgrown and normal shrimp[J]. Microbial Ecology,2017,73(4):988-999.
[29] HOLMES E,NICHOLSON J.Variation in gut microbiota strongly influences individual rodent phenotypes[J]. Toxicological Sciences,2005,87(1):1-2.
[30] ROHDE C M,WELLS D F,ROBOSKY L C,et al. Metabonomic evaluation of Schaedler altered microflora rats[J].Chemical Research in Toxicology,2007,20(10):1388-1392.
[31] WU S G,WANG G T,ANGERT E R,et al. Composition,diversity,and origin of the bacterial community in grass carp intestine[J].PLoS One,2012,7(2):e30440.
[32] KIM D H,KIM D Y.Microbial diversity in the intestine of olive flounder()[J]. Aquaculture,2013,414/415:103-108.
[33] RAMÍREZ C,ROMERO J.Fine flounder() microbiome showed important differences between wild and reared specimens[J].Frontiers in Microbiology,2017,8:271.
[34] 王元,周俊芳,韦信贤,等.海水和淡水养殖凡纳滨对虾肠道和鳃的菌群结构分析[J].湖南农业大学学报(自然科学版),2018,44(2):198-203. WANG Y,ZHOU J F,WEI X X,et al.Microbial community structure analysis of intestine and gill ofin seawater and freshwater[J]. Journal of Hunan Agricultural University(Natural Sciences),2018,44(2):198-203.
[35] 裴鹏兵,吴洁琼,梁宏豪,等.生物净水栅对凡纳滨对虾肠道菌群组成的影响[J].水产科学,2018,37(3):301-308. PEI P B,WU J Q,LIANG H H,et al.Effects of biological water purification grid on intestinal flora composition of Pacific white leg shrimp[J].Fisheries Science,2018,37(3):301-308.
[36] RUNGRASSAMEE W,KLANCHUI A,MAIBUN- KAEW S,et al.Characterization of intestinal bacteria in wild and domesticated adult black tiger shrimp()[J].PLoS One,2014,9(3):e91853.
[37] SUO Y T,LI E C,LI T Y,et al.Response of gut health and microbiota to sulfide exposure in pacific white shrimp[J].Fish & Shellfish Immunology,2017,63:87-96.
[38] ZENG S Z,HUANG Z J,HOU D W,et al.Composition,diversity and function of intestinal microbiota in Pacific white shrimp() at different culture stages[J].PeerJ,2017,5:e3986.
[39] HU M,WANG X H,WEN X H,et al.Microbial community structures in different wastewater treatment plants as revealed by 454-pyrosequencing analysis[J]. Bioresource Technology,2012,117:72-79.
[40] ZHAO P,HUANG J,WANG X H,et al.The application of bioflocs technology in high-intensive,zero exchange farming systems of[J]. Aqua- culture,2012,354/355:97-106.
[41] SLIEKERS A O,DERWORT N,GOMEZ J L C,et al. Completely autotrophic nitrogen removal over nitrite in one single reactor[J].Water Research,2002,36(10):2475-2482.
[42] CHOUARI R,GUERMAZI S,SGHIR A.Co-occurence of Crenarchaeota,Thermoplasmata and methanogens in anaerobic sludge digesters[J].World Journal of Microbiology & Biotechnology,2015,31(5):805-812.
[43] 李玉宏,柴鹏程,胡修贵,等.应用RFLP和DGGE技术分析工厂化养殖凡纳滨对虾肠道微生物群落特征[J].渔业科学进展,2014,35(2):83-89. LI Y H,CHAI P C,HU X G,et al.Analysis of intestinal microecology ofin industrial aquaculture by RFLP and DGGE techniques[J].Progress in Fishery Sciences,2014,35(2):83-89.
[44] WANG X H,LI H R,ZHANG X H,et al.Microbial flora in the digestive tract of adult penaeid shrimp()[J].Journal of Ocean University of Qingdao,2000,30(3):493-498.
[45] 薛超波,王国良,金珊.滩涂贝类养殖环境中细菌生态分布的初步研究[J].中国卫生检验杂志,2005,15(10):1191-1193. XUE C B,WANG G L,JIN S.The preliminary study on the bacteria ecological distribution in the culture environment of marine interdial shellfish[J].Chinese Journal of Health Laboratory Technology,2005,15(10):1191-1193.
[46] 莫照兰,王祥红,于勇,等.虾池有机污染物降解细菌的筛选[J].水产学报,2000,24(4):334-338. MO Z L,WANG X H,YU Y,et al.Selection of organic-pollutants-degrading bacteria in shrimp ponds[J]. Journal of Fisheries of China,2000,24(4):334-338.
[47] 郑立,林伟,严小军,等.海洋细菌抗菌和细胞毒活性的初步研究[J].应用生态学报,2004,15(9):1633-1636. ZHENG L,LIN W,YAN X J,et al.A primary study on antimicrobial and cytotoxic activity of marine bacteria[J]. Chinese Journal of Applied Ecology,2004,15(9):1633-1636.
Effects of stocking density on bacterial community characterization of biofloc and intestine of
WANG Bo, QIN Haipeng, LIAO Xuzheng, HU Shikang, ZHAO Jichen, HE Zihao, HAN Xueming, CHEN Zhaoming, SUN Chengbo*
(Department of Fisheries, Guangdong Ocean University, Zhanjiang, Guangdong 524088, China)
Using the high-throughput sequencing technology of Miseq, the microbial structure of the intestine and water biofloc ofat high, medium and low aquaculture densities(700/m3, 300/m3, 100/m3) were analyzed. The results showed that among the shrimp intestinal flora, the high-density group had the highest abundance and diversity, and the abundance increased over the increase of stocking density, while among the biofloc flora, the high-density group had the lowest abundance. The intestinal and biofloc flora samples were mainly composed of Proteobacteria(relative abundant 49.25%~80.33%), Actinobacteria, Bacteroides and Chloroflexi at phylum level, but the abundance was different. At genus level, the composition and proportion of dominant bacteria were significantly different.,,,, andonly exist in intestinal samples, andonly exist in biofloc samples. The relative abundance ofwas relatively large,abundance of intestinal sample was the smallest(5.23%) in medium density group and the largest(23.39%) in high density group; the low-density group of biofloc samples was the largest(16.15%), and the medium and high-density samples were both smaller, the abundance was 5.51% and 4.20%, respectively. The abundance ofin the intestinal samples decreased with the increase of stocking density, and the abundance was 1.36%, 0.41%, 0.02%, respectively. The abundance difference ofin different culture density biofloc samples was not significant. It can be seen that under the bioflocculation mode, the density of culture had a greater influence on bacterial community characterization of biofloc and intestine of.
; stocking density; biofloc; intestine; bacterial community
S968.22;S917.1
A
1007-1032(2020)05-0608-08
王博,秦海鹏,廖栩峥,胡世康,赵吉臣,何子豪,韩学明,陈兆明,孙成波.养殖密度对墨吉明对虾肠道和生物絮团菌群的影响[J].湖南农业大学学报(自然科学版),2020,46(5):608-615.
WANG B, QIN H P, LIAO X Z, HU S K, ZHAO J C, HE Z H, HAN X M, CHEN Z M, SUN C B. Effects of stocking density on bacterial community characterization of biofloc and intestine of[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(5): 608-615.
http://xb.hunau.edu.cn

2019-10-17
2019-12-18
2019年度“冲一流”广东省财政专项资金项目(231419025);防城港市科技计划项目(防科AD19008017)
王博(1993—),男,甘肃渭源人,硕士研究生,主要从事甲壳类动物遗传育种与增养殖研究,845358136@qq.com;*通信作者,孙成波,教授,主要从事甲壳类动物遗传育种与增养殖研究,scb248@126.com
责任编辑:邹慧玲
英文编辑:柳正
