茶树CCoAOMT原核表达及酶促条件优化
2020-11-11唐倩陈丝欧淑琼李勤李娟王坤波
唐倩,陈丝,欧淑琼,李勤,李娟*,王坤波*
茶树原核表达及酶促条件优化
唐倩1,2,4,陈丝1,2,4,欧淑琼1,2,4,李勤1,2,3,4,李娟1,2,3,4*,王坤波1,2,3,4*
(1.国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;2.茶学教育部重点实验室,湖南 长沙 410128;3.植物功能成分利用省部共建协同创新中心,湖南 长沙 410128;4.湖南农业大学园艺学院,湖南 长沙 410128)
优化了重组茶树咖啡酰辅酶A--甲基转移酶基因()在大肠杆菌中的表达,采用Ni-NTA亲和层析柱对重组蛋白进行纯化。以表没食子儿茶素没食子酸酯(EGCG)为底物,进行体外酶促反应,采用HPLC测定反应产物EGCG3"Me的生成量。结果表明,在BL21中能够高效表达,最优条件为诱导温度37 ℃,诱导时间4 h,异丙基-β-D-硫代半乳糖苷(IPTG)浓度0.5 mmol/L;重组蛋白经Ni-NTA亲和层析柱梯度洗脱达到了较好的纯化效果;重组酶在体外能够催化EGCG,合成EGCG3"Me,底物EGCG最佳浓度为0.05 mmol/L,最适温度为37 ℃,最适pH值为4。
茶树;咖啡酰辅酶A--甲基转移酶;原核表达;纯化;酶促合成
咖啡酰辅酶A--甲基转移酶(CCoAOMT)是一类S-腺苷-L-甲硫氨酸( SAM )甲基转移酶,它能催化类黄酮、生物碱等化合物,生成甲基化酚类代谢物[1-2]。茶叶中甲基化表没食子儿茶素没食子酸酯(EGCG),主要是(-)-表没食子儿茶素3-(3--甲基)没食子酸酯(EGCG3"Me),只有少数茶树种质资源的EGCG3"Me含量在1%以上[3-5]。SAIJO[6]首次从绿茶中分离出EGCG3"Me;后续的研究表明其抗过敏、抗炎效果强于EGCG[7-11]。与化学合成方法相比,运用酶工程技术合成EGCG3"Me,反应条件相对温和、安全,过程简单,后期产物的纯化也较为简易。ZHANG等[12]通过克隆茶树咖啡酰辅酶A--甲基转移酶基因(),在大肠杆菌中进行诱导表达,获得了相对分子质量约28 000的重组蛋白;进一步研究蛋白的催化活性,重组茶树CCoAOMT能够催化EGCG生成甲基化EGCG,且EGCG3"Me生成量相对较高。
笔者以报道的茶树CCoAOMT基因序列为根据,构建了重组融合表达载体pET-28a-,优化其原核表达条件,并利用Ni-NTA亲和层析柱进行分离纯化,获得具有催化活性的重组蛋白,优化重组酶CCoAOMT体外催化EGCG合成EGCG3"Me的反应条件,以期为生物合成EGCG3"Me提供依据。
1 材料与方法
1.1 材料
‘金牡丹’茶树一芽二叶(夏季),采自湖南省茶叶研究所;大肠杆菌BL21(DE3)为北京全式金生物技术有限公司产品;EGCG和EGCG3"Me标准品为Sigma产品;SAM为上海生物工程有限公司产品。
1.2 方法
1.2.1重组表达载体的构建
提取茶树鲜叶总RNA,按照TaKaRa反转录试剂盒说明书进行反转录,获得茶树cDNA。根据NCBI提供的序列号JQ 790528.1设计引物,上游引物为5′-CGCGGATCCATGGCAACAAACGGAGA A-3′,下游引物为5′-GGCTCGAGTCAGCAGACG CCGGGC-3′,酶切位点为HI、I,进行PCR扩增,切胶回收PCR产物。利用平末端T载体连接CCoAOMT基因并转化至Transl-T1感受态细胞中,提取阳性克隆菌Transl-T1质粒并测序。重组质粒-T及pET-28a载体经双酶切后进行回收纯化。T4DNA连接酶连接质粒与载体双酶切产物并转化至DH 5α,提取阳性菌落质粒,最终获得表达载体pET-28a-。
1.2.2原核表达条件的优化及蛋白纯化
重组质粒pET-28a-转化至BL21 (DE3),经含卡那霉素的LB固体培养基扩大培养后,挑选阳性单菌落,在3 mL液体培养基(Kan+)试管中过夜培养。取3 µL培养液在3 mL LB液体培养基(100 mg/L Kan+)中培养3 h后冰上放置2 min,分别加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度为0.1、0.3、0.5、0.7、1.0 mmol/L,37 ℃、180 r/min诱导4 h后离心,收集菌体。菌体冰上放置,待菌体重悬后超声破碎,4 ℃、12 000 r/min离心10 min,取上清液,破壁蛋白沉淀部分同样进行重悬。沉淀液与上清液于100 ℃水浴10 min,使蛋白变性,水浴结束,沉淀液12 000 r/min室温离心15 min后,取上清。SDS-PAGE电泳(12%分离胶、5%浓缩胶)检测上清液及沉淀液上清。继而对诱导表达的蛋白进行纯化。
将Ni-NTA树脂重悬放置于层析柱,加入洗脱液冲洗多次。上清液经0.45 µm滤膜过滤后,加入Ni-NTA树脂。上样完成后用蛋白洗脱液进行梯度洗脱,封闭层析柱下端静置。收集分次洗脱样进行SDS-PAGE电泳检测。
1.2.3酶促反应条件优化
15 mL反应体系中(含1.2 mmol/L SAM、0.2 mmol/L MgCl2)加入1 mL由重组质粒pET-28a-转化至BL21诱导表达后保留的菌种经超声破碎的上清液,EGCG浓度设置为0.01、0.03、0.05、0.07、0.10、0.15 mmol/L,37 ℃水浴恒温1.5 h,加入200 µL 1 mol/L HCl终止反应,并用20 mL乙酸乙酯萃取,离心、旋转浓缩干燥萃取液,用0.2 mL甲醇溶解后过膜,按文献[13]方法对产物EGCG3"Me的生成量进行HPLC分析。选用最佳EGCG浓度,调节反应温度为25、35、37、40、45 ℃,选用最佳EGCG浓度和温度,使用柠檬酸-磷酸盐调节反应体系pH值为3.0、3.5、4.0、4.5、5.0,进行反应和HPLC分析。
2 结果与分析
2.1 pET-28a-CCoAOMT重组质粒的鉴定
CCoAOMT基因经PCR扩增后,获得了900 bp左右的特异性条带。转化至Transl-T1,提取质粒并测序,双酶切重组正确质粒和pET-28a载体,再把酶切产物连接后转化至DH 5α进行菌落PCR扩增,经测序验证序列,结果(图1)表明,成功构建了pET-28a-重组质粒。
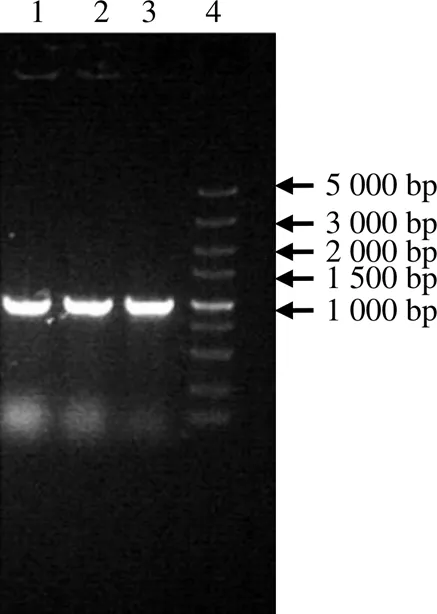
1~3 随机挑选的单菌落;4 DNA标准条带。
2.2 重组茶树pET-28a-CCoAOMT的诱导表达
对诱导温度和诱导时间进行优化,发现在37 ℃下诱导4 h,蛋白表达效果最佳,进而用于筛选IPTG浓度。不同的IPTG终浓度诱导下,在BL21中均得到表达(图2)。上清液及沉淀蛋白中都存在特异性条带,所得的重组蛋白相对分子质量约为28 000,与理论值相符。上清液和沉淀中均存在重组蛋白,表明重组蛋白CCoAOMT是以包涵体形式存在的。比较发现,重组蛋白在上清液和沉淀中表达差异明显,上清液中的表达量相对较高。IPTG终浓度为0.5 mmol/L时,上清和沉淀部分的蛋白表达量均较高,而后提高诱导剂浓度,差异并不明显。可见,重组质粒最佳诱导表达条件为:诱导温度37 ℃,诱导时间4 h,IPTG终浓度0.5 mmol/L。
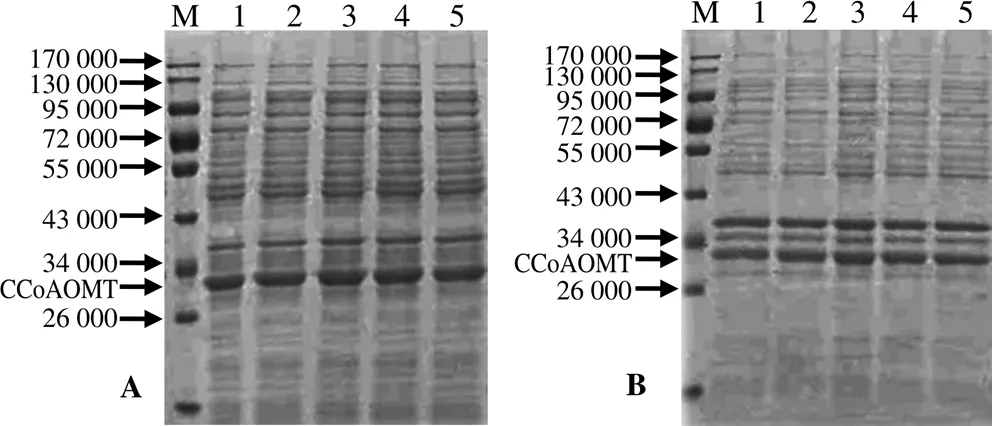
A 上清液部分;B 沉淀部分;M 蛋白标准条带;1~5 IPTG终浓度分别为0.1、0.3、0.5、0.7、1.0 mmol/L。
2.3 重组蛋白CCoAOMT的纯化
表达菌株BL21扩大诱导后,利用Ni-NTA亲和色谱柱纯化蛋白。图3为重组蛋白分次洗脱的SDS-PAGE电泳图谱。泳道5为经梯度洗脱纯化后的蛋白,其蛋白相对分子质量约为28 000,与理论值相符。Ni-NTA树脂基本能吸附重组蛋白。2次洗脱后,大肠杆菌内及反应中的杂蛋白基本洗脱,第3次洗脱少量蛋白被洗脱出来,说明重组蛋白易洗脱。目的蛋白经Elute Buffer第4次洗脱时基本洗脱,而Wash Buffer洗脱液仅洗脱出少量的目的蛋白。

M 蛋白标准条带;1 上清液;2 第1次洗脱液;3 第2次洗脱液;4 第3次洗脱液;5 第4次洗脱液。
2.4 酶促产物的HPLC分析
图4为反应产物的HPLC图谱。在EGCG3"Me对照品相应保留时间25 min左右处可见1个色谱峰,经HPLC分析,鉴定为EGCG3"Me,表明重组蛋白CCoAOMT具有生物学活性,能催化EGCG生成EGCG3"Me。
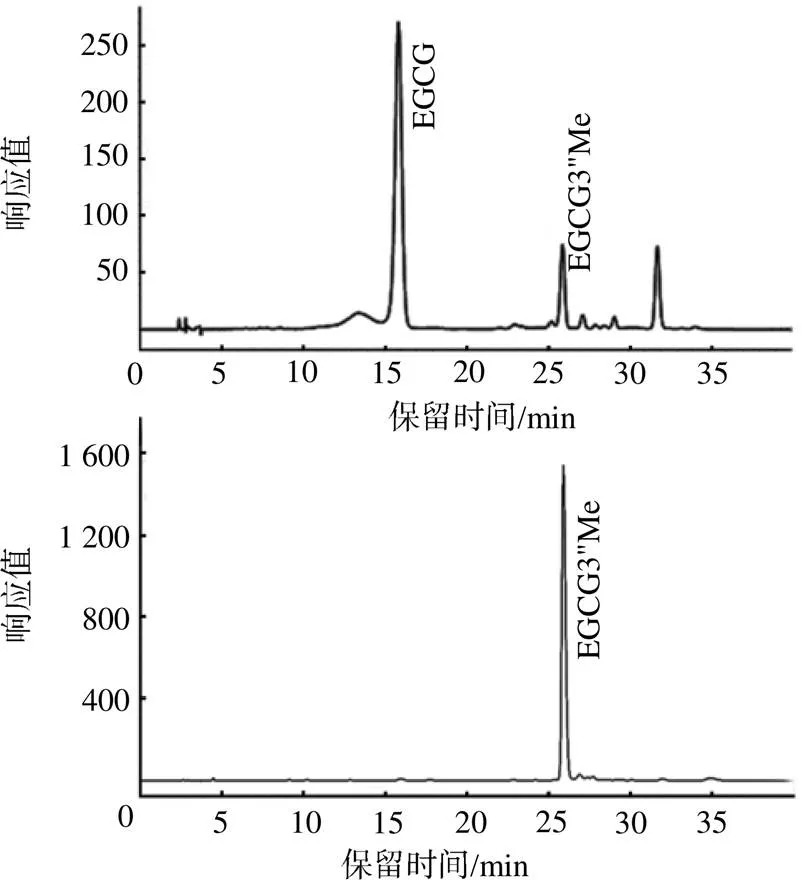
图4 EGCG酶促反应产物的HPLC图谱
2.5 不同酶促反应条件下的产物生成量
从表1可以看出,当EGCG浓度为0.05 mmol/L时,转化率达11.1%;继续提高EGCG浓度,EGCG转化率反而降低。不同酶促温度下,EGCG3"Me生成量35 ℃至37 ℃增幅较大,37 ℃时EGCG3"Me生成量最大;而后再提高温度,EGCG3"Me生成量降低。酶促反应体系pH值从3.0增加到4.0时,EGCG3"Me生成量增加并出现最高值;而后继续升高pH值,EGCG3"Me生成量下降;pH为4.0时,酶促活性最佳,EGCG3"Me生成量最高。由此可见,该酶促反应最佳的底物浓度为0.05 mmol/L,温度为37 ℃,酶促pH值为4.0。

表1 不同酶促反应条件下的EGCG转化率和EGCG3"Me生成量
3 结论与讨论
对重组在大肠杆菌中诱导表达条件进行优化,最佳诱导表达条件为37 ℃下诱导4 h ,IPTG终浓度为0.5 mmol/L。利用Ni-NTA亲和层析柱,经梯度洗脱达到了较好的纯化效果。用重组CCoAOMT,以EGCG为底物进行酶促反应,重组酶能催化EGCG生成EGCG3"Me,且最佳的EGCG底物浓度为0.05 mmol/L,酶促温度为37 ℃,酶促pH值为4.0。
大肠杆菌诱导表达体系中,诱导温度和时间、IPTG浓度均能影响目的蛋白的表达[14-16]。本研究在成功构建重组融合表达载体pET-28a-的基础上,使用优化后的诱导温度(37 ℃)和诱导时间(4 h),改变IPTG终浓度,分析了重组茶树诱导表达的最佳IPTG终浓度。结果表明,同一IPTG终浓度条件下,目的蛋白在上清液中表达量均较沉淀部分高,差异明显;不同IPTG终浓度条件下,上清液中的蛋白表达量在0.5~1.0 mmol/L,表达稳定,继续增大IPTG浓度,对蛋白的表达量影响不明显。考虑到IPTG诱导剂具有潜在毒性,最终确定其最低有效诱导终浓度为0.5 mmol/L,即在大肠杆菌中的最佳表达条件为37 ℃、0.5 mmol/L IPTG诱导表达4 h。
重组蛋白CCoAOMT经Ni-NTA亲和层析柱梯度洗脱,达到了较好的纯化效果,呈现出单一的目的蛋白条带,纯化后的蛋白相对分子质量约为28 000。使用梯度咪唑洗脱,可以控制Ni柱中结合位点的数量,从而对目标蛋白的结合效率进行调整,以达到纯化重组蛋白的目的[17]。洗脱液中咪唑浓度较高,有助于目的蛋白的洗脱。对重组蛋白的活性进行验证,以主要的酶促产物EGCG3"Me生成量为指标,进一步探究其体外酶促反应条件,结果显示,重组蛋白CCoAOMT能催化EGCG生成EGCG3"Me,重组酶具有催化活性,酶促反应的最佳EGCG底物浓度为0.05 mmol/L,酶促温度为37 ℃,酶促pH值为4.0。
[1] YE Z H.Association of caffeoyl coenzyme A 3--methy- ltransferase expression with lignifying tissues in several dicot plants[J].Plant Physiology,1997,115(4):1341- 1350.
[2] 王华美,于延冲,付春祥,等.木质素合成关键酶咖啡酰辅酶A氧甲基转移酶的研究进展[J].基因组学与应用生物学,2014,33(2):458-466. WANG H M,YU Y C,FU C X,et al.Progress of a key enzyme-caffeoyl-CoA 3--methyltransferase in lignin biosynthesis[J].Genomics and Applied Biology,2014,33(2):458-466.
[3] 费冬梅,林智,吕海鹏,等.EGCG--甲基转移酶(EOMT)在重组大肠杆菌中的表达条件研究[J].茶叶科学,2011,31(4):333-340. FEI D M,LIN Z,LYU H P,et al.Study on expression conditions of EGCG--methyl transferase in recombinantbacteria[J].Journal of Tea Science,2011,31(4):333-340.
[4] 任晓萌,商虎,高晨曦,等.茶叶中天然累积和人工合成的甲基化EGCG的研究进展[J].食品研究与开发,2019,40(4):202-208. REN X M,SHANG H,GAO C X,et al.Research progress of natural accumulation and synthetic-methylated EGCG in tea plants[J].Food Research and Development,2019,40(4):202-208.
[5] 吕海鹏,谭俊峰,林智.茶树种质资源EGCG3"Me含量及其变化规律研究[J].茶叶科学,2006,26(4):310-314. LYU H P,TAN J F,LI Z.Study on the content of EGCG3"Me in different tea germplasms and its changes[J]. Journal of Tea Science,2006,26(4):310-314.
[6] SAIJO R.Isolation and chemical structures of two new catechins from fresh tea leaf[J].Agricultural and Biological Chemistry,1982,46(7):1969-1970.
[7] SANO M,SUZUKI M,MIYASE T,et al.Novel antiallergic catechin derivatives isolated from oolong tea[J].Journal of Agriculture and Food Chemistry,1999,47(5):1906-1910.
[8] MAEDA-YAMAMOTO M,SANO M,MATSUDA N,et al.The change of epigallocatechin-3--(3--methyl) gallate content in tea of different varieties,tea seasons of crop and processing method[J].Nippon Shokuhin Kagaku Kogaku Kaishi,2001,48(1):64-68.
[9] SUZUKI M,SANO M,YOSHIDA R,et al. Epimerization of tea catechins and-methylated derivatives relationship between epimerization and chemical structure[J].Journal of Agricultural and Food Chemistry,2003,51(2):510-514.
[10] MAEDA-YAMAMOTO M,TACHIBANA H.Anti- allergic action of-methylated EGCG in green tea cultivar Benifuuki[J].Journal of Food and Drug Analysis, 2012,20(1):313-317.
[11] TANTOUSH Z,APOSTOLOVIC D,KRAVIC B,et al. Green tea catechins of food supplements facilitate pepsin digestion of major food allergens,but hampers their digestion if oxidized by phenol oxidase[J].Journal of Functional Foods,2012,4(3):650-660.
[12] ZHANG Y,LYU H P,MA C Y,et al.Cloning of a caffeoyl-coenzyme A-methyltransferase fromand analysis of its catalytic activity[J].Journal of Zhejiang University-SCIENCE B,2015,16(2):103-112.
[13] 李银花,李娟,龚雪,等.高效液相色谱法同时测定茶叶中8种儿茶素、3种嘌呤碱和没食子酸[J].食品科学,2011,32(18):214-217. LI Y H,LI J,GONG X,et al.Simultaneous determination of eight catechins,three purine alkaloids and gallic acid in tea by high-performance liquid chromatography[J]. Food Science,2011,32(18):214-217.
[14] GAO Q,ZHAO J M,SONG L S,et al.Molecular cloning,characterization and expression of heat shock protein 90 gene in the haemocytes of bay scallop[J]. Fish&Shellfish Immunology,2008,24(4):379-385.
[15] 杨隆兵,国果,马慧玲,等.家蝇抗菌肽AMPs17蛋白原核表达条件的优化及其抗真菌活性检测[J].中国生物工程杂志,2019,39(4):24-31. YANG L B,GUO G,MA H L,et al.Optimization of prokaryotic expression conditions and antifungal activity detection of antibacterial peptide AMPs17 protein in[J].China Biotechnology,2019,39(4):24-31.
[16] 魏婕,易忠,魏玉荣,等.IPTG诱导浓度、时间对Asia I型口蹄疫病毒VP1蛋白表达的影响[J].中国畜牧兽医,2009,36(5):63-66. WEI J,YI Z,WEI Y R,et al.Effect of induced concentration and time of IPTG on the expression of VP1 protein of FMDV type Asia I[J].China Animal Husbandry & Veterinary Medicine,2009,36(5):63-66.
[17] 田阳,饶欢,薛文通.花生致敏原Ara h 1的重组表达与纯化[J].中国食品学报,2020,20(8):20-28. TIAN Y,RAO H,XUE W T.Expression and purification of recombinant peanut allergen Ara h 1[J].Journal of Chinese Institute of Food Science and Technology,2020,20(8):20-28.
Prokaryotic expression offromand optimization of enzymatic conditions
TANG Qian1,2,4, CHEN Si1,2,4, OU Shuqiong1,2,4, LI Qin1,2,3,4, LI Juan1,2,3,4*, WANG Kunbo1,2,3,4*
(1.National Research Center of Engineering and Technology for Utilization of Botanical Functional Ingredients, Changsha, Hunan 410128, China; 2.Key Laboratory of Education Ministry for Tea Science, Changsha, Hunan 410128, China; 3.Co-Innovation Center of Education Ministry for Utilization of Botanical Functional Ingredients, Changsha, Hunan 410128, China; 4.Horticulture College, Hunan Agricultural University, Changsha, Hunan 410128, China)
The expression of the recombinant caffeinyl-coenzyme A-methyltransferase gene() incells was optimized and the enzyme was purified by Ni-NTA affinity chromatography. The enzymatic reaction was carried out in vitro with epigallocatechin gallate (EGCG) as substrate, and EGCG3"Me, the reaction products, were analyzed by HPLC. As a result,was highly expressed inBL21 andthe best induction conditions of recombinantwas 0.5 mmol/L IPTG at 37 ℃ for 4 h. The recombinant protein was purified by Ni-NTA affinity chromatography. The recombinant CCoAOMT could catalyze EGCG to EGCG3"Me in vitro and the optimal reaction conditions include substrate EGCG of 0.05 mmol/L, pH of 4 andtemperature of 37 ℃.
; caffeinyl-coenzyme A-methyltransferase; prokaryotic expression; purification; enzymatic synthesis
S571.101
A
1007-1032(2020)05-0533-05
唐倩,陈丝,欧淑琼,李勤,李娟,王坤波.茶树原核表达及酶促条件优化[J].湖南农业大学学报(自然科学版),2020,46(5):533-537.
TANG Q, CHEN S, OU S Q, LI Q, LI J, WANG K B. Prokaryotic expression offromand optimization of enzymatic conditions[J]. Journal of Hunan Agricultural University(Natural Sciences), 2020, 46(5): 533-537.
http://xb.hunau.edu.cn

2019-11-22
2020-08-01
国家科学技术部重点研发计划课题(2018YFC1604403);湖南省科学技术厅中央引导地方科技发展项目(2019XF5041);湖南省科学技术厅重点研发计划项目(2018NK2031)
唐倩(1996—),女,湖南郴州人,硕士研究生,主要从事茶树分子生物学研究,250482928@qq.com;*通信作者,李娟,博士,讲师,主要从事茶树资源及分子生物学研究,xixi_lj@126.com;*通信作者,王坤波,博士,教授,主要从事茶树分子生物学和次生代谢研究,wkboo163@163.com
责任编辑:罗慧敏
英文编辑:罗维
