羧基化聚乙烯基萘纳米微球的制备和应用
2015-06-01张俊峰王冬梅王彦春魏殿军
张俊峰,靳 颖,徐 亮,程 帅,王冬梅,王彦春,魏殿军
羧基化聚乙烯基萘纳米微球的制备和应用
张俊峰1,靳 颖2,徐 亮3,程 帅3,王冬梅3,王彦春1,魏殿军1
以乙烯基萘(VN)为聚合单体,采用乳液聚合法制备聚乙烯基萘(PVN)纳米微球。通过对其羧基化与β2微球蛋白(β2-M)抗体偶联,制成免疫检测试剂。分别用聚苯乙烯(PS)和PVN检测试剂测定β2-M含量,数据经统计学处理和分析,对自制的PVN纳米微球胶乳增强免疫比浊(LETIA)检测试剂的性能进行评价。自制的羧基化PVN纳米微球免疫试剂成功对标准样本进行了检测并在一定范围内有较好的线性,比PS检测试剂更加灵敏。利用该研究采用的方法和条件可以成功制备粒径大小可控、单分散的羧基化PVN纳米微球,是比PS更优的LETIA新载体,具有很好的临床应用前景。
乙烯基萘;胶乳增强免疫比浊法;β2微球蛋白;纳米微球
乳液聚合是微球制备最常用的方法,主要以水为分散介质[1],需要氮气的保护;乳液聚合无污染或低污染,在工业、农业和生物医药等方面得到了广泛应用[2-4],是最常使用的免疫分析方法之一。迄今,胶乳增强免疫比浊(latex enhanced turbidimetric immunoassay,LETIA)在临床中已经应用于C反应蛋白[4]、胱抑素C[5]、前列腺特异性抗原[6]等涉及炎症、肝肾功能、肿瘤等多个领域项目的检测。目前LETIA检测试剂多以聚苯乙烯(polystyrene,PS)纳米微球为载体,该基质小粒径PS微球偶联抗体量大,可以保证较大线性范围,然而透光率低,灵敏度较差;大粒径PS微球可以提升灵敏度,但偶联抗体量减小,线性范围相对变窄[7]。该研究采用乳液聚合法首次成功制备了羧基化聚乙烯基萘(polyvinyl naphthalene,PVN)纳米微球,可利用较小粒径微球偶联较大量抗体,在提供较好灵敏度的同时又保证有较大的线性范围,将其用作LETIA检测试剂的载体,有很好的临床应用前景。
1 材料与方法
1.1 主要试剂和仪器乙烯基萘(vinyl naphthalene,VN),分析纯,购自国药集团化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS),电泳级,购自天津联星生物公司;过硫酸钾(potassium persulfate,KPS),分析纯,购自天津市化学试剂批发公司;丙烯酸钠(95%)购自天津市光复精细化工研究所;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC 99%]、BSA 99%购自美国Sigma-Aldrich试剂公司;N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS 99%)购自美国Pierce试剂公司;β2微球蛋白(β2-M)及其抗体(IgG 99%)购自深圳菲鹏生物科技有限公司;羧基化PS纳米微球购自伊普西隆(浙江瑞安)生物科技有限公司;DelsaTMNano C纳米粒度及zeta电势分析仪购自美国Beckman Coulter公司;380型傅里叶变换红外光谱仪购自美国Nicolet公司;XL30环境扫描电子显微镜购自荷兰Philips公司;H7180大型生化分析仪和U-3310分光光度计购自日本日立公司。
1.2 方法
1.2.1 羧基化PVN纳米微球的制备 利用乳液聚合法制备羧基化PVN纳米微球。称量0.04~0.15 g乳化剂SDS加入50 ml锥形瓶中,加入碳酸盐缓冲溶液和引发剂KPS溶液,然后加入VN单体;采用化学键合的方法,加入丙烯酸钠;在微球表面引入羧基,进行功能基化改性,以利于该微球的后续应用。通氮气10~15 min,密封,振摇乳化10~15 min。最后放入80℃水浴摇床中120 r/min振摇10 h。使用经过处理的透析袋以蒸馏水为透析液透析制备所得的已知粒径的微球3 d,除去微球中反应后剩余的单体及其他副反应物,将此微球保存于4℃冰箱中,待用。
1.2.2 羧基化PVN纳米微球的表征方法 用DelsaTMNano C纳米粒度及zeta电势分析仪测量羧基化PVN纳米微球的粒径以及单分散系数(particle dispersion index,PDI);采用溴化钾(KBr)压片的方法在380型傅里叶变换红外光谱仪上检测羧基化PVN微球是否连上羧基;用XL30环境扫描电子显微镜观察纳米微球的表面形貌;用U-3310分光光度计在600 nm波长下测量羧基化PVN纳米微球的吸光度(absorbance,A),并与同等粒径的羧基化PS对比。
1.2.3 β2-M-LETIA检测试剂的制备 取羧基化PS纳米微球和羧基化PVN纳米微球各适量,分别依次向其中加入等量EDC和NHS对表面进行活化,室温放置15 min。然后迅速加入等量的β2-M抗体,在37℃恒温水浴锅中反应3 h。取出反应物后采用切向流过滤除去游离的β2-M抗体,收集上清液,用于定量键合抗体量。下层物质加BSA封闭12 h,即可得到反应溶液R2。配制一定离子强度的反应溶液R1(50mmol/L Tris-HCl缓冲液,pH 7.4),此两种反应溶液共同组成β2-M-LETIA检测试剂。
2 结果
2.1 羧基化PVN纳米微球制备条件的考察
2.1.1 缓冲液的影响 总体积为10 m l,NaHCO3和Na2CO3浓度分别为20 mmol/L,通过取不同体积的溶液配比调节缓冲液pH值,制备羧基化PVN纳米微球,并测量反应后纳米微球的粒径及粒径分布。实验结果显示,NaHCO3和Na2CO3各5 ml时,制备出的羧基化PVN纳米微球的PDI为0.033,较低;其他配比条件制备出的微球PDI均大于0.1,单分散性较差。
2.1.2 引发剂浓度的影响 在羧基化PVN纳米微球制备过程中,KPS不仅影响反应速度,而且影响纳米微球粒径分布。实验表明,0.1%的KPS粒径分布最小为0.038,而KPS浓度为0.3%和0.4%,制备出的羧基化PVN纳米微球粒径和PDI均较大。
2.1.3 VN单体质量的影响 在一定范围内,羧基化PVN纳米微球的粒径会随着VN单体量的增加而增加,实验结果显示当VN单体含量为1 g时最为合适,单分散性较好。
2.1.4 加入丙烯酸钠对粒径的影响 加入不同质量丙烯酸钠会对纳米微球的粒径产生不同的影响,羧基化PVN纳米微球的粒径会随丙烯酸钠量的增加先减小后增大(表1)。
2.1.5 乳化剂浓度的影响 乳化剂SDS对羧基化PVN纳米微球的粒径有显著性影响,羧基化PVN纳米微球的粒径随SDS浓度增加而减小(表2)。通过扫描电镜观察所得羧基化PVN纳米微球为粒径均匀的球形结构、表面光洁,呈单分散存在(图1)。
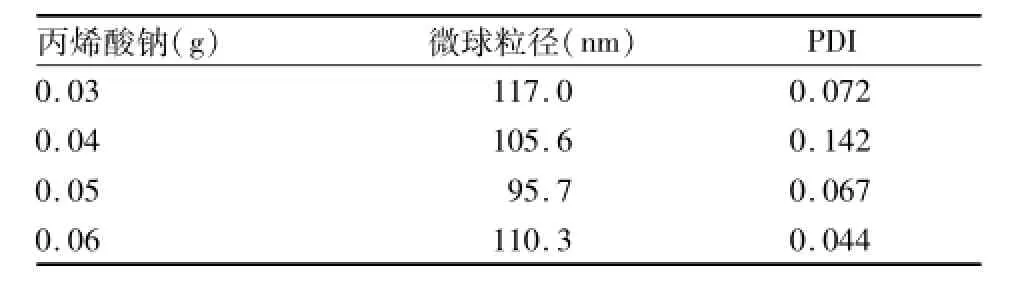
表1 在SDS浓度为0.05%下加入不同质量丙烯酸钠对纳米微球粒径的影响

表2 乳化剂SDS浓度与羧基化PVN纳米微球粒径关系
2.2 羧基化PVN纳米微球的表征
2.2.1 纳米微球的红外光谱图 PVN、羧基化PVN、羧基化PVN-IgG的红外光谱如图2所示。通过(图2A)、(图2B)比较VN单体、PVN和羧基化PVN微球的红外吸收峰位发现,图2A中1 800 cm-1为烯烃末端-C=C-H的振动谱带,1 700~2 000cm-1为萘环及烯烃C=C的累计双键振动谱带,1 606 cm-1和1 599cm-1为苯环骨架振动谱带,指纹区的771 cm-1和696 cm-1为单取代振动谱带。图2B在2 920 cm-1和2 848 cm-1为饱和-CH2振动谱带,1 597 cm-1和1 504cm-1为苯环骨架振动谱带,1 347 cm-1裂为一强一弱两个峰,为偕三甲基中碳振动谱带,证明有饱和碳原子,990 cm-1吸收峰消失,证明末端烯烃消失,771 cm-1和696 cm-1指纹区单取代振动谱带消失,说明单体VN合成了聚合物微球。比较图2B中PVN微球和羧基化PVN微球红外谱图可以看出,羧基化PVN微球红外谱图在1 573 cm-1处出现-C=O振动谱带。证明在PVN微球上键合了-COOH。图2C中2 500~3 200 cm-1的宽强峰为-COOH中的缔合-OH振动谱带,1 631 cm-1为-C=O的吸收峰,1 553 cm-1为-N-H的吸收峰,1 037 cm-1为-COOH中的-C-O吸收峰,说明IgG成功键合在微球表面。
2.2.2 羧基化PVN纳米微球以及与羧基化PS纳米微球的A对比 在特定波长下,同等粒径的羧基化PVN纳米微球比羧基化PS纳米微球的A值大,粒径越大A值相差也越大(表3),说明羧基化PVN纳米微球的灵敏度更好。
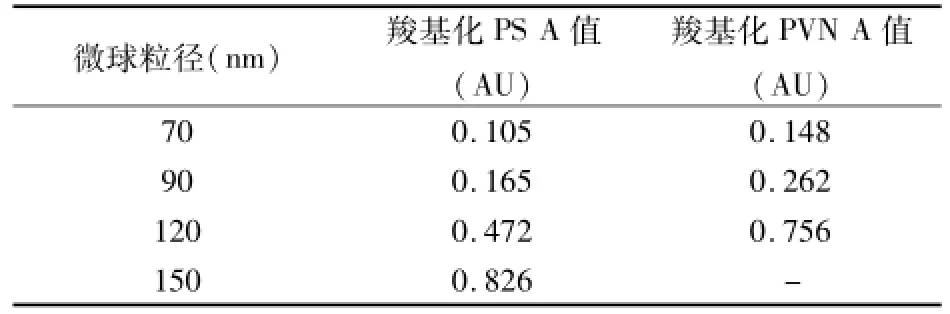
表3 波长600 nm处羧基化PS与羧基化PVN微球的A值
2.3 β2-M-LETIA试剂的研制及应用
2.3.1 制作检测试剂因素的考察 经过大量实验显示,当每毫升纳米微球加入EDC和NHS各0.1 mg和β2-M抗体3 mg时才能制成β2-M-LETIA试剂。
2.3.2 检测接入β2-M抗体数量 羧基化PS和羧基化PVN微球在接入β2-M抗体后,微球的粒径和PDI均有所增加。由表2~5可以看出PS微球粒径120 nm时接入抗体量较大,120 nm的PVN微球接入量较同粒径的PS微球大(表4)。
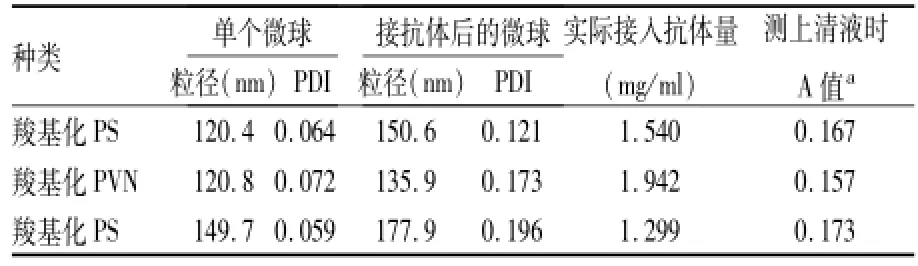
表4 羧基化PS和羧基化PVN接入抗体数量
2.3.3 标准曲线 以理论浓度(0、2.5、5.0、10.0、17.5、25.0 mg/L)为横坐标、试剂测量数据A值为纵坐标,在0~25 mg/L的浓度范围内,考察以PVN和PS纳米微球为载体的β2-M-LETIA试剂的线性范围并绘制标准曲线(图3)。如图所示,自制的羧基化PVN纳米微球检测试剂的线性范围较羧基化PS纳米微球的线性范围要好。120 nm羧基化PS纳米微球在理论浓度为0~10 mg/L内呈线性,在0~5 mg/L范围内其相关系数可以达到0.981 5。150 nm羧基化PS纳米微球在理论浓度为0~5 mg/L内呈线性,其相关系数可以达到0.998 8。而120 nm羧基化PVN纳米微球在理论浓度为0~17.5 mg/L内呈线性,在0~10 mg/L内其相关系数可以达到0.902 3。因此,PVN纳米微球作为LETIA试剂的载体材料与PS相比有更高的灵敏度并且可以提供较大的线性范围。
2.3.4 临床样本的方法建立检测 用正常人血清和50 mg/L的标准品配制3个样品即S0:正常人血清500μl;S1:正常人血清450μl+标准品50μl;S2:正常人血清350μl+标准品150μl。分别将PS纳米微球和PVN纳米微球检测试剂在同一大型生化分析仪上在600 nm处对临床样本中的β2-M进行检测,并将测试结果进行比对,结果见表5。在测量低值实际样品时,120 nm的PVN纳米微球试剂和120、150 nm PS纳米微球试剂的回收率处于95%~105%,说明测量准确;测量高值实际样品时,由于120 nm PVN纳米微球试剂标准曲线线性范围较大,可以得到较高回收率,即测量结果较准确。通过实际样品测量比较,可知自制以羧基化PVN纳米微球为载体的β2-M-LETIA检测试剂有明显优势。

表5 PVN和PS试剂临床样本的检测结果
3 讨论
本文研究了pH值、引发剂和VN单体浓度、乳化剂添加量等各因素在羧基化PVN纳米微球的制备过程中对其粒径及粒径分布的影响:①pH缓冲剂:离子型乳化剂只有在一定的pH值范围内才能起到有效的乳化作用。SDS为阴离子型乳化剂,需要在碱性介质中使用,在使用PBS缓冲体系时微球制备均聚集,后采用NaHCO3-Na2CO3作为缓冲液;②单体:在一定范围内,羧基化PVN纳米微球的粒径会随着VN单体量的增加而增加;③乳化剂:乳化剂对羧基化PVN纳米微球的粒径有显著的影响,微球粒径随乳化剂浓度的增大而减小;④丙烯酸钠:羧基化PVN纳米微球的粒径会随丙烯酸钠量的增加先减小后增大。由于丙烯酸钠本身有两亲性,加入量较小时起乳化剂作用;随丙烯酸钠加入量增加,微球粒径逐渐减小,超过临界值,起盐溶液作用,粒径随加入量的增加而增大。通过对这些影响因素详细地考察,达到对羧基化PVN纳米微球的粒径大小和分布进行调控。通过一系列的考察可以得知,以1 g VN为单体,SDS为乳化剂,各5m l的20mmol/L的NaHCO3和Na2CO3为缓冲溶液,0.1%KPS为引发剂,对得到的羧基化PVN用扫描电镜、激光粒度仪、傅里叶红外光谱仪进行表征,表明合成的羧基化PVN微球表面光滑,单分散性好,球形度好,证实可制备出优良的羧基化PVN纳米微球。目前,课题组已经能够成功地制备粒径范围在60~200 nm的羧基化PVN纳米微球。
通过A值的比较,证明自制的羧基化PVN纳米微球的灵敏度要比羧基化PS纳米微球高,并通过与抗体偶联制备成β2-M-LETIA试剂应用于临床样品检测进行验证。经实验证明PVN纳米微球检测试剂更灵敏,有更好的线性范围,在测量小于17.5 mg/L浓度范围的样品时准确度更高。PVN纳米微球与同粒径的PS纳米微球相比有更高的灵敏度,与大粒径的PS纳米微球相比有较宽的线性范围。通过实际样品测量比较可知自制以羧基化PVN纳米微球为载体的β2-M-LETIA检测试剂具有明显优势,PVN纳米微球作为LETIA试剂的载体材料有很大的临床应用潜力。
[1] Kohri M,Uzawa S,Kobayashi A,et al.Enzymatic emulsifier-free emulsionpolymerization to prepare polystyrene particles using horseradish peroxidase as a catalyst[J].Polymer J,2012,129(10):354-8.
[2] Prescher S,Ghasimi S,Höhne P,et al.Polyfluorene polyelectrolyte nanoparticles:synthesis of innovative stabilizers for heterophase polymerization[J].Macromol Rapid Commun,2014,35(22):1925-30.
[3] 李清华,宋聿炜,刘 笋,等.乳液聚合法合成农用聚羧酸盐分散剂[J].现代农药,2013,12(6):27-9.
[4] Oliveira KG,von Zeidler SV,Lamas A Z,etal.Relationship of inflammatorymarkers and pain in patients with head and neck cancer prior to anticancer therapy[J].Braz JMed Biol Res,2014,47(7):600-4.
[5] Sohrabian A,Noraddin FH,Flodin M,et al.Particle enhanced turbidimetric immunoassay for the determination of urine cystatin C on Cobas c501[J].Clin Biochem,2012,45(4-5):339-44.
[6] Akino H,Tsuka H,Okada K,et al.Value of serum PSA and PAP measurementwith newly developed latex turbidimetric immunoassay[J].Hinyokika Kiyo,1995,41(6):439-45.
[7] Colfen H,Volkel A,Shinichi E,et al.Mechanism of nanoparticleenhanced turbidimetric assaysapplying nanoparticles of different size and immunoreactivity[J].Langmuir,2002,18:7623-8.
Preparation and app lication of carboxylic polyvinyl naphthalene nanospheres
Zhang Junfeng1,Jin Ying2,Xu Liang3,et al
(1The Second Hospital of Tianjin Medical University,Tianjin 300211;2The Affiliated Hospital of Armed Police Force Logistics Institute,Tianjin 300163;3Tianjin Key Laboratory on Technologies Enabling Developmentof Clinical Therapeutics and Diagnostics,School of Pharmacy,Tianjin Medical University,Tianjin 300070)
Using vinyl naphthalene(VN)as the monomer,polyvinyl naphthalene(PVN)nanometermicrospheres were synthesized by emulsion polymerization,which were made for immunodetection reagents by carboxylating and coating withβ2-microglobulin(β2-M)antibody.β2-M was determined respectively using polystyrene(PS)and PVN immunodetection reagents and the results were statistically processed and analyzed,the purpose of which was that the performance of PVN-homemade nanoparticles carrier for latex enhanced turbidimetric immunoassay(LETIA)was evaluated.Immunological reagents of carboxylated PVN nanospheres had been successfully used for testing standard samples and having good linearity,therefore they weremore sensitive than that of PS nanospheres.Controllable particle size,monodisperse carboxylated PVN nanoparticles can be successfully synthesized by using method and conditions of this paper and have good prospects for clinical application,which are better than thatof PSnanospheres carrier for LETIA.
vinyl naphthalene;latex enhanced turbidimetric immunoassay;β2-microglobulin;nanospheres
R 318.08;R 313;R 446.11+2
A
1000-1492(2015)08-1184-05
2015-04-08接收
天津市应用基础与前沿技术研究计划(编号:14JCYBJC24300)
1天津医科大学第二医院检验科,天津 300211
2武警后勤学院附属医院,天津 300163
3天津市临床药物关键技术重点实验室,天津医科大学药学院,天津 300070
张俊峰,男,硕士,技师;
徐 亮,男,副教授,硕士生导师,责任作者,E-mail:xuliang@tmu.edu.cn;
靳 颖,女,副主任技师,责任作者,E-mail:jinying9032@hotmail.com
