大黄酚通过TLR4/NF-kB信号通路途径调控小胶质细胞炎性反应
2020-11-10郭青何前松胡斐然
郭青 何前松 胡斐然


摘要:目的 观察大黄酚对脂多糖(LPS)激活诱导的小胶质细胞炎性反应的影响并探讨其作用机制。方法 采用LPS诱导小胶质细胞活化,CCK-8检测不同浓度大黄酚(1、10、50、100 μg/ml)对小胶质细胞细胞活性的影响,将细胞分为空白组、LPS组、LPS+大黄酚低、中、高剂量组(1、10、50 μg/ml),一氧化氮(NO)测试盒检测细胞上清液中NO释放量,ELISA检测IL-1、TNF-a、IL-4和IL-10含量,蛋白免疫印迹法检测小胶质细胞NF-κB及TLR4蛋白表达的情况,免疫荧光法检测NF-κB蛋白在细胞中的位置变化。结果 大黄酚浓度在1~50 μg/ml对小胶质细胞活力影响不显著,此浓度范围内,大黄酚呈剂量依赖性地降低IL-1、TNF-a表达水平,升高IL-4、IL-10的表达水平(P<0.05);此外,大黄酚可抑制LPS诱导的小胶质细胞形态改变。与空白组比较,LPS组TLR4、NF-kB蛋白表达水平升高意义(P<0.05);与LPS组相比较,除LPS+大黄酚低剂量组胞核中NF-κB蛋白表达水平降低不显著外,其余各组上述蛋白水平表达均改善(P<0.05)。免疫荧光染色实验结果显示,与空白组相比较,LPS组细胞核中NF-κB蛋白表达上升,胞浆中NF-κB表达下降。结论 大黄酚可以抑制LPS诱导的小胶质細胞炎性反应,促进小胶质细胞M1型向M2型的转化,其机制可能与下调TLR4/NF-κB信号通路有关。
关键词:大黄酚;脂多糖;小胶质细胞;炎性反应
中图分类号:R285.5 文献标识码:A DOI:10.3969/j.issn.1006-1959.2020.19.016
文章编号:1006-1959(2020)19-0051-05
Abstract:Objective To observe the effect of chrysophanol on the inflammatory response of microglia induced by lipopolysaccharide (LPS) activation and explore its mechanism.Methods LPS was used to induce the activation of microglia. CCK-8 was used to detect the effects of different concentrations of chrysophanol (1, 10, 50, and 100 μg/ml) on the activity of microglia. The cells were divided into blank group, LPS group, LPS+chrysophanol low, medium and high dose groups (1, 10, 50 μg/ml), nitric oxide (NO) test kit detects the release of NO in the cell supernatant, and ELISA detects IL-1, TNF-a, IL -4 and IL-10 content, Western blotting was used to detect the expression of NF-κB and TLR4 protein in microglia, and immunofluorescence was used to detect the location of NF-κB protein in the cell.Results The concentration of chrysophanol in the range of 1-50 μg/ml has no significant effect on the viability of microglia. In this concentration range, chrysophanol dose-dependently reduces the expression level of IL-1 and TNF-a, and increases IL-4 and IL -10 expression level (P<0.05). In addition, chrysophanol can inhibit the morphological changes of microglia induced by LPS. Compared with the blank group, the expression levels of TLR4 and NF-kB protein in the LPS group increased(P<0.05); compared with the LPS group, except for the low-dose LPS+chrysophanol group, the expression of NF-κB protein in the nucleus except for the insignificant decrease in the level, the expression of the above-mentioned protein levels in the other groups was improved (P<0.05). The results of immunofluorescence staining experiments showed that compared with the blank group, the expression of NF-κB protein in the nucleus of the LPS group increased, and the expression of NF-κB in the cytoplasm decreased.Conclusion Chrysophanol can inhibit LPS-induced inflammatory response in microglia and promote the transformation of microglia from M1 type to M2 type might be related to the down-regulation of the TLR4/NF-κB signaling pathway.
Key words:Chrysophanol;Lipopolysaccharide;Microglia;Inflammatory response
脑缺血后导致一系列病理生理损伤事件,包括兴奋性氨基酸毒性损伤、钙调节障碍、氧化应激、炎症细胞浸润和细胞凋亡,造成不可逆的神经细胞凋亡[1]。缺血后神经炎症反应已被认为是缺血性中风的病理生理学的关键因素。小胶质细胞(microglia, MG)作为中枢神经系统的常驻巨噬细胞,其炎性活化在脑缺血损伤过程中发挥了重要作用[2]。脑缺血时损伤信号刺激小胶质细胞和募集的巨噬细胞在急性期被激活并极化为M2表型并分泌抗炎因子和神经营养因子(如IL-4、IL-10、BDNF等),然后逐渐向M1表型转变,可以产生炎性细胞因子和神经毒性因子,启动或加重神经元损伤,导致神经元变性死 亡[3,4]。越来越多证据表明[5,6],小胶质细胞表面表达的Toll样受体4(TLR4)在介导脂多糖(LPS)诱导的小胶质细胞激活和炎症反应中起重要作用,激活下游信号核因子kappa B(NF-κB)传导,促进细胞因子、细胞黏附分子等多种炎性介质转录。因此,选择性抑制M1型小胶质细胞,促进小胶质细胞由M1损伤型向M2修复型转化,是防治神经炎症以及神经退行性疾病的有效途径之一。大黄酚(chrysophanol,Chry)是从中药大黄中提取的活性成分,具有广泛的药理特性,如抗炎、改善记忆功能、抗心肌缺血以及脑保护等药理特性[7,8]。既往的研究表明[9],大黄酚可通过血脑屏障并保持其生物活性,可拮抗脑缺血/再灌注损伤,抑制小胶质细胞介导的神经炎症反应。但是在神经炎症的保护机制尚不明确。本研究采用LPS诱导小胶质细胞株活化建立炎症模型,观察大黄酚对小胶质细胞活化介导炎症反应的影响并探讨其作用机制,为大黄酚应用于神经炎症疾病的预防和治疗提供初步的实验依据。
1材料与方法
1.1主要药品与试剂 大黄酚(纯度98%)购于源叶生物有限公司;小胶质细胞株(Hapi)购于华拓生物公司;TLR4多克隆抗体、兔抗多克隆NF-kB p65抗体购于Bioswamp公司;兔抗GAPDH多克隆抗体购于Bioswamp公司;CCK-8检测试剂盒购于日本索莱宝公司;NO检测试剂盒购于南京建成公司;IL-6检测试剂盒、TNF-α检测试剂盒、IL-4检测试剂盒、IL-10检测试剂盒购于基因美公司;BCA蛋白浓度测定试剂盒购于日本索莱宝公司;高糖培养基、双抗(青链霉素)、胰酶消化液、PBS缓冲液、DMSO(二甲基亚砜)购于美国HYCLONE公司。
1.2仪器 低速离心机购于杭州奥盛仪器公司;超纯水生产仪购于美国Scientific公司;细胞培养箱、多功能酶标仪购于美国Thermo Fisher Scientific公司;倒置相差显微镜购于日本Olympus公司;电热恒温水浴箱购于上海精弘设备公司;电泳仪购于美国BIO-RAD公司;高速冷冻离心机购于杭州奥盛公司;全自动化学发光分析仪购于天能公司。
1.3方法
1.3.1细胞培养 细胞复苏后,用含10%胎牛血清、100 U/ml青霉素和链霉素的高糖DMEM培养基把Hapi小胶质细胞种植于培养瓶中,置于恒温培养箱(37 ℃、5%CO2)进行常规培养及传代,待状态稳定后移至96孔培养板上,分组进行实验。
1.3.2 CCK-8法检测细胞存活率 使用日本索莱宝公司CCK-8试剂盒进行检测。将对数生长的Hapi小胶质细胞均匀接种至96孔板中,培养24 h后,随机分为设空白(Blank)组、LPS组(0.1 μg/ml)、LPS+大黄酚低、中、高、很高剂量组(1、10、50、100 μg/ml)。每组设置6个复孔,进行12 h干预。干预结束后,孔板内加入10 μl的CCK-8试剂,2 h后多功能酶标仪在450 nm波长读取OD值。处理完毕后按照CCK-8试剂盒具体说明,向每孔加入10 μl CCK-8的试剂,将培养板在细胞培养箱内孵育2 h,用酶标仪测定在450 nm波长的吸光度。细胞存活率(%)=(实验组OD-空白组OD) /(对照组OD-空白组OD)×100%。
1.3.3一步法检测NO释放量 使用南京建成公司NO一步法试剂盒进行检测。将Hapi小胶质细胞以7000个/孔(100 μl)的密度接种至96孔培养板中,培养24 h后,随机分为空白组、LPS组、LPS+大黄酚低、中、高剂量组(1、10、50 μg/ml)。每组均设置6个复孔,干进行12 h的干预。干预结束后取100 μl细胞上清检测NO含量,按一步法试剂盒说明,取100 μl样本加入200 μl试剂一,充分混合并加入100 μl试剂二,彻底混合,静止10 min,在3500 r/min下离心10 min后,取160 μl上清液加入显色剂80 μl,混匀,静置15 min。用酶标仪测定在550 nm波长吸光度。
1.3.4倒置显微镜下观察细胞形态学 小胶质细胞以接种于96孔培养板,密度为7000 细胞/孔,100 μl培养基。组别设置为空白组、LPS组、LPS+大黄酚低、中、高剂量组(1、10、50 μg/ml)。每组设6个复孔。空白对照组常规培养,LPS模型组加入LPS(0.1 μg/ml)的培养基培养12 h,大黄酚预处理组用含LPS(濃度为0.1 μg/ml)进行预处理,其余处理步骤同LPS模型组。倒置显微镜下观察细胞形态、细胞密度及贴壁状态的改变。
1.3.5 ELISA法检测IL-l、TNF-a、IL-4、IL-10炎症因子表达 细胞分组及处理同1.3.3,处理结束后收集48孔板内细胞上清液,采用ELISA试剂盒测定各组培养孔内细胞上清液中促炎因子及抗炎因子的表达水平。
1.3.6蛋白免疫印迹方法检测TLR4、NF-kB蛋白表达 细胞分组及处理同1.3.3。收集处理过的细胞,冲洗(PBS3Ml、2次),在冰上用适量的细胞裂解液裂解约30 min,在裂解的上清液中定量蛋白质(BCA法),然后调节蛋白浓度,接着煮沸,然后进行电泳,切换至PVDF膜,在室温下封闭3 h(3%BSA),添加第一抗体后在4 ℃孵育过夜,洗涤膜,添加第二抗体(HRP标记)进行孵育,2 h后用ECL试剂显色,并收集图像。Bio-Rad成像仪进行成像分析,图片灰度值采用Image Lab软件进行分析。
1.3.7免疫荧光检测不同浓度大黄酚对NF-κB蛋白位置的影响 取出各组样本(12孔板),用 PBS洗涤2次(1 ml,3 min)。常温用1 ml 4%多聚甲醛固定约30 min,加入1 ml 0.5%Triton X-100室温通透 20 min,PBS洗涤后加入1 ml 5%BSA,在37℃条件下封闭1 h。滴加一抗即兔抗多克隆NF-kB p65抗体(1∶200)4 ℃过夜,Alexa Fluor 594标记羊抗兔IgG(1∶100)37 ℃ 1 h,加入300 μl抗荧光淬灭封片液(含DAPI)防淬灭剂封片,倒置荧光显微镜下观察,采集5个视野图片。采用Image pro plus6.0软件计算NF-κB核转移数。
1.4统计学分析 应用SPSS 20.0软件进行统计数据分析,数据使用(x±s)表示,组间比较用采用单因素方差分析,P<0.05表示差异有统计学意义,P<0.01表示统计学意义显著。
2结果
2.1各组小胶质细胞存活率 CCK法检查结果示,与空白组比较,100 μg/ml大黄酚预处理组的细胞存活率明显降低(P<0.05),其余各组均无明显下降(P>0.05),见表1。
2.2 NO释放量检测结果 一步法检测各组小胶质细胞NO释放量,结果显示与空白组比较,LPS组NO释放量明显增高,差异具有统计学意义(P<0.01);在大黄酚预处理组,随着大黄酚浓度的增加,NO的释放量逐渐减少(P<0.05)。其中1 μmol/L大黄酚预处理组与模型组比较,差异无统计学意义(P>0.05),见表2。
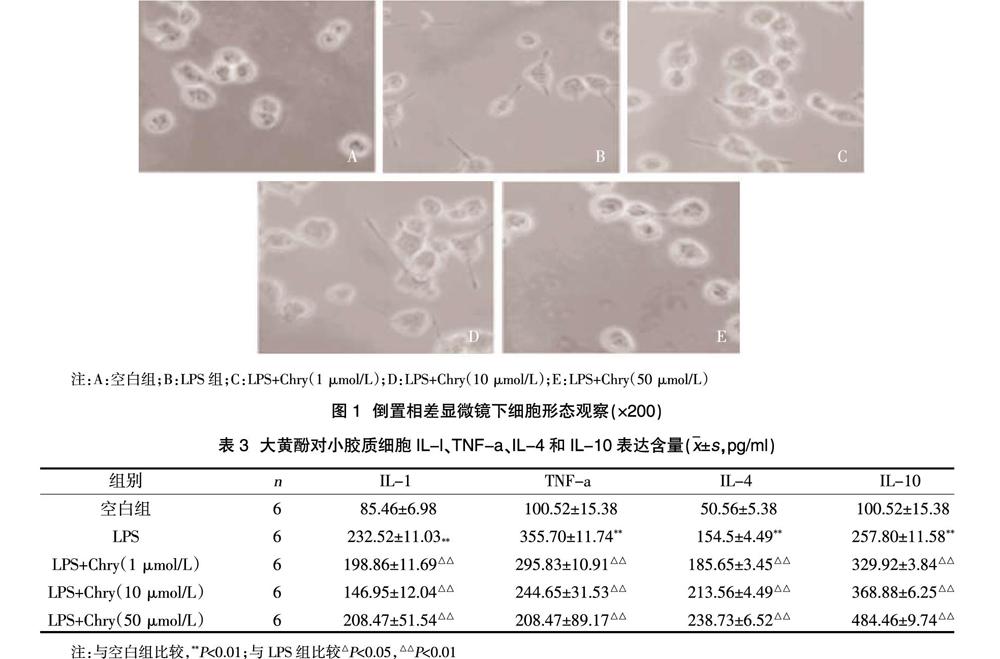
2.3显微镜下观察细胞的形态学变化 倒置相差显微镜下,空白对照组细胞呈静状态,细胞体小、纤细;与空白对照组相比较,LPS模型组细胞胞体增大,细胞表面的突起变粗或者变短,呈阿米巴样,小胶质细胞明显活化;大黄酚各剂量预处理不同程度地减少活化的小胶质细胞数量,见图1。
2.4大黃酚对小胶质细胞IL-l、TNF-a、IL-4和IL-10表达的干预作用 ELISA检测结果显示,与空白组比较,LPS刺激小胶质细胞后可明显上调上清液IL-l、TNF-a、IL-4和IL-10表达水平(P<0.01);与LPS模型组相比较,大黄酚各剂量组呈剂量依赖性降低促炎因子IL-l、TNF-a水平,升高抗炎因子IL-4、IL-10的表达水平(P<0.05),见表3。
2.5大黄酚对LPS刺激的小胶质细胞TLR4、NF-кB蛋白表达水平的影响 与空白组比较,LPS模型组TLR4、NF-kB蛋白表达水平显著升高,差异有统计学意义(P<0.05);与LPS模型组相比较,除大黄酚低剂量组胞核中NF-κB蛋白表达水平表达降低不显著外,其余各组上述蛋白水平表达均明显改善(P<0.05)。各组TLR4、NF-κB蛋白表达的电泳图见图2、表4。
2.6免疫荧光检测不同浓度大黄酚对NF-κB蛋白位置的影响 免疫荧光染色实验结果发现:与空白对照组相比较,LPS模型组细胞核中NF-κB蛋白表达明显上升,胞浆中NF-κB表达下降,用大黄酚处理则可以抑制NF-κB的核转移,见图3。
3讨论
免疫炎性反应作为脑部病理损伤机制中的一个重要组成部分,小胶质细胞在脑内炎症反应中起重要作用,可诱发、调控甚至放大包括中风在内的多种中枢神经系统的免疫调节机制。小胶质细胞被激活时,形态也可发生明显改变,从静息分枝状态快速转向阿米巴活化状态[10]。本实验研究结果显示,空白对照组细胞呈静状态,活化后小胶质细胞表面的突起变粗或变短,形态呈阿米巴样改变。大黄酚浓度在1~50 μg/ml对小胶质细胞活力影响不显著,在此浓度范围内,大黄酚能够显著抑制小胶质细胞形态的改变,提示大黄酚对小胶质细胞活化具有抑制作用。
脑缺血或脑损伤后,细胞内外离子失衡、多种可溶性炎性细胞因子表达以及兴奋性氨基酸、一氧化氮和氧自由基的生成等均可导致小胶质细胞激活[11]。整个活化过程呈现瀑布效应:分化、增殖,免疫分子表达或表达上调,迁移至损害部位,发生形态、免疫显性和功能改变等。小胶质细胞是中枢神经系统中的免疫细胞,其数量在脑细胞中占第3位(约10%)。受其环境的影响,小胶质细胞呈现多种表型,并保留转移功能以维持组织稳态的能力[12]。活化的小胶质细胞有M1型和M2型两种表型。通过LPS或IFN-γ刺激小胶质细胞可促使其向“M1促炎亚型”转变而募集适应性免疫细胞促进炎症反应或通过IL-4/IL-13刺激小胶质细胞可促使其向“M2型抑炎亚型”转变而发挥抗炎和促进损伤修复功能[13]。本研究中观察到大黄酚呈剂量依耐性地抑制小胶质细胞NO、IL-l、TNF-a的释放,促进IL-4、IL-10的表达。实验结果提示大黄酚具有拮抗LPS诱导的小胶质细胞炎症介质的释放,促进小胶质细胞M1型向M2型的转化。
TLR4作为炎症激活的关键上游门户蛋白,是Toll样受体家族的主要成员,广泛表达于小胶质细胞[14]。小胶质细胞激活过程中涉及TLR4信号,并激活下游信号核因子kappa B(NF-κB)传导,从而增加细胞因子(如TNF-α、IL-1β和IL-6)、趋化因子以及细胞黏附分子等多种炎性介质转录,还产生一氧化氮(NO)、活性氧簇(ROS)和类花生酸类(如前列腺素E2)等,导致继发性损害[15]。本研究中LPS刺激小胶质细胞激活后,小胶质细胞TLR4蛋白表达增加,细胞核中NF-κB蛋白表达明显上升,胞浆中NF-κB表达下降,而大黄酚处理则可以减少LPS诱导的TLR4蛋白表达,抑制NF-κB向由细胞质向细胞核内转位。由此可知,TLR4/NF-κB通路可能是大黄酚拮抗小胶质细胞炎症反应的机制之一。
综上所述,本研究结果提示大黄酚可拮抗LPS诱导的小胶质细胞炎症介质的释放,促进小胶质细胞M1型向M2型的转化,而TLR4/NF-κB信号通路可能作为调控小胶质细胞表型转换的新靶点,为开发大黄酚作为一种新的脑血管保护药物提供实验依据。
参考文献:
[1]Randolph SA.Ischemic Stroke[J].Workplace Health Saf,2016,64(9):444.
[2]Jin WN,Shi SX,Li Z,et al.Depletion of microglia exacerbates postischemic inflammation and brain injury[J].J Cereb Blood Flow Metab,2017,37(6):2224-2236.
[3]Surinkaew P,Sawaddiruk P,Apaijai N,et al.Role of microglia under cardiac and cerebral ischemia/reperfusion(I/R)injury[J].Metabolic Brain Disease.2018,33(4):1019-1030.
[4]Qin C,Zhou LQ,Ma XT,et al.Dual Functions of Microglia in Ischemic Stroke[J].Neurosci Bull,2019,35(5):921-933.
[5]Anttila JE,Whitaker KW,Wires ES,et al.Role of microglia in ischemic focal stroke and recovery:focus on Toll-like receptors[J].Prog Neuropsychopharmacol Biol Psychiatry,2017,79(Pt A):3-14.
[6]Leitner GR,Wenzel TJ,Marshall N,et al.Targeting toll-like receptor 4 to modulate neuroinflammation in central nervous system disorders[J].Expert Opin Ther Targets,2019,23(10):865-882.
[7]Li RR,Liu XF,Feng SX,et al.Pharmacodynamics of Five Anthraquinones(Aloe-emodin,Emodin,Rhein,Chysophanol,and Physcion)and Reciprocal Pharmacokinetic Interaction in Rats with Cerebral Ischemia[J].Molecules,2019,24(10):1898.
[8]Xie L,Tang H,Song J,et al.Chrysophanol:a review of its pharmacology,toxicity and pharmacokinetics[J].J Pharm Pharmacol,2019,71(10):1475-1487.
[9]Yuan Y,Fang M,Wu CY,et al.Scutellarin as a Potential Therapeutic Agent for Microglia-Mediated Neuroinflammation in Cerebral Ischemia[J].Neuromolecular Med,2016,18(3):264-273.
[10]Hickman S,Izzy S,Sen P,et al.Microglia in neurodegeneration[J].Nat Neurosci,2018,21(10):1359-1369.
[11]Zhao SC,Ma LS,Chu ZH,et al.Regulation of microglial activation in stroke[J].Acta Pharmacol Sin,2017,38(4):445-458.
[12]Kaur C,Rathnasamy G,Ling EA.Biology of Microglia in the Developing Brain[J].J Neuropathol Exp Neurol,2017,76(9):736-753.
[13]Tang Y,Le W.Differential Roles of M1 and M2 Microglia in Neurodegenerative Diseases[J].Mol Neurobiol,2016,53(2):1181-1194.
[14]Bruno K,Woller SA,Miller YI,et al.Targeting toll-like receptor-4(TLR4)-an emerging therapeutic target for persistent pain states[J].Pain,2018,159(10):1908-1915.
[15]Huang Z,Zhou T,Sun X,et al.Necroptosis in microglia contributes to neuroinflammation and retinal degeneration through TLR4 activation[J].Cell Death Differ,2018,25(1):180-189.
收稿日期:2020-06-21;修回日期:2020-06-30
編辑/肖婷婷
