牛冠状病毒TaqMan 荧光定量RT-PCR 检测方法的建立及初步应用
2020-11-10何琪富
谭 烁,汤 承,何琪富,岳 华,2*
(1.西南民族大学生命科学与技术学院,四川 成都 610041;2.国家现代农业产业技术体系四川省兽药创新团队,四川 成都 610041)
牛冠状病毒(Bovinecoronavirus,BCoV)能够引起新生犊牛腹泻、成年牛冬季痢疾和呼吸道疾病,该病毒在世界范围内流行,给养牛业造成了重大的经济损失[1]。除了感染牛以外,BCoV 还可以跨种间传播给野生反刍动物,包括长颈鹿、羊驼、驯鹿、白尾鹿、羚羊、麋鹿和水鹿[2]。BCoV 有着重要的公共卫生学意义,德国研究人员从儿童的腹泻样品中分离出一株冠状病毒(Coronavirus,CoVs),其基因组与BCoVs 的关系比与人类(H)CoVs 的遗传关系更近,表明该病毒株可能起源于BCoV[3]。
PCR 技术是病原检测的“金标准”,对疫病的诊断和流行病学调查具有重要意义[4]。目前国内外报道的检测BCoV 的RT-PCR 方法有很多[5-11],所采用的靶基因主要选用N 基因[5-7,9-11],也有选择M 基因[8]以及聚合酶基因[10],这些基因相对BCoV 的其它基因较保守。虽然BCoV N 基因相对保守,但其仍然存在序列变异的情况[10]。本实验对GenBank 中登录的136 条BCoV N 基因序列以及128 条BCoV M 基因序列进行了变异位点的统计,结果表明N 基因和M 基因的核苷酸变异率分别为14.4%和12.3%,并且这些核苷酸变异可发生在部分检测引物靶向的区域[5-9,11],有可能导致检测方法的效果不佳。因此,进一步验证和改善BCoV 的RT-PCR 检测方法对BCoV 的流行病学调查具有重要意义。
CoVs 的ORF1a 编码的聚合酶基因保守性较高,可用作检测人和动物CoVs 的RT-PCR 方法的分子检测靶点[10,12],且ORF1a 区域是WHO 推荐用于诊断中东呼吸综合征的常用检测区域[13]。本实验室前期采用该聚合酶基因设计引物并建立了检测BCoV 的RT-PCR 方法,显示出良好的特异性、稳定性和灵敏度,证明该基因有作为BCoV 分子检测靶点的潜力[10]。但目前还未见到采用该聚合酶基因作为靶标检测BCoV 的荧光定量RT-PCR 方法的报道。因此,本实验在充分分析了BCoV 常用分子检测靶基因:N基因、M基因、聚合酶基因核苷酸序列变异频率基础上,选用聚合酶基因nsp10 作为检测靶点,建立检测BCoV 的TaqMan 荧光定量RT-PCR 方法,并应用该方法对新疆及辽宁的犊牛腹泻样品进行BCoV 的检测,丰富了国内BCoV的病原流行病学资料。
1 材料与方法
1.1 病毒株、菌株及临床样品 BCoV 分离株、牛轮状病毒(Bovine rotavirus, BRV)、牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)、牛星状病毒(Bovine astrovirus,BAstV)、牛细小病毒(Bovine parvovirus,BPV)、牛纽布病毒(Bovine nebovirus,BoNeV)、牛库布病毒(Bovine kobuvirus,BKV)、牛诺如病毒(Bovine norovirus,BNoV)、牛肠道病毒(Bovine enterovirus,BEV)、牛源K99 大肠杆菌、牛源都柏林沙门氏菌、牛源产气荚膜梭菌、牛源空肠弯曲杆菌、牛源艾美尔球虫、牛源安氏隐孢子虫的核酸样品由本实验室保存。
用于符合率比较的腹泻样品:56 份3 月龄以内奶犊牛腹泻粪便样品,于2017 年采自四川省4 个养殖场;20 份3 月龄以内牦牛腹泻粪便样品于2015 年采自四川省红原县。用于临床样品检测的腹泻粪便样品:153 份3 月龄以内奶犊牛腹泻粪便样品,于2018 年8 月~2018 年12 月采集自新疆和辽宁的16 个牧场,其中新疆10 个牧场86 份,辽宁6 个牧场67份。所有样品均于-80 ℃保存备用。
1.2 主要试剂 Prime Script 试剂盒、TRIzol Reagent试剂盒、Premix ExTaq、pMD19-T 载体等购自TaKa⁃Ra 公司;质粒提取试剂盒、DH5ɑ 感受态细胞购自宝生物工程(大连)有限公司;AXYprepTMDNA 胶回收试剂盒购自Axygen 公司;DNA Marker 购自赛默飞公司。
1.3 引物的设计与合成 根据GenBank 登录的BCoV(U00735.2,包括BCoV-like)聚合酶基因nsp10核苷酸序列,选择保守序列设计特异性检测引物和探针,引物序列:nsp10-F:5'-AGTAGTGTCAGTGC⁃TAAC-3'/nsp10-R:5'-CAAGTGCCTGTAGGTATA-3',探针序列:nsp10-P:5'-FAM-ACAACTTCCATCC CGCCAAA-TAMRA-3',扩增目的片段长度为114 bp,位于BCoV 基因组13 198 bp~13 311 bp 处。引物及探针由上海生工生物工程技术服务有限公司合成。
1.4 重组质粒标准品的构建与鉴定 利用TRIzol 试剂盒提取BCoV YAK/HY24/CH/2017 分离株的总RNA并反转录为cDNA,以其为模板,利用引物nsp10-F/nsp10-R 进行RT-PCR 扩增。PCR 产物经回收纯化后克隆至pMD19-T 载体,构建的重组质粒经菌液PCR鉴定,阳性重组质粒由上海生工生物工程技术服务有限公司测序,测序正确的重组质粒作为标准品。利用核酸蛋白检测仪检测重组质粒标准品浓度,利用以下公式计算拷贝数,拷贝数=质粒浓度×10-9×6.02×1023/(660×质粒总长度)。
1.5 反应体系及条件的优化 利用20 μL 反应体系(Probe qPCR Premix ExTaq10 μL,探针0.4 μL,上下 游 引 物 各0.8 μL,模 板2 μL,ddH2O 补 足 至20 μL),采用方阵试验对退火温度(45 ℃~55 ℃)优化,通过对扩增曲线与Ct 值结合分析确定最佳退火温度;再以优化的退火温度对浓度为10 μmol/L 的引物用量(0.5 μL~1.5 μL)及10 μmol/L 的探针用量(0.1 μL~1 μL)进行优化。
1.6 标准曲线的建立 将BCoV 重组质粒标准品10倍倍比稀释(101~1010)后作为模板,采用建立的方法进行检测,建立标准曲线。
1.7 特异性试验 以本实验室保存的BRV、BVDV、BAstV、 BoNeV、 BKV、 BNoV、 BEV 的cDNA 及BPV、牛源K99 大肠杆菌、牛源都柏林沙门氏菌、牛源产气荚膜梭菌、牛源空肠弯曲杆菌、牛源艾美尔球虫、牛源安氏隐孢子虫的基因组DNA 为模板,以BCoV 重组质粒标准品(3.36×106拷贝/μL)为阳性对照,ddH2O 为阴性对照,利用所建立的TaqMan 荧光定量RT-PCR 进行扩增,评价该方法的特异性。
1.8 敏感性试验 以10 倍倍比稀释的重组质粒标准品(3.36×101拷贝/μL~3.36×1010拷贝/μL)为模板并设置ddH2O 为阴性对照,按照建立的TaqMan 荧光定量RT-PCR 进行扩增,每个稀释度做3 个平行,并与文献[8]建立的TaqMan 荧光定量RT-PCR 进行敏感性比较。
1.9 重复性试验 利用本研究建立的RT-PCR 检测方法对3.36×104拷贝/μL、3.36×106拷贝/μL、3.36×108拷贝/μL 3 个稀释度的BCoV 重组质粒标准品进行批内重复性试验,每个浓度重复3 次;取上述重组质粒标准品为模板,在3 个不同的时间采用该方法进行批间重复性试验。评估该方法的重复性。
1.10 两种TaqMan 荧光定量RT-PCR 符合率的比较试验 56 份奶牛和20 份牦牛腹泻粪便样品经常规处理,按照1.4 方法提取RNA 并反转录为cDNA,采用本实验所建立的方法和文献[8]报道的TaqMan 荧光定量RT-PCR 进行检测,比较两者的检测结果,全部阳性PCR 产物由上海生工生物工程技术服务有限公司公司测序,并使用二分类结果诊断试验符合率计算方法[14]计算二者结果的符合率。
1.11 临床样品的检测 153 份犊牛腹泻粪便样品各取1 g,分别与已灭菌的PBS(pH 7.4)5 mL 制成悬液,充分涡旋,反复冻融3 次后4 ℃3 000 r/min 离心10 min,取上清液4 ℃12 000 r/min 离心30 min,取上清液,提取总RNA,反转录为cDNA,以其为模板,利用本实验建立的TaqMan 荧光定量RT-PCR 方法进行BCoV 的病原检测。随机挑选20%检测结果为阳性的样品由上海生工生物工程技术服务有限公司测序,以进一步验证所建立方法检出结果的准确性。
2 结 果
2.1 目的基因的扩增及重组质粒的鉴定 以BCoV cDNA 为模板,利用特异性引物nsp10-F/R 进行PCR扩增,琼脂糖凝胶电泳检测,获得约100 bp 的片段,与目的片段大小相符(图略)。PCR 产物经纯化回收后构建重组质粒,经PCR 鉴定正确后经测序,结果显示插入片段与BCoV nsp10 基因片段同源性为100%,表明正确构建了重组质粒。经核酸蛋白检测仪测得重组质粒浓度为100 ng/μL,计算其拷贝数为3.36×1010拷贝/μL。
2.2 荧光定量RT-PCR 反应条件的优化结果 经方阵试验优化,荧光定量RT-PCR 的反应体系及条件如下:Probe qPCR Premix ExTaq10 μL,探针0.4 μL(10 μmol/L),上下游引物各0.8 μL(10 μmol/L),模板2 μL,ddH2O 补足到20 μL。反应程序为:95 ℃2 min;95 ℃15 s、54 ℃20 s,40 个循环。
2.3 标准曲线的建立 将重组质粒标准品10 倍倍比稀释成3.36×100拷贝/μL~3.36×109拷贝/μL 后,作为模板进行扩增,获得TaqMan荧光定量RT-PCR的标准曲线。标准曲线为y=-3.115x+37.636,R2=0.9996,E=109%(图1)。表明,质粒标准品在3.36×101拷贝/μL~3.36×109拷贝/μL 与Ct 值呈现良好的线性关系。

图1 BCoV 荧光定量RT-PCR 方法的标准曲线Fig. 1 Standard curve of real-time RT-PCR for BCoV
2.4 特异性试验结果 采用建立的荧光定量PCR 方法对BCoV 的重组质粒标准品及其它牛常见病毒和细菌病病原的核酸进行检测。结果显示,该方法仅对BCoV 的重组质粒标准品扩增结果为阳性,对其它病原的核酸扩增结果均为阴性(图2)。表明本实验建立的方法的特异性较强。

图2 特异性试验结果Fig. 2 The specificity test of the real-time RT-PCR
2.5 敏感性试验结果 分别以10 倍倍比稀释的质粒标准品(3.36×109拷贝/μL~3.36×100拷贝/μL)为模板,同时设置ddH2O 为阴性对照进行TaqMan 荧光定量RT-PCR 扩增。结果显示本研究建立的方法对重组质粒标准品的检测下限为33.6 拷贝/μL(图3),与文献[8]报道的方法的检测下限相同,敏感性在同一数量级别,表明本研究所建立方法的敏感性较高。
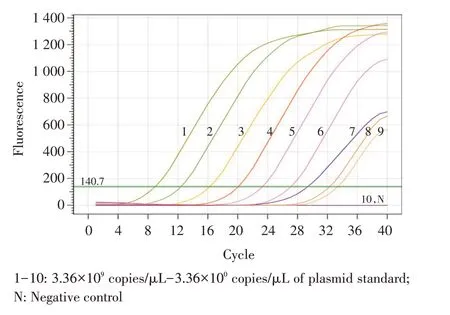
图3 敏感性试验结果Fig. 3 The sensitivity test of the real-time RT-PCR
2.6 重复性试验结果 利用3 个稀释度的重组质粒标准品进行批内和批间的重复性试验,结果显示,本研究建立的TaqMan 荧光定量RT-PCR 检测方法的批内和批间的变异系数均低于5%(表1)。表明该方法具有良好的重复性。

表1 TaqMan 荧光定量RT-PCR 的重复性(n=3)Table 1 Reproducibility analysis of the TaqMan-based real-time RT-PCR(n=3)
2.7 两种TaqMan 荧光定量RT-PCR 符合率的比较试验结果 利用两种TaqMan 荧光定量RT-PCR 对56 份奶牛的粪便样品检出率分别为33.9%和14.3%,阳性符合率为80.4%;20 份牦牛粪便样品的检出率分别为50%和10%,阳性符合率为60%(表2)。测序结果显示本研究建立的方法检出的全部阳性样品均为BCoV 目的片段,且检出的阳性样品包括了另一种方法所检出的全部阳性样品,表明本实验建立方法准确性更高。
2.8 临床样品的检测结果 利用本研究建立的Taq⁃Man 荧光定量RT-PCR 方法检测153 份犊牛腹泻粪便样品,结果显示BCoV 的检出率为71.24%(109/153),场阳性率为100%(16/16)(表3)。随机挑选的22 份阳性样品经测序进一步验证,结果显示均为BCoV 目的片段。表明本研究建立的TaqMan 荧光定量RT-PCR 方法可以用于临床样品的检测。

表2 两种TaqMan 荧光定量RT-PCR 方法的检测结果Table 2 Detection results of two kinds of TaqMan-based real-time RT-PCR

表3 临床样本中BCoV 的检测结果Table 3 Detection results of BCoV in clinical samples
3 讨 论
BCoV 能够引起新生犊牛腹泻、成年牛冬季痢疾和呼吸道疾病,该病毒在世界范围内流行,是危害养牛业的重要病毒病之一[1]。犊牛腹泻病因复杂,BCoV 引起的犊牛腹泻和其它病原引起的腹泻临床症状相似,往往需要实验室检测才能确诊。荧光定量PCR 技术具有灵敏度高并可定量检测等特点,广泛用于病原微生物的实验室检测。本实验选择BCoV 保守的nsp10 为检测靶基因设计引物,建立了检测BCoV 的TaqMan 荧光定量RT-PCR 方法,该方法特异性和重复性好,检测下限为33.6 拷贝/μL,为BCoV的检测和流行病学调查提供了有力的手段。
目前已报道的用于检测BCoV 的荧光定量RTPCR 方法有4 种[7-9,11],包括两种染料法和两种探针法。探针法和染料法相比,特异性更强,只对特异扩增片段产生荧光信号[15]。本研究所建立的BCoV 检测方法对临床样品的检出效果明显优于目前国外唯一报道的TaqMan 荧光定量RT-PCR 方法,检测结果的差别可能是两种方法选择的靶基因不同所致。利用PCR 技术进行病原学检测时,设计的引物能否与被检测靶基因完全匹配对检测结果影响很大。通过对文献[8]方法的检测靶基因(M 基因)序列分析后发现,该靶基因与GenBank 中2020 年3 月前登录的63/128 条BCoV 的M 基因序列不匹配;进一步分析发现,62/63 条不匹配序列是2008 年以后登录GenBank的,晚于该方法文献报道的时间。因此,BCoV 的M基因核苷酸序列变异,可能是导致该方法对当前流行株检测效果不好的原因。进一步分析文献报道的两种检测BCoV 的染料法荧光定量RT-PCR 和另外一种检测BCoV 的探针荧光定量RT-PCR 的引物[7,9,11],均存在不同程度的与靶基因不完全匹配的现象,可能影响其扩增效率。前期的研究表明,不同地区和不同时间流行的BCoV 株,可能存在一定程度的核苷酸序列变异[16],而我国BCoV 流行株具有独特的进化趋势[17]。因此,有必要进一步监测BCoV 流行株分子检测靶基因的遗传变异情况,验证和改进BCoV 的RT-PCR 检测方法,以提高BCoV 检测和病原流行病学调查结果的准确性。
本研究对新疆和辽宁16 个奶牛场153 份奶牛腹泻粪便样品进行了BCoV 的检测,BCoV 平均阳性率为71.24%,场阳性率达100%,提示BCoV 可能是导致当前两省区犊牛腹泻的重要原因。结合前期的研究表明国内BCoV 感染普遍,有广泛的地域分布,是国内犊牛腹泻的重要病原[11,17-18]。值得注意的是,引起犊牛腹泻的病原很多,BCoV 与其它病原的混合感染现象普遍[11,19],因此,进一步开展犊牛腹泻的多病原混合感染调查,对国内犊牛腹泻的防控具有重要意义。
