A 型塞尼卡病毒与O 型、亚洲I 型、A 型口蹄疫病毒多重RT-PCR 检测方法的建立
2020-11-10谢守玉刘惠心施开创屈素洁尹彦文王树培陆文俊冯淑萍粟艳琼
谢守玉,刘惠心,施开创*,赵 晶,屈素洁,尹彦文,王树培,陆文俊,冯淑萍,粟艳琼
(1.广西动物疫病预防控制中心,广西 南宁 530001;2.广西大学动物科学技术学院,广西 南宁 530005)
A 型塞尼卡病毒(Senecavirus A,SVA),曾用名塞尼卡谷病毒(SenacaVally virus,SVV),是小RNA病毒科塞尼卡病毒属的唯一成员[1]。2002 年,首次在细胞培养基中发现SVA,最初被认为是来源于猪胰蛋白酶或胎牛血清的污染物。直至2007 年,加拿大首次报道SVA 可导致猪发生原发性水疱病(Por⁃cine idiopathic vesicular disease,PIVD)[2]。2012 年美国首次报道该病[3],但SVA 在美国猪群的存在最早可追溯至1988 年[4]。随后,巴西、中国、哥伦比亚、泰国、越南等国家相继报道SVA 感染猪群发病[5-9]。在我国广东省2015 年首次报道[6]之后相继在湖北、黑龙江、福建及河南等多个省份暴发由SVA 感染引起的PIVD[10-12]。
SVA 能够感染不同年龄段的猪[13]。成年猪感染初期表现为厌食、嗜睡及发热等症状,随后在吻部、口腔、舌面和蹄部产生水疱,继而水疱破裂发生溃疡,造成蹄壳脱落致使病猪跛行。SVA 发病率因不同生长阶段的猪群而异,断奶仔猪的发病率为0.5%~5%,育肥猪及后备猪的发病率为5%~30%,而新生仔猪的发病率可高达70%、死亡率可达15%~30%[14-15]。SVA 感染的临床症状与猪口蹄疫(Footand-mouth disease,FMD)极为相似,难以区分,需要实验室鉴别诊断。当前,国内外已有学者建立了针对SVA 和/或FMD 病毒(FMDV)的多重RT-PCR 鉴别检测方法。张彦婷等、李金海等建立了O 型、A型及亚洲I 型FMDV 多重RT-PCR 检测方法[16-17],黄元等建立了小反刍兽疫病毒(PPRV)、A 型和O 型FMDV 多重RT-PCR 检测方法[18],刘涛等建立了SVA和FMDV 双重RT-PCR 检测方法[19]。然而,迄今尚未见能够同时检测并区分SVA 与O 型、亚洲I 型、A型FMDV 多重RT-PCR 的报道。本研究首次建立了鉴别检测SVA 与O 型、亚洲I 型、A 型FMDV 的多重RT-PCR 方法,为快速鉴别检测SVA 和FMDV 提供了有效的技术手段。
1 材料与方法
1.1 病毒株及临床样品 SVA 分离株(GD 株)由扬州大学惠赠;FMDV O 型疫苗株(OS 株)、亚洲I 型疫苗株(JSL 株)、A 型疫苗株(AF/72 株)购自中农威特公司。猪瘟病毒(CSFV)疫苗株(C 株)、猪繁殖与呼吸综合征病毒(PRRSV)疫苗株(TJM-F92 株)、伪狂犬病病毒(PRV)疫苗株(Bartha-K61 株)、猪圆环病毒2 型(PCV2)疫苗株(SX07 株)、PCV3 分离株(GX18 株)、猪细小病毒(PPV)疫苗株(N 株)均由本实验室保存。30 份疑似临床样品(每头病猪包括淋巴结、水疱液、痂皮等)采集自2019 年广西各地猪场疑似病猪。
1.2 主要试剂 MiniBEST Viral RNA/DNA Extraction Kit Ver. 5.0、PrimeScriptⅡ1st strand cDNA Synthesis Kit、TksGflexTMDNA Polymerase、MiniBEST Agarose Gel DNA Extraction Kit Ver. 4.0、pMD18-T 载体、E. coliDH5α 感受态细胞、Mini Plasmid Kit、EcoR I 及Hind Ⅲ内切酶均购自宝生物工程(大连)有限公司。
1.3 引物设计 根据GenBank 登录的SVA(NC_011349)、O 型FMDV(KR401154)、亚洲I 型FMDV(KR073010)及A 型FMDV(KT968663)参考株基因序列,设计特异性引物(表1),分别用于扩增SVA 3D基因以及O 型、亚洲I 型、A 型FMDV VP1 基因。
1.4 重组质粒标准品的制备 根据SVA 参考株(NC_011349)3D 基因序列,人工合成157 bp 目的基因片段,以其为模板,以SVA-F/SVA-R 引物,PCR扩增目的片段;取O 型、亚洲I 型、A 型FMDV 疫苗株病毒液200 μL,采用病毒核酸提取试剂盒分别提取总RNA,将其反转录为cDNA,分别作为模板,采用表1 中相应的特异性引物,PCR 扩增目的片段。使用胶回收试剂盒分别回收、纯化PCR 产物,连接至pMD18-T 载体、转化E. coliDH5α 感受态细胞,筛选阳性菌落并扩大培养后,抽提质粒,进行PCR、酶切及测序鉴定。鉴定正确的相应重组质粒作为标准品。测定4 种质粒标准品的浓度后,分别将其换算为拷贝数。
1.5 多重RT-PCR 反应条件的优化 建立25 μL 反应体系:2×PremixTaqTM12.5 μL,4对特异性上、下游引物各0.5 μL,4 种重组质粒标准品等比例混合物2.5 μL,灭菌双蒸水6 μL。采用方阵法对多重RTPCR 反应的退火温度(53.0 ℃、53.2 ℃、53.6 ℃、54.2 ℃、54.9 ℃、55.6 ℃、56.4 ℃、57.1 ℃、57.8 ℃、58.4 ℃、58.8 ℃、59.0 ℃)、引物浓度(终浓度为0.20 pmol/μL、0.25 pmol/μL、0.30 pmol/μL、0.35 pmol/μL、0.40 pmol/μL、0.45 pmol/μL、0.50 pmol/μL、0.55 pmol/μL、0.60 pmol/μL)及循环数(25、30、35、40、45 个循环)等反应条件进行优化。

表1 本研究所使用的引物序列Table 1 Primers used in this study
1.6 特异性试验 取SVA、FMDV(O 型、亚洲I型、A 型)、CSFV、PRRSV 及PEDV 病毒液,采用病毒核酸提取试剂盒分别抽提总RNA,反转录为cD⁃NA;取PRV、PPV、PCV2 及PCV3 病毒液,采用病毒核酸提取试剂盒抽提总DNA。分别以上述cDNA和DNA 为模板,以4 种重组质粒标准品混合物为阳性对照、灭菌双蒸水为阴性对照,按照已优化的多重RT-PCR 反应条件进行PCR 扩增,进行该方法的特异性试验。
1.7 敏感性试验 分别将重组质粒标准品pSVA-3D、pO-VP1、pAsia I-VP1 及pA-VP1 10 倍倍比稀释成终浓度为2.5×108拷贝/μL~2.5×100拷贝/μL,进行单一PCR 扩增;将4种重组质粒标准品等比例混合后10倍倍比稀释,使其终浓度均为2.5×108拷贝/μL~2.5×100拷贝/μL,按照已优化的反应条件进行多重PCR 扩增,对比两种方法的扩增结果,评估本实验建立的多重RT-PCR 方法的敏感性。
1.8 重复性试验 将4种重组质粒标准品等比例混合后10 倍倍比稀释,使其终浓度均为2.5×107拷贝/μL,按照已优化的反应条件经多重RT-PCR 扩增,进行重复性试验。批内试验,每个试验重复5 次;批间试验做5 次,每次间隔1 周。比较批内批间试验检测结果,评估本实验建立的多重RT-PCR 方法的重复性。
1.9 多重RT-PCR 方法的临床应用 取30 份临床疑似样品,用灭菌剪刀将临床组织样品剪至小块状,连同水疱液,放入含有适量(W/V,1 4)pH 7.2 PBS 溶液的灭菌离心管中,反复冻融3 次,研磨至糜状后12 000×g 离心3 min,取200 μL 上清抽提总RNA,利用反转录试剂盒反转录为cDNA 作为模板。利用所建立的多重RT-PCR 方法检测SVA 以及O 型、亚洲I 型、A 型FMDV。同时,按照国家标准《口蹄疫诊断技术》(GB/T18935-2003)中的RT-PCR方法分别对O型、亚洲I型、A型FMDV进行检测,按照Feronato 等报道的SVA 套式RT-PCR 方法[20]对SVA进行检测,比较两种方法对相同病料样品的检测结果,计算二者的符合率。随机选取其中3 份阳性样品,回收PCR 产物、连接pMD-18T 载体、转化DH5α 感受态细胞,阳性克隆增菌培养后提取质粒进行测序、比对。
2 结 果
2.1 重组质粒标准品的鉴定结果 以人工合成的SVA 目的片段,以及O 型、亚洲I 型、A 型FMDV 疫苗株的cDNA 为模板,利用特异性引物进行PCR 扩增,获得SVA 157 bp 的3D 基因(图1 A)、O 型FMDV 240 bp 的VP1 基因(图1 B)、亚洲I 型FMDV 460 bp 的VP1 基因(图1 C)及A 型FMDV 320 bp 的VP1 基因目的片段(图1 D)。经回收PCR 产物后连接pMD18-T载体,转化DH5α 感受态细胞,阳性克隆增菌培养后提取质粒。经PCR、酶切及测序鉴定正确后,获得的重组质粒分别命名为pSVA-3D、pO-VP1、pA⁃sia I-VP1 及pA-VP1,作为质粒标准品。

图1 重组质粒pSVA-3D(A)、pO-VP1(B)、pAsia I-VP1(C)及pA-VP1(D)的酶切鉴定结果Fig. 1 Identification of recombinant plasmids pSVA-3D(A),pO-VP1(B), pAsia I-VP1(C) and pA-VP1(D)
2.2 多重RT-PCR 方法各条件的优化结果 经优化退火温度、引物浓度、反应循环数等反应条件,确立多重RT-PCR 反应的最佳退火温度为58.4 ℃;SVA 及O 型、亚洲I 型、A 型FMDV 特异性上、下游引物最佳终浓度分别为0.3 pmol/μL、0.3 pmol/μL、0.25 pmol/μL、0.25 pmol/μL;最佳扩增循环数为40 个。以引物浓度为例的优化结果见图2。
建立25 μL 反应体系:2×PremixTaqTM12.5 μL,SVA、O 型FMDV 特异性上、下游引物(10 pmol/μL)各0.75 μL,亚 洲I 型、A 型FMDV 上、下 游 引 物(10 pmol/μL)各0.625 μL,模板2.5 μL,灭菌双蒸水4.5 μL。PCR 扩 增 程 序:94 ℃3 min;94 ℃30 s,58.4 ℃30 s,72 ℃30 s,40个循环;72 ℃10 min。
2.3 特异性试验结果 分别以重组质粒标准品pS⁃VA-3D、pO-VP1、pAsia I-VP1、pA-VP1 混合物,O型、亚洲I 型、A 型FMDV、SVA、CSFV、PRRSV、PEDV 的cDNA,以及PRV、PPV、PCV2、PCV3 的DNA 为模板,进行多重RT-PCR。结果显示,仅4种重组质粒标准品混合物以及O 型、亚洲I 型、A型FMDV、SVA 的cDNA 扩增出目的条带,其他病毒均未扩增出条带(图3),表明该多重RT-PCR 特异性较强。

图2 多重RT-PCR 引物浓度的优化结果Fig. 2 Optimization for primer concentrations of the multiplex RT-PCR

图3 多重RT-PCR 特异性试验结果Fig. 3 Specificity test of the multiplex RT-PCR
2.4 敏感性试验结果 分别将重组质粒标准品pS⁃VA-3D、pO-VP1、pAsia I-VP1 及pA-VP1 10 倍倍比稀释成终浓度为2.5×108拷贝/μL~2.5×100拷贝/μL,进行单一PCR 和多重RT-PCR 反应。结果显示,单一PCR 检测pSVA-3D、pO-VP1、pAsia I-VP1、pA-VP1重组质粒标准品的检出下限均为2.5×101拷贝/μL(图4A),多重RT-PCR 检测这4 种重组质粒标准品的检出下限均为2.5×102拷贝/μL(图4B)。表明所建立的多重RT-PCR 的敏感性较高。
2.5 重复性试验结果 随机选取终浓度均为2.5×107拷贝/μL 的4 种重组质粒标准品混合物作为模板,以相同的条件进行多重PCR 的批内和批间重复性试验,结果显示,批内和批间重复性试验均能扩增出均匀一致的目的条带(图5),表明该方法重复性较好。

图5 多重RT-PCR 重复性试验结果Fig. 5 Repeatability test of the multiplex RT-PCR
2.6 多重RT-PCR 方法的临床应用结果 利用所建立的多重RT-PCR 方法,对30 份临床疑似样品进行检测,结果显示,SVA 阳性样品5 份,阳性率为16.67%;O 型FMDV 阳性样品19 份,阳性率为63.33%;未检出亚洲I 型及A 型FMDV。部分临床样品检测结果见图6。同时,按照口蹄疫诊断技术国家标准中的RT-PCR 方法分别对O 型、亚洲I 型、A型FMDV 进行检测,按照文献报道的SVA 套式RTPCR 方法[20]对SVA 进行检测,结果与本研究建立的多重RT-PCR 方法检测结果的符合率为100%。对随机选取的3 份阳性样品PCR 产物进行测序比对,结果证实均为相应病毒的基因片段。表明本实验建立的多重RT-PCR 方法可用于临床检测。
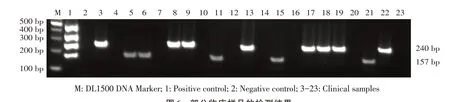
图6 部分临床样品的检测结果Fig. 6 Detection results of partial clinical samples by the multiplex RT-PCR
3 讨 论
由于SVA 与FMDV 感染猪群的临床症状、病理变化极为相似,临床上难以区分,需借助实验室检测才能鉴别诊断[21-22]。多重RT-PCR 具有扩增效率高、速度快、成本低等优点,尤其适合混合感染样品中多种病原的鉴别检测,因而广泛应用于实验室。多重RT-PCR 方法的突出优点是特异性强、敏感性较高、扩增效率高、速度较快、成本低廉,并且通过一个反应即可检测多个目的基因,尤其适合混合感染样品中多种病原的鉴别检测。因此,多重RT-PCR 方法仍是当前我国各级兽医实验室的一种理想选择,因而得到普遍使用,在我国动物疫病的监测、检测、诊断和流行病学调查中发挥不可替代的作用。但是,多重RT-PCR 方法也有局限性,突出问题是多重RT-PCR 方法的敏感性一般会比相应的单一RT-PCR 的敏感性稍低,也比相应的多重荧光定量RT-PCR 方法敏感性低;同时由于需要经凝胶电泳后观察结果,容易污染环境,导致假阳性出现。由于方法本身的局限性,部分病毒含量很低的样品有可能会漏检,部分阴性样品也有出现假阳性的风险,这是利用该方法进行样品检测时需要注意防范的技术风险。随着我国经济发展和科技进步,荧光定量RT-PCR 将更加普及,不断被基层兽医实验室推广并应用。但当前国内外已报道的针对SVA和FMDV 的多重RT-PCR 检测方法均不能同时检测并区分SVA 及O 型、亚洲I 型、A 型FMDV。为此,本研究建立了鉴别检测SVA 和O、A、亚洲I 型FM⁃DV 的多重荧光定量RT-PCR 方法,供有条件的实验室选择使用。
本研究针对SVA 3D 基因的保守区域,O 型、亚洲I 型、A 型FMDV VP1 基因的差异区域,分别设计特异性引物,优化退火温度、引物浓度、扩增循环数等反应条件,建立了SVA 与O 型、亚洲I 型、A 型FMDV 多重RT-PCR 检测方法,实现了在同一个反应体系中同时鉴别检测这些病原的目的。所建立的方法敏感性高,对各质粒标准品的最低检出下限均达到2.5×102拷贝/μL;特异性较强,只能扩增SVA与O 型、亚洲I 型、A 型FMDV,而与其他主要猪源病毒均无交叉反应;重复性好,同一反应条件下均能扩增出均匀一致的目的条带。
利用本研究所建立的方法对2019 年采集自广西各地的30 份临床疑似样品进行检测。结果显示,SVA 检出阳性率为16.67%(5/30),O 型FMDV 检出阳性率为63.33%(19/30),未能检出亚洲I 型及A 型FMDV(0/30)。张志等检测来自辽宁、福建、广西等12个省的临床样品,发现SVA 阳性检出率在2016年~2018 年分别为14.6%、21.9%及22.6%[23];刘健新等检测来自广东省的124 份临床样品,发现SVA 阳性检出率为3.2%[24];以上结果表明,我国猪群存在不同程度的SVA 感染,并且有不断蔓延扩散之势。目前我国主要以O 型FMDV 缅甸98 株流行为主[25]。而亚洲I 型和A 型FMD 也曾在我国暴发和流行。2005年后,山东、江苏、新疆及河北等多地相继暴发牛亚洲I 型FMD 疫情,同时也在病猪中分离和鉴定到亚洲I 型FMDV[26]。最近几年,亚洲I 型FMD 防控在我国取得重大突破,2011 年6 月以来全国未检出亚洲I 型FMDV 病原学阳性样品,已达到全国免疫无疫标准,因此2018 年起亚洲I 型FMD 在我国退出免疫(农业农村部第2635 号公告);但周边一些国家仍时有亚洲I 型FMD 发生[27],在云南采集来自境外流动动物的组织样品中亚洲I 型FMDV 阳性检出率高达5.83%(7/120)[28],国外疫情存在重新传入我国的巨大风险。而A 型FMD 于2013 年在我国茂名市的猪群中首次确认后,在全国迅速蔓延,A 型FMD 在我国猪FMD 疫情中的比例不断攀升[29],仅2013 年我国向OIE报告的A 型FMD 疫情就高达11 起。因此对O 型、亚洲I 型、A 型FMD 的监测和防控仍然不能松懈。本研究针对SVA 与O 型、亚洲I 型、A 型FMDV,首次建立了同时检测并区分上述病原的多重RT-PCR 方法,敏感性高、特异性强、重复性好,为临床上上述病原的鉴别检测及流行病学调查提供有效的技术方法,具有重大的现实意义和应用价值。
