慢性萎缩性胃炎病理改变与幽门螺旋杆菌感染及血清胃蛋白酶原、胃泌素-17的相关性
2020-11-10黄妙灵刘序友
黄妙灵 刘序友
1南方医科大学深圳医院健康管理中心(广东深圳518110);2广州市红十字会医院,暨南大学附属广州红十字会医院消化内科(广州510220)
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)是公认的胃癌前病变[1],其主要特征表现为胃黏膜中腺体萎缩,确诊需结合胃镜和病理诊断[2]。因腺体萎缩常呈灶性分布,病理诊断受活检部位及幽门螺旋杆菌(Hp)感染等因素影响,导致胃镜和病理诊断准确率偏低。血清胃蛋白酶原(pepsinogen,PGI 和PGII)和胃泌素-17(gastrin-17,G-17)表达水平被称为“血清学活检”,可用来筛查胃黏膜萎缩[3]。研究指出,Hp感染是CAG 重要因素之一[4],早期明确是否Hp感染及监测血清PG、G-17 水平对诊断CAG 有重要价值[5],但Hp感染、血清PG、G-17 与CAG 病理改变相关性尚缺乏深入研究。故在此基础上回顾性分析127 例CAG患者内镜检查及Hp感染、血清PG、G-17 检测结果并探讨其相关性,报告如下。
1 资料与方法
1.1 研究对象及资料选择2019年6月至2019年12月间诊断为CAG 患者为研究对象共127例,其中男76 例,女51 例,年龄41 ~68 岁,平均(49.95 ±12.84)岁。同期诊断为慢性非萎缩性胃炎(CNAG)患者为对照组共288 例,其中男157 例,女131 例,年龄36 ~67 岁,平均(47.61 ± 11.36)岁。回顾收集患者基本资料、胃镜、Hp、病理组织活检及胃标志物三项等结果。
1.2 纳入标准和排除标准(1)纳入标准:①年龄18 ~70 岁;②符合《中国慢性胃炎共识意见(2017年,上海)》中的诊断标准[6];③临床资料完整,经医院伦理委员会论证通过并签署知情同意书。(2)排除标准:①胃及十二指肠溃疡、胃癌、胃泌素瘤;②合并心、肺、肝、肾等脏器功能障碍;③近1 个月有使用抗菌药物、胃黏膜保护剂、PPI 制剂;④曾接受胃部切除手术者。
1.3 胃镜检查所有研究对象均行胃镜检查并取活组织进行病理检查。活检部位包括:胃窦距幽门约2 cm 处、胃体距贲门约8 cm 处、胃角;若有可疑病灶则在可疑病灶处再取1 块活组织。Hp检测采用14C 呼气试验,以呼气试验阳性为Hp现症感染。
1.4 ELISA实验清晨采集患者空腹静脉血4 mL,离心后收集血清置于-20 ℃冰箱中。按照ELISA检测说明书进行,检测各组研究对象的血清PG I、PG II、G-17 水平,并计算胃蛋白酶原比值(pepsinogen ratio,PGR=PG I/PG II)[7]。
1.5 统计学分析采用SPSS 22.0 软件进行统计分析,计量资料以表示,两组间比较采用t检验,多组间比较采用方差分析,计数资料以例数和百分数表示,比较采用卡方检验,各指标对萎缩性胃炎诊断效果用灵敏度、特异性和ROC 曲线下面积(AUC)评价。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料按诊断标准及排除标准共纳入CAG 患 者127 例,纳入对照组CNAG 患者288 例,两组性别、年龄差异均无统计学意义(P>0.05),具有可比性,见表1。
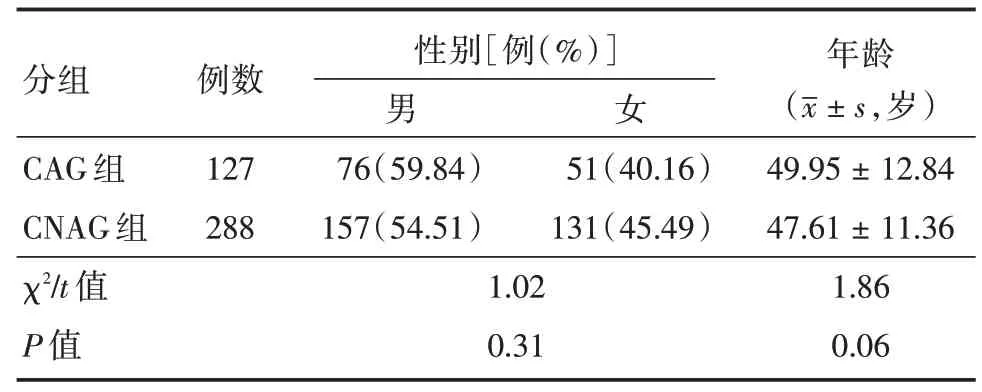
表1 两组患者性别、年龄比较Tab.1 Comparison of the two general data
2.2 两组患者Hp感染情况及血清PGI、PGII、PGR、G-17 水平比较两组共415 例患者中,Hp感染患者254 例,总感染率为61.20%,其中CAG 组感染率明显高于CNAG 组,差异有统计学意义(P<0.05)。两组患者血清PGI、PGII、PGR、G-17水平结果显示,与CNAG 组相比,CAG 组的PGI、PGII、PGR 及G-17 水平均下降,两组比较差异均有统计学意义(P<0.05),见表2。
表2 两组患者Hp 感染情况及血清PGI、PGII、PGR、G-17 水平比较Tab.2 Comparison of Hp,PGI,PGII,PGR and G-17 between the two groups ±s

表2 两组患者Hp 感染情况及血清PGI、PGII、PGR、G-17 水平比较Tab.2 Comparison of Hp,PGI,PGII,PGR and G-17 between the two groups ±s
分组CNAG 组CAG 组χ2/t 值P 值Hp(+)[例(%)]165(57.29)89(70.08)6.07 0.01 PGI(μg/L)131.74±23.27 74.12±15.44 25.53<0.01 PGII(μg/L)18.52±4.08 13.61±3.55 11.74<0.01 PGR 9.43±3.94 6.23±2.93 8.21<0.01 G-17(pmol/L)23.63±9.67 21.26±9.19 2.34 0.02
2.3 不同病理特征与Hp感染的关系127 例CAG患者中根据Hp感染分为阳性组和阴性组,并根据慢性炎症、萎缩、肠上皮化生和上皮内瘤变不同病理特征分级。在Hp感染阳性组中,慢性炎症反应以中度(++)为主,重度(+++)次之;Hp阴性组则以轻、中度炎症为主;两组之间比较差异有统计学意义(P<0.05),即Hp感染阳性组慢性炎症程度较Hp阴性组严重,慢性炎症与Hp感染有关。Hp感染阳性组以中度萎缩为主,Hp阴性组则以轻度萎缩为主;两组比较差异有统计学意义(P<0.05),即Hp感染阳性组萎缩程度较Hp阴性组严重,胃黏膜萎缩与Hp感染有关。CAG 患者肠上皮化生、上皮内瘤变程度在Hp感染阳性组和阴性组中比较,差异均无统计学意义(P>0.05),见表3。
2.4 不同部位萎缩性胃炎与Hp感染情况及血清PGI、PGII、PGR、G-17 水平比较将127 例CAG患者按萎缩部位分3 组:胃窦萎缩组65 例、胃体萎缩组44 例和全胃萎缩组18 例,3 组中以胃窦萎缩组的Hp感染率最高,胃体萎缩组最低,3 组Hp感染阳性率差异有统计学意义(P<0.05)。胃窦萎缩组、胃体萎缩组、全胃萎缩组的血清PGI、PGII、PGR 及G-17 水平比较如下:PGI 在胃窦萎缩组、胃体萎缩组和全胃萎缩组中均降低,以胃体萎缩组降低最明显,全胃萎缩组次之,两两之间比较差异有统计学意义(P<0.05);PGII 在全胃萎缩组中下降明显,胃窦萎缩组与全胃萎缩组、胃体萎缩组与全胃萎缩组比较差异均有统计学意义(P<0.05);PGR 以胃体萎缩组降低最明显,胃窦萎缩组与胃体萎缩组比较,差异有统计学意义(P<0.05);G-17 在胃窦萎缩组中明显下降,而在胃体萎缩组中升高显著,两两之间比较差异有统计学意义(P<0.05),见表4。

表3 CAG 患者中不同病理特征与Hp 感染的关系Tab.3 The relationship between different pathological features and Hp in CAG 例(%)
2.5 不同程度萎缩性胃炎与Hp感染情况及PGI、PGII、PGR、G-17 水平比较将127 例CAG 患者按萎缩程度分3 组:轻度64 例,中度49 例和重度14 例,3 组中以中度萎缩性胃炎组的Hp感染率最高,重度次之,3 组Hp感染阳性率差异有统计学意义(P<0.05)。3组研究对象PGI、PGII、PGR及G-17指标比较,随着胃黏膜萎缩程度加重,PGI、PGII、PGR 及G-17 水平逐渐降低,各指标的两两之间比较差异均有统计学意义(P<0.05),提示胃黏膜萎缩程度越重,PGI、PGII、PGR 及G-17 水平下降越明显,见表5。
表4 不同部位萎缩性胃炎与Hp 感染情况及PGI、PGII、PGR、G-17 水平比较Tab.4 Atrophic gastritis in different parts was compared with Hp,PGI,PGII,PGR and G-17 ±s

表4 不同部位萎缩性胃炎与Hp 感染情况及PGI、PGII、PGR、G-17 水平比较Tab.4 Atrophic gastritis in different parts was compared with Hp,PGI,PGII,PGR and G-17 ±s
注:与胃窦萎缩组比较,aP <0.05;与胃体萎缩组比较,bP <0.05;与全胃萎缩组比较,cP <0.05
分组胃窦萎缩组胃体萎缩组全胃萎缩组F/χ2值P 值例数65 44 18 Hp(+)[例(%)]52(80.00)25(56.82)12(66.67)6.84 0.03 PGI(μg/L)91.13±16.82bc 54.14±12.47ac 61.56±11.44ab 89.98<0.01 PGII(μg/L)14.19±6.14c 15.04±5.32c 8.03±3.07ab 11.00<0.01 PGR 7.22±3.21b 4.94±2.48a 5.81±3.67 7.534<0.01 G-17(pmol/L)14.90±8.74b 31.68±12.02ac 18.76±9.16b 37.21<0.01
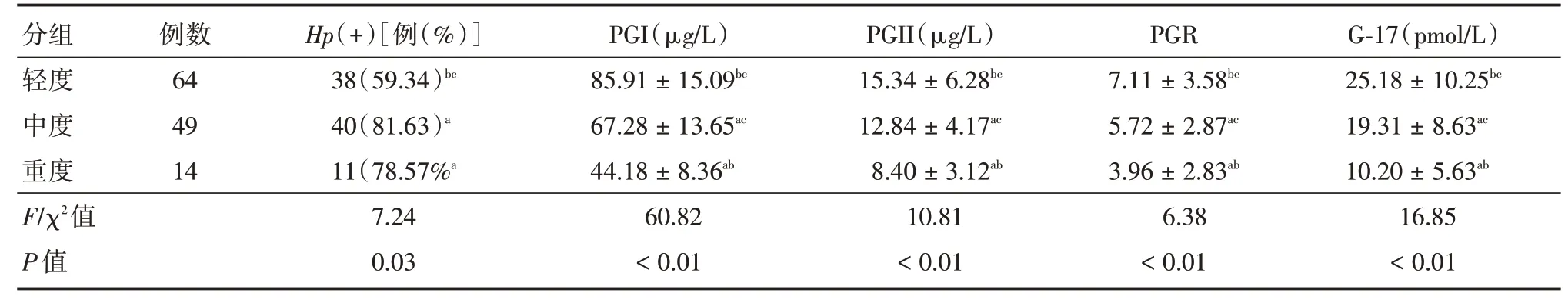
表5 不同程度萎缩性胃炎与Hp 感染情况及PGI、PGII、PGR、G-17 水平比较Tab.5 Different degrees of atrophic gastritis were compared with Hp,PGI,PGII,PGR and G-17例(%)
2.6 血清PGI、PGII、PGR 及G-17 诊断萎缩性胃炎的诊断性能分析以CAG 组为病例组,CNAG 组为对照组分别绘制PGI、PGII、PGR、G-17 的ROC 曲线。AUC 越大,指标对疾病的诊断效能越高,PGI的AUC 值为0.981,具有更高的诊断性能。诊断萎缩性胃炎的PGI、PGII、PGR、G-17 的最佳临界值分别为90.65 μg/L、13.56 μg/L、8.32 和16.98 pmol/L。PGI 诊断萎缩性胃炎的灵敏度最高,为97.57%;PGI 和G-17 诊断萎缩性胃炎的特异度最高,均为87.40%,见表6 及图1。
2.7 血清PGI 诊断不同萎缩部位及不同萎缩程度的萎缩性胃炎的诊断性能分析在CAG 组中分别以不同萎缩部位及萎缩程度分组,绘制PGI 的ROC 曲线。在不同萎缩部位分组中,PGI 诊断胃窦、胃体及全胃萎缩性胃炎AUC 分别为:0.941(0.885 ~0.975)、0.867(0.795 ~0.921)、0.719(0.633~0.795);在不同萎缩程度分组中,PGI 诊断轻度、中度及重度萎缩性胃炎AUC 分别为:0.830(0.754~0.891)、0.661(0.572 ~0.743)、0.953(0.900 ~0.982)。PGI 对胃窦萎缩性胃炎及重度萎缩性胃炎,具有更高的诊断性能(图2)。

表6 血清PGI、PGII、PGR 及G-17 诊断萎缩性胃炎的AUC及最佳临界值Tab.6 The AUC and the optimal critical value of PGI,PGII,PGR and G-17 in the diagnosis of atrophic gastritis

图1 PGI、PGII、PGR 和G-17 诊断萎缩性胃炎的ROC 曲线Fig.1 ROC curves of diagnosis of atrophic gastritis of PGI,PGII,PGR and G-17
3 讨论
Hp感染可通过多种途径损伤胃黏膜,最终导致慢性萎缩性胃炎、胃癌的发生[8-10]。本研究以同期诊断为非萎缩性胃炎作为对照组与萎缩性胃炎患者比较,结果显示,CAG 患者Hp感染的阳性率比CNAG 组高,Hp阳性患者存在慢性炎症及萎缩程度较Hp阴性者严重,不同部位的萎缩性胃炎中,以胃窦萎缩组的Hp感染率最高。表明Hp感染可能促进慢性萎缩性胃炎的发生,Hp感染在CAG 向肠化、异型增生乃至胃恶性肿瘤进展和转变的过程中,起到了推波助澜作用[11-12],是导致CAG 病情加重乃至恶化的主要因素之一。
血清PGI 由胃底(体)腺的主细胞和颈黏液细胞分泌,主要反映胃底黏膜的功能状态,PGⅡ由贲门腺、胃窦幽门腺和十二指肠Brunner 腺分泌,反映全胃黏膜的分泌功能[7,13]。PG 在胃酸作用下活化成胃蛋白酶,若机体胃黏膜发生病变,则会导致胃黏膜细胞及腺体功能异常,PGⅠ和PGⅡ水平也随之改变[14]。G-17 是由胃窦部及十二指肠近端黏膜中G 细胞分泌,可刺激盐酸、胰液和胆汁分泌,主要受胃内pH 值、G 细胞数量和进食(如蛋白质)影响,是反映胃窦分泌功能的敏感指标[15]。本研究中,CAG 组血清PGI、PGII、PGR 及G-17 水平较CNAG 组均显著下降,提示胃黏膜萎缩可影响血清PG 及G-17 水平。由于PG 及G-17 由胃黏膜不同部位分泌,导致不同部位及不同程度的胃黏膜萎缩对血清PG 及G-17 水平有不同的影响。本研究按不同部位及不同程度的胃黏膜萎缩分组,结果显示:胃体萎缩组和全胃萎缩组的PGI、PGII、PGR 水平均低于胃窦萎缩组;胃窦萎缩组和全胃萎缩组G-17 水平低于胃体萎缩组,以胃窦萎缩组下降显著;随着胃黏膜萎缩程度加重,PGI、PGII、PGR 及G-17 水平下降越明显。导致血清PG 及G-17 水平变化的原因分析:当胃体黏膜发生萎缩时,主细胞数量减少或消失,由胃体分泌的PGI 减少,而PGII来源比较广,受胃体黏膜萎缩影响较小,PGII 水平稍下降或不变,导致PGR 下降。因此PGI 及PGR在胃体萎缩时下降明显,PGII在胃窦萎缩或胃体萎缩时轻度下降,而PGI、PGII、PGR 在全胃萎缩中的水平,则取决于胃窦和胃体萎缩所占的比重[16]。随着胃黏膜萎缩程度加重,PGI、PGII 分泌均受影响,导致PGI、PGII及PGR水平均下降,其下降程度与胃黏膜萎缩程度呈正相关。血清G-17 主要由胃窦的G细胞产生,其产生也受胃酸分泌的调节,当胃窦萎缩时,G 细胞数量明显减少,因此分泌的G-17 水平明显降低[17]。当胃体萎缩时,由于PGI及PGR下降,胃酸分泌减少,而G 细胞数量不减少,导致G-17 水平出现反馈性升高。随着胃黏膜的萎缩程度加重,G 细胞数量逐渐减少,G-17 水平逐渐下降[15,18]。在CAG 组中以不同萎缩部位及不同萎缩程度ROC 曲线中显示,PGI 对胃窦萎缩性胃炎及重度萎缩性胃炎,具有更高的诊断性能,故联合PG、PGR 及G-17检测有助于判断胃萎缩部位及其严重程度[13]。

图2 PGI 诊断不同萎缩部位及不同萎缩程度的萎缩性胃炎的ROC 曲线Fig.2 ROC curves of PGI in the diagnosis of atrophic gastritis with different atrophic sites and degrees
所纳入病例诊断萎缩性胃炎的PGI、PGII、PGR、G-17 的最佳临界值分别为90.65、13.56 μg/L、8.32、16.98 pmol/L。单一指标中以PGI 对诊断萎缩性胃炎价值较高。不同研究报道的临界值差异较大,这可能与选取病例中萎缩性胃炎的萎缩部位、程度以及Hp感染等不完全相同导致胃腺体损害及丧失程度不同有关[19],也可能与各地生活习惯及饮食结构差异导致不同人群血清PG 及胃泌素差异有关[20]。
综上所述,联合检测PG、G-17 及Hp能提高萎缩性胃炎的诊断性能,可作为胃镜检查前的第一线萎缩性胃炎普查方式,或通过此方法加强慢性萎缩性胃炎胃镜的随访,有助于对胃黏膜萎缩程度风险分层和早期诊断,从而为胃癌的早期防治提供依据。
