昆虫不育分子研究进展
2020-11-10杨雨航黄新意翁群芳
杨雨航,黄新意,翁群芳
(华南农业大学植物保护学院,广东 广州 510642)
国家质量监督检验检疫总局于2017年发布的《中华人民共和国进境植物检疫性有害生物名录》,包含441种外来检疫物种。外来入侵物种严重损害了经济和生态,时常伴随有疫情暴发,同时危害了人们的安全,如红火蚁(Solenopsis invictaBuren)、新菠萝灰粉蚧(Dysmicoccus neobrevipesBeardsley)[1]。凤梨盾蚧(Diaspis bromeliaeKerner)、杰克贝尔氏粉蚧(Pseudococcus jackbeardsleyiGimpel& Miller)和并蛎蚧(Neopinnaspis harperiMckenzie)是近些年首次入侵传入我国的适应能力极强的代表品种,在短短几年内已经从沿海地区传入我国内陆,对农产品的种植和出口有着巨大的负面影响[2-3]。伴随气候变化加剧,害虫对常用化学杀虫剂的抗药性增加,人们的绿色生态意识不断加强,昆虫不育技术(SIT)因其具有无污染、无抗性、防效持久、专一性强、对人畜和天敌安全等突出优点日益受到重视,已经成为有害生物综合治理(IPM)的重要内容[4-5]。
辐照作为SIT中的常用手段受到广泛研究。辐射处理的雄虫被释放到野外与野生雌性交配,从而阻止它们产生可存活后代的SIT,成功地抑制了某些昆虫种群。60Co-γ射线对靶标生物的作用具有随机性和复杂性,既可能改变染色体结构,也可能导致基因组单个位点发生潜在的未知突变或代谢调控变化等多种路径异常而产生的综合效应[6]。但因其作用靶点的随机性、不确定性导致其难以广泛应用。随着分子技术的日趋成熟、昆虫内部的信号传递网络逐渐探明,其内部微观动态变化过程受到了广泛研究,并通过辐照不育启发了大量有关不育技术的研究。
通过查阅文献发现目前对昆虫不育的研究大多以生态种群的宏观角度进行叙述,对其微观角度的分子研究的论述并不多,同时,总结各个不育技术成果并找到其共同之处,以种群控制角度进行论述的研究极少。特别是在分子技术不断成熟应用在昆虫不育方面时,各种不育技术的原理特点、适用范围、针对对象的生理生态特性及实际使用中的一系列问题等均会对其大范围使用与开发造成挑战,对昆虫不育技术开发亟待解决的研究内容较多,涉及生态环境、种群基因库、技术评价标准及有效分子机制等。本文整理了数十年来昆虫不育技术发展变化和主流的分子遗传防控机理研究,在全球频繁交流、加深合作的背景下,总结前沿的昆虫辐照不育分子研究内容,以防治思路的时间变化为轴,围绕具体技术的原理、防治特征、适用原则及实际应用等方面进行综述,为绿色农业发展提供了思考,为科研工作者提供借鉴。
1 昆虫辐照不育技术的原理及主要方式
1.1 昆虫辐照不育原理
昆虫辐照不育技术是利用射线和中子流对目标昆虫某个虫态进行辐照处理,导致显性致死、当代或后代不能正常生殖,从而实现害虫防治的一种物理方法。昆虫不育的原因有:雌虫不能产卵,雄虫不能产生精子或精子失活,不能交配,雄虫或雌虫生殖细胞产生致死突变。辐照效应与昆虫细胞的分化程度呈反比,与分裂程度呈正比。在细胞分裂的活跃期,如卵的胚胎发育期、羽化前和化蛹后的这些时间段较小的辐照剂量就可以致死的。成虫细胞的分化程度最高,但是性腺细胞却在成虫细胞中处于分裂活跃期,对辐照最敏感,较低的剂量即可使昆虫不育或产生遗传紊乱的配子,这也是不育剂量比致死剂量低得多的原因。同时,辐照剂量必须破坏雄虫精原细胞,防止其恢复生殖能力,永久破坏形成卵所必需的卵原细胞或滋养细胞,辐照的能量传到核酸链上将其打断,使配子染色体断裂、精子畸形,还会引起活性氧上升损害多种细胞途径和过程;产生水自由基损坏细胞结构,加剧蛋白质和脂肪分解代谢[7-9]。然而使用此类方式进行处理的个体,其生活力和交配竞争力等生理指标均明显下降,如棉铃虫在辐照后的飞行距离、成虫寿命较野生种都显著下降[10]。国际原子能机构(www.iaea.org) 的 IDIDAS(International Database on Insect Disinfestation and Sterilization)数据库(https://nucleus.iaea.org/sites/naipc/ididas/Pages/Browse-IDIDAS.aspx)中包含有害虫的致死剂量和不育剂量,在2012年共收录了337种害虫的辐照处理剂量,在2020年3月IDIDAS数据库收录的害虫达到374种,但是这些数据中只有少数种类的昆虫有对应的杀灭剂量和不育剂量。
1.2 完全不育剂量概述及应用
完全不育剂量是指在防治区域内释放亲代不育雄虫(通过高剂量辐照处理,达到当代不育),跟野生雄虫竞争,使整个种群数量下降,达到对特定种类昆虫数量控制的目的。该策略在前期需要大量释放初始不育雄虫控制种群数量,但由于不育只会影响当代,故需要定时释放稳定防治效果[11]。释放不育雄虫与野生型雄虫的初始数量比(释放比)越高,防治效果越好。从图1可以看出,通过长时间释放不育雄虫能达到有针对性地控制昆虫种群的目的。此方式是基于对象昆虫的生理生态特性(雌虫一生交配1次)所选用的,对某些种类的昆虫适用性强且十分有效。但对于难以人工养殖的昆虫,且一生多次交配种类的昆虫并不合适,并且按时释放以稳定防治效果的做法增加了防治成本与难度,这不是一个普遍适用策略。故完全不育剂量限制了昆虫辐照不育技术的推广应用。

图1 完全不育剂量运行图Fig.1 Run chart of completely sterile dose
1.3 亚不育剂量概述及应用
1.3.1 亚不育剂量概述 亚不育剂量是指通过释放低剂量辐照雄虫,在其与野生雌虫交配后会产生F1,而F1为不育昆虫(图2A)。此现象发现于苹果蠹蛾〔Cydia pomonella(L.)〕中,雄虫在低辐照处理下,后代为亚不育或全不育,在辐照下雌虫较雄虫相比表现出更为明显不耐受性[11]。在其他鳞翅目昆虫中也发现了类似现象,相同剂量下出现了雌虫完全不育,雄虫为半不育,且雌蛹羽化率显著低于雄蛹的现象。通过60Co-γ射线以亚不育剂量处理小菜蛾〔Plutella xyllostella(Linnaeus)〕,与对照相比,辐照雄虫的飞行能力、交配能力、对雌虫性信息素的感知能力均无显著差异,F1代生殖力受到影响,其产生的F2代死亡率极高,生活力大幅下降,且释放比为5∶1,大大减少了不育昆虫的释放量,降低了防治成本与人工养殖的难度(图2B)[12]。
与完全不育剂量相比,低剂量增强了辐照雄虫的竞争配偶能力和生殖力,且亚不育剂量可以适用在大部分种类昆虫上。尽管相对于完全不育剂量的生活力和竞争力得到了改善,但是依旧对昆虫造成了伤害。同时,辐照不育技术必须要解决饲养昆虫的雌雄分离问题,相同剂量的辐照只能使少数种类昆虫的雌性个体不育甚至死亡,因此混合释放大大降低了防治效率。昆虫具有明显的雌雄二型,对于大多数昆虫而言,需要一种选择性标记系统实现雌雄昆虫的大规模自动分离。
因昆虫多型性普遍,甚至存在变态发育阶段,故在选择辐照虫态时需要考虑:(1)方便收集进行辐照处理;(2)该虫态处理后能保证其最大限度的存活率、寿命、生殖力和交配竞争力[13];(3)该虫态的大规模释放对作物、环境等生产生活资料不产生特别严重的影响[14]。值得一提的是,同种昆虫不同地理种群间的亚不育剂量也可能不一样。
1.3.2 亚不育剂量的应用前景 对于辐照不育,目前出现了与其他防治方法结合克服了辐照SIT本身的不足,补充了昆虫不育体系。胞质不相容(Incompatible Insect Technique,IIT)是由于沃尔巴克氏体(Wolbachia)的作用下使得昆虫精子与卵子无法融合即胞质不相容[15],但缺点是如果雌雄个体均感染了此菌就可以产生后代[16]。沃尔巴克氏体是世界上最常见的寄生微生物,最早在尖音库蚊(Culex pipiens)体内发现。它们能感染各种节肢动物,尤其是昆虫。这类细菌只能通过卵来传播,并且它们善于操控宿主:一些沃尔巴克氏体菌株会使雌蚊未经交配就产卵;另一些菌株则会让雄蚊变成会产卵的雌蚊;还有一些菌株能使受感染的雄蚊精子发生改变,当这些精子让未受感染的雌蚊卵受精的时候,卵子就会因为细胞质不亲和而死亡。而IIT与SIT结合使用则克服了各自缺点,让野生白纹伊蚊〔Aedes albopictus(Skuse)〕稳定感染了沃尔巴克氏体,并传播了至少34代,虽然感染了沃尔巴克氏体的蚊子还是能传播疟原虫,但是传播效率大大降低[17]。原因在于,虽然人工释放的蚊子全部感染有沃尔巴克氏菌,但是当接受不影响活力的低剂量辐射时雌蚊会完全不育,降低了沃尔巴克氏菌感染的雌性意外释放的机会,从而大大降低了染菌雌雄产生可育后代的机率。可以看出,多种防控措施的有机结合是未来绿色高效防治害虫发展的方向,这项举措为阻断虫媒疾病做出了巨大贡献,也为害虫防控建立隔离区提供了新思路。

图2 亚不育剂量策略Fig.2 Sub-sterile dosage strategy process
2 自我限定型种群抑制研究
自我限定种群抑制是根据遗传学原理,向自然界中释放不育或携带有害基因的雄虫,所释放的遗传改造昆虫可将突变基因遗传给下一代,与自然界的野生雌虫交配后使其不能产生后代,或有害基因在后代中表达导致后代死亡,从而使害虫种群在几个世代后迅速减少,甚至灭绝。但其不利遗传因素(如显性致死基因)会随着时间推移而消失,因此就需要周期性地释放基因改造昆虫到野生种群中以维持抑制效果。
2.1 RIDL调控机理及应用
2.1.1 RIDL调控机理 释放携带显性致死基因昆虫技术(Release of Insects Carrying a Dominant lethal, RIDL)通过基因工程的方法,体外连接昆虫转座子、特异启动子、昆虫显性致死基因、转录激活域、荧光标记等元件,构建了一个复合转座 子(Transposons with Armed Cassettes,TAC)。基于昆虫转座子的引导,TAC插入昆虫基因组中,以遗传作为传递路径,以此达到控制害虫的目的。转基因纯合子雄虫与野生(wt)雌虫交配后,后代中雌性个体在TAC作用下死亡,雄性存活,经历数个世代后TAC将在子代中扩散,实现害虫灭绝。
目前使用RIDL技术构建的昆虫品系分别采用的调控体系是温度敏感性致死和四环素(Tetracycline,Tc)调控致死,后者为常用手段,是通过四环素饲喂控制含有致死基因昆虫生死的技术[19]。RIDL技术中Tet-off系统最为常见,由启动元件(Driver)为特异启动子驱动四环素转录激活因子tTA(tetracycline dependent transactivator,或经密码子突变改造优化的tTAV)与响应元件(Effector)组成。响应元件包括转录增强子tetO(tetracycline operator)或包含多个tetO元件的四环素响应元件tRE(tetracycline response element)、最小启动子(minimal promoter)和效应基因(可与性别特异可变剪切体连接)。
其原理为四环素存在时,tTA与tetO的特异结合受到抑制,效应基因不启动,昆虫正常存活;反之,昆虫死亡[20]。tetO由大肠杆菌(Escherichia coli)四环素抑制子(tetracycline repreeeor,tetR)的DNA结合域与病毒HSV1中VP16基因的转录激活域组成。控制系统又分为单元件和双元件。当效应基因为tTA时,此就为单元件系统,会形成正向反馈,通过不断积累的tTA造成昆虫死亡(图3A);若效应基因为凋亡基因(如hid)或Ⅰ型蛋白磷酸酶抑制剂基因(NippⅠ)等,既表达tTA也表达其效应基因,此为双元件系统。由于释放两性昆虫会使得防治效率下降,所以目前开发的是雌性不育RIDL(female specific RIDL,fsRIDL),通过性别特异表达的启动子或某些基因(如Actin-4、dsx、tra基因等)的性别特异可变剪切体,将它们与效应基因连接,即可实现性别的筛选(图3B)。RIDL应用于埃及伊蚊(Aedes aegypti),利用Actin-4基因的5' UTR具有性别特异性剪切体与效应基因VP16融合,特异地在雌性中表达,使得雌蚊无法飞行,RIDL技术采用的双元件系统(图3C)[21]。
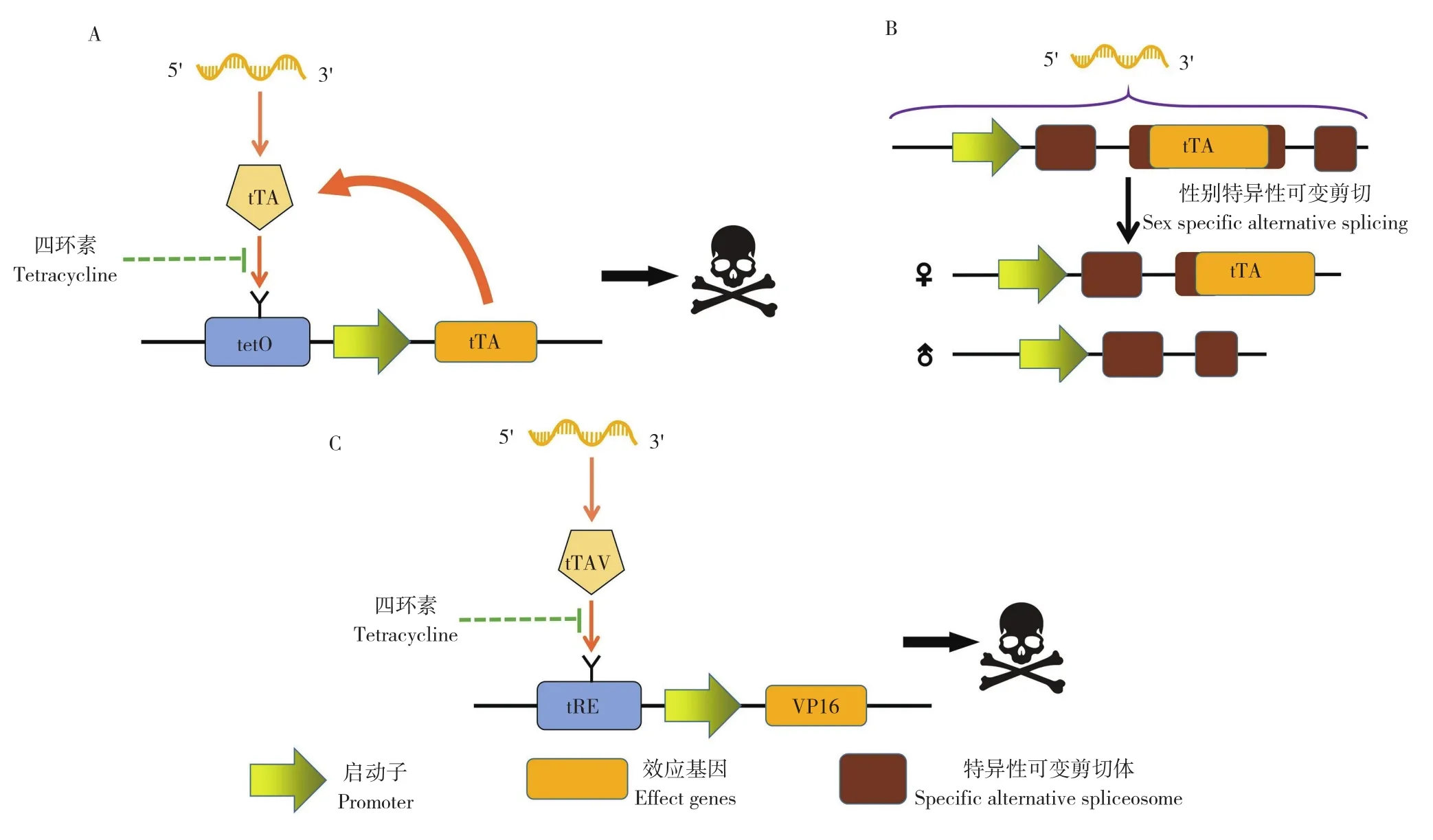
图3 RIDL系统示意图Fig.3 Schematic diagram of RIDL system
2.1.2 RIDL在应用中的可能模型 RIDL处理的昆虫与辐照处理相比,不仅解决了性别筛选的问题,同时消除了逃逸昆虫的可能,并且可以将释放昆虫进行可遗传荧光标记以有效监控。但其不足也较明显:(1)需要构建多个品系进行筛选,其昆虫品系使用不同转座子TAC被随机插入基因中,其插入位点决定了效应基因的表达效率和RIDL品系的适合度;(2)对于遗传信息不清晰的昆虫进行操作会变得困难,因为在构建TAC时,会利用目标昆虫的内源启动子、效应基因和雌性特异性剪接内含子信息;(3)转座子活性可能导致TAC在种内或种间漂移,降低了品系的遗传稳定性,进而需要通过特定手段使转座子失效;(4)昆虫种类的繁多、遗传信息差异也导致构建RIDL品系的技术难度和时间成本增加。
2.2 RNAi技术
2.2.1 RNAi技术概述 RNAi(RNA interference)由一种双链RNA(double-stranded RNA,dsRNA)诱导的内源性序列特异性转录后基因沉默机制,具有高度保守性。RNAi是dsRNA诱导的多步骤、多因素参与的过程,分为起始阶段与效应阶段。在起始阶段中,Dicer酶(序列特异性核酸内切酶)起到了关键性的作用,能特异识别dsRNA,当dsRNA进入到细胞质基质时会被Dicer酶分解为siRNA(small interference RNA)。在效应阶段,siRNA与Argonaute蛋白、Dicer酶等多种生物大分子装配形成复合物RISC(RNA-induced silenceing complex),通过ATP供能RISC携带的双链siRNA变成单链siRNA,变成具有活性的RISC(Slicer),此时Slicer与目的mRNA结合。如果siRNA的无义链与mRNA不互补,则复合体离开mRNA;反之,则置换出siRNA有义链,RNAaseⅢ从siRNA的无义链一端开始剪切mRNA,形成25 nt的小分子RNA,而这些小分子RNA在核酸酶的作用下降解,翻译阶段被破坏,实现目的基因沉默。将RNAi应用进昆虫遗传中,促使雌性后代特异性表达进行基因沉默,实现控制害虫的目的。
2.2.2 RNAi的应用 对100种昆虫的转录本研究中,编码这些蛋白的核心RNAi途径基因系统起源相似,充分说明了该技术的可行性[22]。橘小实蝇〔Bactrocera dorsalis(Hendel)〕中的雄性生殖相关基因gld2、tim、rae1和gudu使用RNAi后生殖力受到了显著影响,单雌产卵率显著下降[23]。对于鞘翅目昆虫,没有GGU这种特定序列,RNAi在使用上更加方便,效率更高。在鳞翅目昆虫中使用某些dsRNA不会沉默,反而使目标基因表达上调,在亚洲玉米螟(Ostrinia furnacalis)使用dsGFP和dsMLP共诱导了160个基因上调、44个基因下调,说明dsRNA的结构会引起防御性蛋白的表达[24]。在昆士兰果蝇(Bactrocera tryoni)中以tssk1、topi和trx为靶点基因可在不影响雄性竞争力的情况下,显著影响生殖力[25]。在鳞翅目昆虫中用RNAi抑制dsRNase基因可增强RNAi的效率[26]。小分子RNA降解时,其碱基排列为GGU为酶解位点,并且此排列具有普遍性[27]。
诸多因素限制着RNAi的推广应用:(1)dsRNA序列导致了siRNA数量存在差异;(2)目前dsRNA通过注射或饲喂的方法,在血淋巴和唾液中存在核酸酶水解的情况。在鳞翅目昆虫中还发现由up56基因编码特异性核酸酶REase抑制了RNAi[28]。研究表明,双链核糖核酸酶(dsRNases)、内切体包埋、核心机制功能缺陷、dsRNA的脱靶效率低和免疫刺激不足是限制RNAi效率的原因[29]。
3 自我维持型种群替代研究
基因驱动是指某些特定基因型或特定性状在种群中被有偏好性地遗传给后代的现象,也称为超孟德尔遗传(super-Mendelian inheritance)。自我维持型种群替代是通过基因驱动,将某些特定基因型或特定性状(具有轻度危害的良性基因)遗传给后代,以此替代自然界中具有严重危害作用品系的防治策略[30]。与自我限定型种群抑制相比,它具有更强的针对性和渗透作用,甚至可以改造种群,具有兼顾生态多样性保护和控害效益提高的特点。
3.1 基因编辑技术
这种策略的实施主要依靠于基因编辑技术的成熟应用。CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats)是一种由单链向导gRNA(single-guide RNA, gRNA)指导的Cas核酸酶对靶向基因进行特定DNA修饰的技术[31]。在基因编辑中Cas9蛋白(来源于酿脓链球菌Streptococcus pyogenes)应用最广,Cas9内切酶在向导gRNA〔识别保守的间隔相邻基序(proto-spacer adjacent motifs, PAM基序)〕的指引下能够对各种入侵的外源DNA分子进行定点切割。CRISPR/Cas9基因编辑系统由两部分组成,一部分是可以使dsDNA断裂产生平末端的Cas9核酸酶,另一部分是与Cas9相结合并可与靶标基因反义链序列结合的一段20 nt长的gRNA,在靶标基因上还需要有一个可以使Cas9可识别的PAM(NGG的序列)[32]。
crRNA(CRISPR-derived RNA)通过碱基配对与反式tracrRNA(trans-activating RNA)结合形成tracrRNA/ crRNA复合物(可以将crRNA和tracrRNA的表达融合到一起成为一个gRNA),此复合物引导核酸酶Cas9蛋白在与crRNA配对的序列靶位点剪切双链DNA[33]。gRNA引导序列靶定位点剪切双链DNA达到对基因组DNA修饰的目的[34]。切割DNA后会产生DSBs通过非同源末端连接修复机制(non-homologous end joining, NHEJ)可引起插入或缺失突变(insertion and deletions,Indels),从而改变靶标基因的开放阅读框,引起基因敲除;通过同源重组修复机制(homology directed repair, HDR)可插入外源序列,并产生等位基因[35-36]。随着该技术的发展,已在30种昆虫中应用,也在非模式昆虫建立了基因编辑方法,对于昆虫基因功能研究帮助巨大[36]。基于CRISPR剪切DNA的两种修复方式均会导致突变,产生抗CRISPR的基因序列[25]
3.2 诱变链式反应技术
3.2.1 诱变链式反应技术原理 诱变链式反应(mutagenic chain reaction, MCR)是基于CRISPR/Cas9技术编辑插入一个诱变体到目标基因,该诱变体通过自促性诱变将其同源染色体上的等位基因替换,产生纯合等位基因个体的现象。诱变体由三部分组成:(1)编码Cas9蛋白的中心片段(在体细胞和生殖细胞中表达);(2)感兴趣的基因序列gRNA;(3)Cas9/gRNA片段位点两侧的同源臂(HA1和HA2)与被切基因组靶点两侧的序列相匹配。通过Cas9引起的双链断裂的两种修复方法,一种是通过Rad51蛋白进行HDR,可将姐妹染色体的序列信息复制到切割位点,另一种是通过Ku70/80蛋白进行NHEJ,会导致插入信息错误或删除某些序列。在gRNA引导下Cas9切割基因组靶点,随后通过HDR将Cas9/gRNA片段插入该位点,然后由HDR驱动的Cas9/gRNA片段传播给姐妹染色体,只有当Cas9/gRNA片段来自反义链才能利用细胞的内源性修复机制,复制到另一个染色体上产生自纯合等位基因。此遗传规律绕开了孟德尔遗传规律,这是一种主动遗传。尽管其他形式的主动遗传学也能绕开孟德尔遗传规律(如转座子RIDL和RNAi),但MCR提供了更为灵活的编辑功能。对个体的MCR进行测序发现有部分的Cas9切割并没有进行NHEJ,而是进行了HDR,这种修复不仅降低了基因转化效率,而且这种突变会不利于携带MCR个体的生存,可能形成wt抗MCR的等位基因[37]。
3.2.2 MCR的修复方式与优势 将Cas9突变的情况严格限制在生殖细胞中可以针对特定位点,进而抑制基因驱动的发生。有两种方法可以针对MCR所导致的抗性基因的出现,去除变异基因的影响:
(1)自促性链式反应的逆转元件(Elements for Reversing the Autocatalytic Chain Reaction,ERACR)可以去掉并替代MCR。ERACRs(需提供外源Cas9)的gRNA与MCR的Cas9在反义链上结合,将元件去除并替换。ERACRs相较于MCR是保守的,因其无编码Cas9的序列故不能在野生种群中传播,而且也不会有基于Cas9的基因突变从而减少突变积累,甚至可以恢复MCR所改变的基因功能[38]。但是也有它的局限性,当gRNAs相似时MCR会破坏ERACRs形成NHEJ阻止MCR缺失,同时,对于ERACRs拥有了抗性的MCR基于HDR也可在种群中传播。为了减少此类情况,就是将ERACRs的切割位点放在距离MCR较远的位置(>1 kb)。
(2)自促性链式反应的搭便车结构(Constructs Hitchhiking on the Autocatalytic Chain Reaction,CHACR)可作用于染色体的其它位点,与MCR并行复制用于替换修复。CHACRs是携带1个或多个gRNAs结构(不以MCR为靶点)的元件,CHACRs可将其他基因组当作靶点,通过插入CHACR到基因组引发NHEJ。当Cas9脱靶突变了1个位点,可设计1个CHACRs通过与MCR杂交,重新编码突变位点进行替换修复[39]。CHACR传播到种群中,随后使用ERACRs去除MCR使其恢复到wt。ERACRs的靶点也会出现在CHACRs(通过携带针对Cas9的gRNAs)上,这使得CRISPR更加灵活。通过使用类似的gRNAs品系与MCR品系杂交的方法,可让后代中的MCR或CHACR自动去除不能编辑的等位基因,并且HDR会使用对gRNA有抗性的同源模板修复突变。这种搭便车的模式让CHACR与MCR得以关联传播。CHACR携带一个或多个gRNAs(可通过同一的途径激活)沉淀在(非)靶标基因,用以灭活 MCR[40]。
自我维持型种群抑制仅仅成功控制了少数害虫,随着人们对物种多样性认识的加深,种群替代已经成为遗传控制的首选。显然,该技术的成熟应用对于以后复杂的转基因和孟德尔遗传规律组合,可以更好地针对虫媒疾病与入侵物种,甚至是某些疾病。在不针对个体存亡时从技术上可以看出:(1)MCR对生态影响极小,甚至不伤害昆虫种群;(2)MCR群体不会持续单独存在,它们能够分散进入相邻的同一种群中进行交配,不会存在隔离的情况,能够比较温和地将MCR混入wt种群,回顾自我限定型种群抑制则不会;(3)CHACR和ERACR的联合使用增加了灵活性,做到了精准的“外科手术”,是对生物分子机理的人为实践,具有应用价值。
3.2.3 精确诱导不育技术的应用 精确诱导不育技术(precision guided SIT, pgSIT)是基于CRISPR的精确诱导昆虫不育显性遗传技术,该技术在卵期就开始筛选性别并使雄性不育。通过pgSIT系统能精准地针对雌性致死基因与雄性不育基因,让其后代产生100%的不育雄虫,与自限性技术相比拥有更高的效率(图4)。主要作用方式为,分别构建两个转基因品系(通过CHACR和ERACR做到稳定繁殖),A品系表达dgRNAs(double-guide RNAs),B品系表达Cas9蛋白,通过单向交配使得两边被同步引导并敲除了显性等位基因,在后代中将隐性性状转化为显性性状,这种方式产生的后代竞争力与wt相比没有差别[41]。在雌性果蝇中挑选性别特异基因Sxl(sex lethal)和Tra(transformer),在雄性中挑选出生育基因dsxF(doublesex)和βTub(βTubulin 85D),Sxl可使雌性致死,βTub则可使雄性不育[42]。将他们组合在一起构建出 dgRNAβTub,Sxl,dgRNAβTub,Tra和 dgRNAβTub,DsxF对生殖竞争力无影响的A品系;B品系表达nos-Cas9也对其生活力无影响。dgRNAβTub,Sxl与B交配后可产生100%的雄性不育后代,不会产生雌性;而dgRNAβTub,Tra和dgRNAβTub,DsxF雌性会转化为无法生育的个体(intersex,♀),雄性则完全不育。通过上述的CHACR和ERACR可以做到精准控制品系的产生而不会影响各品系内个体的正常繁殖。在F1中dgRNA出现了反式表达的情况,但依旧不影响表型。由于分别插入了两种gRNA至同源染色体的等位基因上,因此依赖CRISPR的pgSIT能促使DNA断裂并进行NHEJ修复,而不是诱导HDR。
明显优点:(1)pgSIT的抗性积累是不存在的。因为纯合品系分别培养然后交配产生不育雄虫,即不能产生可存活后代,从而限制了CRISPR靶位点的选择压力;(2)自然遗传多样性也不太可能构成问题。考虑到pgSIT雄性的作用只是寻找wt雌性交配,从而减少种群数量;(3)卵的释放让运输保存大大简化,并且做到了防治区域可控。孵化的幼虫消耗了原本可繁殖幼虫的资源,这点与fsRIDL相似,但不会对生态产生影响。唯一可能的缺点在于,Cas9的脱靶几率是有的,这点与辐照不育的随机性是相似的,这也是引起某些不育雄性环境适应性低的主要原因[43]。

图4 pgSIT 模式[40]Fig.4 Mode of pgSIT[40]
4 讨论与展望
农业害虫防治的未来应该是创造出一种简便、易控、生态友好型的自我维持型种群替代技术。自我限定型种群抑制对于整个环境而言是具有风险的[44],而自我维持型种群替代受到了广泛重视。首先,应通过辐照结合分子技术的手段找寻昆虫对不同剂量产生耐辐照性的根本原因;其次,通过成熟的pgSIT创造出低耐辐照性品系并在野生种群中传播;最后在不影响生态的情况下通过区域内大范围低剂量辐照甚至通过紫外光,促使目标害虫达到不育效果,实现控制种群的目的。这种做法不仅解决了昆虫饲养的问题,更是做到了对生态最大限度的保护。
不育策略在实践中需谨慎。在加拿大针对辐照苹果蠹蛾Cydia pomonella(L.)防控进行了长达25年的跟踪研究发现,种植者会反对这种产生不育后代的措施,原因是:(1)与直接使用农药相比起效时间太长,并要保证不育蛾与野生蛾交配的同步性,即应在野外种群大量交配的时期且集中分布的地块释放不育昆虫,才能达到干扰繁殖的目的;(2)滞育的野生幼虫出现的概率大,在种植时间长的果园里应及时对控制区内的老树进行清理;(3)人工饲养的辐照蛾应该与外界的环境需相似,否则释放时辐照蛾不适应环境会大量死亡;(4)使用辐照蛾之前需要先将其野生种群密度降到最低,才利于控制害虫种群。有研究发现寄生蜂和辐照蛾联用可以极大地提升防治效果[45]。可见,目前公众对于此类技术秉持怀疑,因此研究者应该注意宣传促成公众态度和科学研发的互动,从而建立健全国家政策,达到良性循环使技术真正造福于民。
实践中所出现的问题是不育技术投入使用的重要一环,表明技术的真正开展需要对昆虫生态、生理学等多种学科加深了解才能充分发挥其长处,这也对科研工作者提出了更高的要求。可以看出任何不育技术都是需要对靶标昆虫的规模化养殖,故昆虫的饲养是该技术的主要瓶颈,但目前大多数昆虫的人工饲养尚不成熟,因此要大规模的推广必定需要重视昆虫工厂化大规模饲养技术的研究开发。
本文总结了过去10年间昆虫不育技术在防治侧重点上的动态变化,可以看出思路的转变带动了技术的变革,并且不断完善昆虫不育体系。目前研究已经达到了分子操作的层次,由于针对的是微观层面,可能更加难以察觉,需要科研工作者加大对物种基因库变化与风险的检测,如蛋白通路变化、基因的融合表达等。科学技术的不断发展使得这些技术相互融合并碰撞出了更为耀眼的火花,为未来科学防控提供了无限可能。
