一株防治黄瓜霜霉病的地衣芽孢杆菌HS10的防病机理初探
2020-11-10罗玉明刘红霞郭坚华
郑 丽 ,徐 龙,罗玉明,刘红霞,郭坚华
(1.仲恺农业工程学院 植物健康创新研究院/农业与生物学院,广东 广州 510225;2.南京农业大学植物保护学院/江苏省生物源农药工程中心,江苏 南京 210095;3.淮阴师范学院生命科学学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏 淮安 223001;4.中化现代农业安徽有限公司,安徽 合肥 240041)
【研究意义】由古巴假霜霉菌(Pseudoperonospora cubensis)引起的黄瓜霜霉病,在高温高湿的温室环境下流行快、发病重、防治难度大,成为生产中重要的病害之一[1-2]。抗性品种的选育周期长,病害防治过多依赖化学药剂,而化学农药的反复使用又极易产生抗药性[3]。【前人研究进展】植物病害生物防治是利用有益微生物及其代谢物,对农作物病害进行有效防控的方法与技术[4]。芽孢杆菌(Bacillussp.)具有丰富的多样性、分布广泛、抗菌谱广等优势,被广泛应用于病害的生物防治,包括枯草芽孢杆菌(B.subtilis)、蜡样芽孢杆菌(B.cereus)、地衣芽孢杆菌(B.licheniformis)、短小芽孢杆菌(B.pumilus)等。枯草芽孢杆菌研究最为深入,而关于地衣芽孢杆菌防病机理的报道相对较少。随着社会对农药残留问题的重视,中高毒性的化学农药不断被禁用、限用,农业农村部启动“减肥减药”行动,生物农药的开发得到快速发展。生物农药“宁盾”[5]、“武夷菌素”[6]、“绿盾丰”、“双抗”或其他活体生防菌剂,主要是利用植物的天然代谢物或生防菌株的发酵液及其次生代谢产物,防效大多在50%~70%[7-8]。此外,还有关于植物类提取液[9]、生物活性蛋白[10]、寡糖[11]等应用型研究。
【本研究切入点】据已有研究可知,地衣芽孢杆菌对农作物的真菌性病害如辣椒疫霉菌菌(P.capsici)[12],油菜核盘病(Sclerotinia sclerotiorum)[13],柑橘炭疽病(Colletotrichum gloeosporioidesPenz.)、苹果轮纹病菌(Physalospora piricola)[14]及桃枝枯病(Phomopsis amygdali)[15]等有较好的防治效果,生防菌能够通过多种途径促生防病。【拟解决的关键问题】前期获得一株对黄瓜霜霉病(P.cubensis)防效较好的地衣芽孢杆菌HS10,拟进一步检测该菌株的广谱室内平板抑菌活性和对同类疫霉菌病害的防效,通过检测该菌株的胞外粗蛋白对病害表现的防效,以及对植物抗病相关酶活性的影响,初步探究其可能的防病机理。
1 材料与方法
1.1 菌株培养和植物材料
HS10菌株培养:将-70 ℃冰箱的菌株划线在LB固体培养基上,置于28 ℃培养12 h,挑取单菌落接种到液体LB(氯化钠10 g/L,胰蛋白胨10 g/L,酵母浸粉5 g/L,调节pH=7.2,琼脂粉15 g/L)中,28 ℃、200 r/min振荡培养12~16 h,当培养至OD600为0.5~0.8时,将种子液以1∶500体积比加入至500 mL培养液中,28 ℃、200 r/min振荡培养24 h。
病原菌培养:稻瘟病菌、辣椒疫霉菌使用PDA培养基(马铃薯200 g/L,切碎加水煮沸20 min,滤液中加入蔗糖20 g/L,琼脂粉15 g/L)、霜疫霉菌采用胡萝卜培养基(胡萝卜 200 g,去皮后榨汁,汁液双层纱布过滤,定容至1 L,加琼脂 15 g),25 ℃培养 5~7 d。
植物材料及培养:供试黄瓜品种为津优35,将黄瓜种子进行表面消毒(70%无水乙醇表面消毒1~2 min,0.05%次氯酸钠溶液浸泡10 min,灭菌水润洗5次),播种于育苗盘中在28 ℃、16/8 h光周期、70%以上相对湿度的温室培育。待黄瓜苗长到3~4片真叶(25 d左右)进行移栽。将黄瓜幼苗移栽装满基质的盆钵中,每盆1株,置于28 ℃、相对湿度85%以上、光周期16/8 h的温室培养。荔枝品种为广州从化85%成熟度的糯米糍。
1.2 HS10菌株室内平板抑菌作用测定
通过对峙培养方法测试菌株的颉颃作用。将病原菌菌丝块分别接种于PDA培养基中心,在其四周距中心约27 mm处接种HS10菌株,4次重复,每个重复3个培养皿。28 ℃培养5~7 d,待对照菌丝长满平板后,记录抑菌带的大小。
1.3 HS10菌株对荔枝采后霜疫病的防治效果试验
试验设5.0×107CFU/mL生防菌HS10发酵培养液和1/10 LB液体2个处理。采后室内防效测定:田间采摘健康的糯米糍果实(广州从化某农户,约85%成熟度,2016年6月),每个处理3 L菌液或LB浸泡果实,24 h后接种浓度为5×104个/mL荔枝霜疫霉菌孢子囊。每个处理4次重复,每个重复30个果实。接种后72 h调查病情指数。
田间防效测定:田间约75%成熟度的淮枝果实(广州花都区四联村某农户,2016年6月)喷雾处理,3 d后田间喷雾接种病原菌,喷雾时加入终浓度为0.01%表面活性剂Tween-20。接种后90 h调查病情指数。病害调查和病害统计参照Zheng等[16]的方法。
1.4 HS10粗蛋白对黄瓜霜霉病的防治效果试验
1.4.1 粗蛋白提取 按上述方法培养菌体,6 000 r/min离心10 min,收集上清,使用80%硫酸铵沉淀上清液,获得粗蛋白[13]。利用BSA牛血清蛋白作标准品,采用考马斯亮蓝法检测HS10-Protein蛋白浓度,调整终浓度至50 μg/mL喷施。
1.4.2 粗蛋白对黄瓜霜霉病的防效检测 试验设粗蛋白和无菌水2个处理,每个处理4次重复,每个重复60棵苗,随机区组排列,小区之间以4株黄瓜苗作为保护行。施药方法采用小喷壶喷雾至每片黄瓜叶片上布满液滴,重点喷施叶背。大棚霜霉病自然发生,药后8 d开始调查病情指数。日光温室大棚及土壤结构、病情指数统计和防治效果参照Zheng等[17]的方法
1.4.3 粗蛋白对辣椒疫霉菌丝生长的影响 将在PDA平板、25 ℃培养4 d的辣椒疫霉菌,接种至50 mL液体PDA培养基中,100 r/min、25 ℃培养2 d后,加入终浓度2.5 mg/mL粗蛋白,继续培养2 d后,挑取菌丝进行显微镜观察。
1.5 HS10预处理对黄瓜叶片PAL和POD活性测定
1.5.1 黄瓜叶片处理 参照Zheng等[17]的方法培育黄瓜苗,待其长出10片真叶后在温室进行喷雾处理。试验设1.0×107CFU/mL HS10菌悬液和无菌水2个处理,在喷雾时均加入终浓度为0.01%表面活性剂Tween-20。每个处理4次重复,每个重复24棵苗,每棵苗喷施至叶面可见液滴为准(约30~60 mL)。取样时间为处理后 0、3、6、12、24、36、48 h。
1.5.2 粗酶液提取 准确称量黄瓜叶片(去叶柄)0.5 g,剪碎,加入5.0 mL、0.050 mol/L硼酸缓冲液(含5 mmol/L巯基乙醇,1 mmol/L EDTA,pH=8.7),0.05 g聚乙烯吡咯烷酮(PVP),在冰浴中研磨成匀浆,于4 ℃、12 000 r/min离心20 min,取上清液,即为粗酶液。
1.5.3 PAL活性测定 粗酶液用KOH调节pH=8.9,21 μL上清中加14 μL STO缓冲液和7 μL 60 mmol/L L-苯丙氨酸,40 ℃温水浴反应1 h,冰浴停止反应。测定OD290值(以每分钟OD290值变化0.01所需酶量为1 U),计算酶活性(U/g·min):
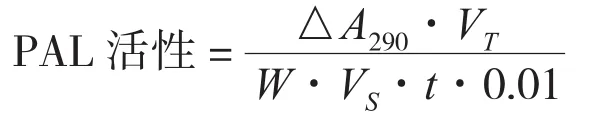
式中,△A290为单位反应时间内吸光度值的变化,VT为酶提取液总体积(mL),VS为测定时取用的酶液体积(mL),W为样品鲜重(g),t为反应时间(min)。
1.5.4 POD活性测定 500 μL反应体系中,含0.1 mol/L磷酸缓冲液(pH=6.1),4 mmol/L愈创木酚,3 mmol/L H2O2,20 μL粗酶提取物,测定OD470值(以每分钟OD470值变化0.01所需酶量为1 U)。POD活性用辣根过氧化物酶标准曲线标定,计算公式同1.5.3。
在Microsoft Excel中对试验数据进行基本处理后,采用DPS7.05软件进行单因素方差分析,采用LSD法进行差异显著性检验。
2 结果与分析
2.1 HS10菌株对病原真菌的颉颃作用
HS10菌株对稻瘟病菌抑菌圈半径为14.3 mm,颉颃效果较好;对霜疫霉菌和辣椒疫霉菌抑菌圈半径分别为12.8、12.3 mm,颉颃效果次之;对炭疽病菌和草茎点霉菌抑菌圈半径分别为2.5、1.5mm[18],但对小孢拟盘多毛孢无抑菌圈(表1)。可见,该菌株对不同病原真菌的颉颃能力存在差异。

表1 HS10菌株对多种病原真菌的颉颃作用Table 1 Antagonism of HS10 strain against various pathogenic fungi
2.2 HS10菌栋对荔枝霜疫病的防治效果
采后荔枝果实在室内常温条件下,接种病原菌72 h,HS10处理病情指数仅为15.52,而对照则为41.23,防效达到62.36%,能有效减轻霜疫病发生。田间试验发现,接种后90 h,HS10处理病情指数为34.14,对照为63.22,防效为46%(表2)。可见,该菌株对荔枝霜疫病表现较好的防治效果。
2.3 HS10菌体粗蛋白的作用分析
2.3.1 对黄瓜霜霉病的田间防效 HS10菌株粗蛋白(浓度为50 μg/mL)喷雾预处理日光温室黄瓜后,发现对黄瓜霜霉病防效可达60.08%(表3),与该菌株一样对黄瓜霜霉病表现出较好的防效[17]。
2.3.2 粗蛋白对辣椒疫霉菌的抑菌效果 据报道,黄瓜霜霉病可能与疫霉分类地位相似,故本实验选择辣椒疫霉菌作为指示菌检测提取的粗蛋白活性[19]。结果发现,HS10粗蛋白可抑制辣椒疫霉菌丝生长,造成菌丝顶端生长异常,膨大扭曲、畸形,菌丝胞质分布不均匀,营养吸收障碍,生长受抑制,由白色变黄色(图1)。
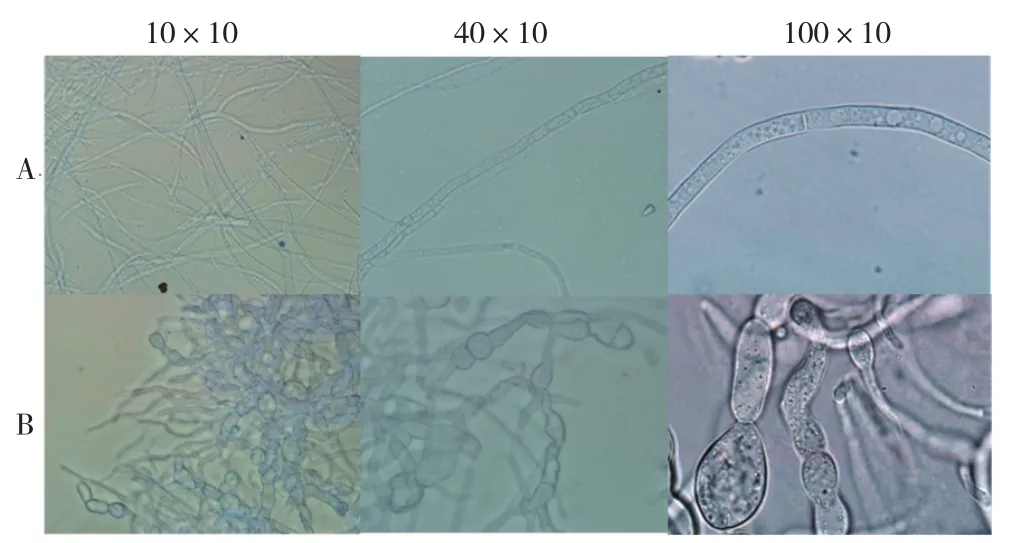
图1 HS10粗蛋白对辣椒疫霉病菌菌丝生长的影响Fig.1 Effect of HS10 crude protein on the growth of P.capsici mycelium
2.4 HS10菌株对植物防御酶活性的影响
HS10菌株喷雾预处理黄瓜叶片后,发现PAL和POD活性变化趋势为“上升-下降-上升”。PAL活性表现为在0~12 h高于对照,48 h达到峰值(图2A),POD活性表现为0~6 h高于对照,48 h达到峰值(图2B)。可见,该菌株预处理叶片,也提前引发植物防御酶活性的增加。
3 讨论
前期,我们从黄瓜健康根围土中分离筛选到一株有效生防地衣芽孢杆菌HS10,通过检测发现其对多种病原菌均有平板颉颃效果;在对与黄瓜霜霉病菌分类地位较接近的其他病害如荔枝霜疫病菌引起的霜疫病防效分析中,我们同样发现该菌株对田间或采后果实均表现生防效果,且该菌株的菌源VOCs同样对霜疫病具有抑制效果[16],初步说明该生防菌可作为较好的生防因子防治一类病害,特别是霜霉科病害。
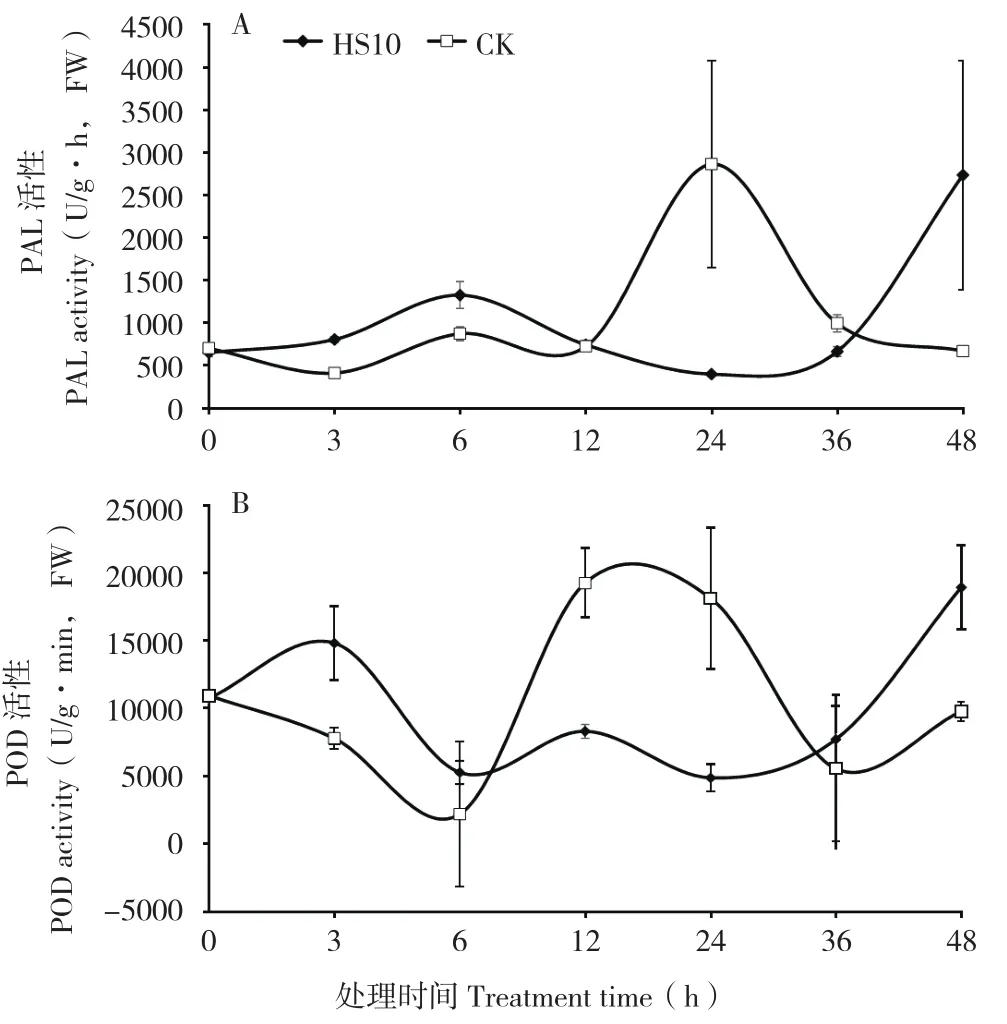
图2 HS10菌株对黄瓜叶片PAL、POD活性的影响Fig.2 Effects of HS10 strain on PAL and POD activity in cucumber leaf
近年来,从抗菌蛋白的角度解析生防芽孢杆菌的可能作用机制成为研究热点,发现了不少新型抗菌蛋白。所涉及的生防菌株包括枯草芽孢杆菌、蜡质芽孢杆菌、解淀粉芽孢杆菌和其他新型芽孢杆菌,发现抗菌蛋白大都具有抗菌谱广、稳定性良好等优势,蛋白大小不等、种类多样,如枯草芽孢菌分离的41.9 ku抗菌蛋白(Bacisubin)具有凝集素活性和核糖核酸酶活性,对链格孢属(Alternaria)真菌有较强的抑制作用[20];蜡质芽孢菌分离的30 ku蛋白为新型胞外几丁质酶[21];解淀粉芽孢杆菌分离的50 ku抗广谱真菌蛋白Baciamin可以抑制各种肿瘤的增殖,激活巨噬细胞的一氧化氮活性,并抑制HIV-1反转录酶(reverse transcriptase,RT)[22];在蜜蜂体内新型芽孢杆菌分离的一种35.615 ku鞭毛蛋白(flagellin),也具有抑菌活性[23]。同时,胞外脂肽类化合物也是重要的抑菌物[24]。在针对HS10粗蛋白的研究中,对黄瓜霜霉病的田间防效达到60.08%,随后的研究中发现粗蛋白能够造成菌丝顶端生长异常,膨大扭曲、畸形。推测HS10菌株可能通过胞外分泌物抑制病原菌的生长,是生防效果发挥的重要途径之一,也为新型生物农药开发提供途径。
生物激发因子能够通过诱导细胞防卫反应抵抗病原菌侵扰,包括活性氧的爆发,细胞壁的加厚,植保素的积累,以及防御酶活性的变化等[25-26]。PAL与酚类物质、木质素及植保素等植物抗病物质的合成密切相关;POD可清除活性氧,并氧化酚类物质为对病原菌具有毒害作用的醌类物质,促进木质素合成。本研究结果表明,用HS10处理后的黄瓜叶片中PAL和POD活性与对照相比发生了明显变化,处理6 h内,酶活性均高于对照,但峰值延迟,36~48 h才快速上升,对照则在6~12 h快速上升。可能原因为菌体处理后提前激活植物防御酶活性,随着菌株定殖量的减少,酶活性降低,但之后定殖的菌体开始增殖,激活防御相关酶的活性。
4 结论
地衣芽孢杆菌HS10对稻瘟病菌、霜疫霉菌、辣椒疫霉菌表现较好平板颉颃作用,抑菌圈在10 mm以上;对与黄瓜霜霉病菌具有相似分类地位的荔枝霜疫菌及其引发的荔枝霜疫病表现出抑菌和防病效果;该菌株可通过胞外分泌蛋白抑制辣椒疫霉菌的菌丝生长,通过影响防病相关酶PAL和POD活性的改变达到防病的作用。在未来研究中,我们将进一步探讨抗性相关基因的表达水平,对病原真菌菌丝生长形态和生长相关调控的影响机制,以及对叶围或果实表面的微生物群落丰度的影响。
