温度对蝴蝶兰成花诱导的影响
2020-11-10唐芸妃徐旭华赖思婷杨世茵区健晴
唐芸妃,徐旭华,丰 锋,赖思婷,杨世茵,区健晴,廖 菲
(广东海洋大学滨海农业学院,广东 湛江 524088)
【研究意义】蝴蝶兰(Phalaenopsis amabilis)为多年生草本附生花卉,因其花型独特、花色丰富、品种繁多、观赏期长而备受人们的喜爱,是花卉市场上中高档花卉中的佼佼者。其中,“火凤凰”蝴蝶兰好养且易催花、花色艳丽、花级别高、花期长、商品性好[1]。蝴蝶兰原生长于热带亚热带地区,生长温度要求18 ℃以上,耐寒性较弱。刘学庆等[2]对6个品种蝴蝶兰耐冷性进行了比较研宄,表明蝴蝶兰忍受夜温极限在9 ℃以下。蝴蝶兰由营养生长转向生殖生长的重要环境信号是温度[3],楼建华等[4]研究表明,蝴蝶兰最适的生长温度是24~27 ℃,发生冷害的临界温度为10~12 ℃,因此,温度是影响蝴蝶兰生长的重要环境限制因子,每年的7、8月份将蝴蝶兰转移到山上,利用山上的温差促使花梗抽生,但这种处理方式的费用和损耗率大大增加,使得成本也随之提高。因此,探索温度对蝴蝶兰成花诱导的影响,明确蝴蝶兰生长的适温区间,为难催花品种及低温替代提供参考,从而利用人工控温,减少生产成本,对我国蝴蝶兰产业的可持续健康有序发展具有现实意义。【前人研究进展】近几年来,温度对蝴蝶兰生长影响主要在生理生化代谢[5]、成花诱导和激素水平变化等方面[6]的研究较多。植物长期生长过程中,形成了抗氧化酶类保护系统,高冬冬等[7]研究表明,可溶性糖、可溶性蛋白质等渗透调节物质含量多少,以及超氧化物歧化酶抗氧化酶活性等的变化情况,都可以反映植物的抗冷性强弱,同时蝴蝶兰抗冷品种自身酶保护系统强于不抗冷品种。Guilbault等[8]通过对不同蝴蝶兰品种的抗寒性研究,得出超氧化物歧化酶活性及丙二醛含量与蝴蝶兰的抗冷性性关系较大。【本研究切入点】基于前人的研究成果,本试验将处于大苗期的蝴蝶兰品种火凤凰置于一系列温度梯度的气候箱中培养,通过测定不同温度处理时间下,蝴蝶兰品种叶片内可溶性糖、可溶性蛋白质、丙二醛含量及超氧化物歧化酶活性等指标,并分析其在不同温度处理条件下的变化趋势。【拟解决的关键问题】从生理生化方面探讨温度对蝴蝶兰成花诱导的影响,分析掌握促进蝴蝶兰开花、同时提高花梗质量的温度范围。
1 材料与方法
1.1 试验材料
供试蝴蝶兰品种为火凤凰(大苗期,叶长1.17 cm,3~4片叶),购于佛山市顺德区陈村花卉世界。
1.2 试验方法
试验采用单因素随机区组设计,设5个处理,分别为29/22、26/19、23/16、20/13、17/10 ℃(日/夜),分别置于5个气候箱,昼夜温差为7 ℃,2次重复,每个重复10株,共100株。昼夜光周期10 h/14 h,相对湿度75%,于2019年7月18日开始培养,9月3日(培养52 d)移出气候箱以20/17 ℃继续培养。各处理每隔10 d施肥、浇水1次,每次每株100 mL。施肥、浇水时间间隔开,肥料为花宝2号(N∶P∶K=20∶20∶20)1 000倍加磷酸氢二钾(K2HPO4)500倍混合液。
从试验开始每隔10 d取样1次,每个处理随机取样两株,剪取植株自上而下的第2片叶,用以生理指标测定,3次重复。
1.3 形态指标和生理指标测定
抽梗指数:指蝴蝶兰该日抽梗数与至该日止的抽梗天数之比的总和。
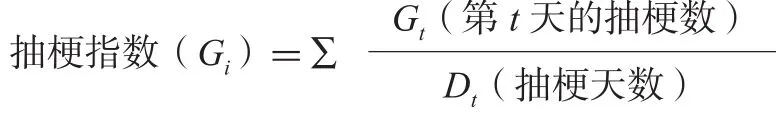
可溶性糖含量测定采用蒽酮比色法,可溶性蛋白质测定采用考马斯亮蓝G-250法[9]。
丙二醛含量测定采用张蜀秋等[10]的方法并稍作改进:将称量好的硫代巴比妥酸倒入烧杯中,加入10%三氯乙酸1 mL,混合,在45 ℃左右水浴锅中搅拌溶解,再用10%三氯乙酸定容至相应刻度。试验中如果发现硫代巴比妥酸溶液结块,均先在45 ℃左右的水浴中溶解后再使用。
超氧化物歧化酶(SOD)活性测定参照高俊凤[11]的方法。
试验数据使用Microsoft Excel 2010进行预处理,采用SPSS 20.0进行One-Way ANOVA单因素方差分析和显著性检验(Ducan新复极差法),采用Origin 2019绘图。
2 结果与分析
2.1 温度对蝴蝶兰抽梗的影响
由表1可知,26/19 ℃处理蝴蝶兰抽梗时间最早,处理后30 d抽梗,抽梗率100%,抽梗指数为14.86,为所有处理中最高;23/16 ℃处理后36 d抽梗,抽梗率100%,抽梗指数为2.41;20/13 ℃处理后40 d抽梗,抽梗率95%,抽梗指数为1.13;17/10 ℃处理抽梗率80%,抽梗指数为0.41;29/22 ℃处理抽梗指数为0.04,为所有处理中最低。
由表2可知,26/19 ℃处理后30 d抽梗植株数为7株,显著高于其他处理,处理后40 d累计抽梗数为10株,抽梗结束;23/16 ℃处理后40 d抽梗数量为8株,显著高于其他处理,处理后50 d累计抽梗数为10株,抽梗结束;20/13 ℃处理后60 d抽梗数量为3.5株,显著高于其他处理,处理后70 d累计抽梗数量为9.5株,抽梗结束。17/10℃处理后70 d抽梗数量为6.5株,显著高于其他处理,处理后80 d累计抽梗数为8株,抽梗结束。
2.2 温度对蝴蝶兰叶片可溶性糖含量的影响
由表3可知,26/19 ℃处理后20 d蝴蝶兰叶片可溶性糖含量达到最高值4.65 mg/g,处理后30 d可溶性糖含量比处理后20 d下降0.91 mg/g,处理后40 d依然在下降;23/16 ℃处理后20 d可溶性糖含量达到最高值8.16 mg/g,极显著高于其他处理,之后呈现下降趋势;20/13 ℃处理后30 d可溶性糖含量达到最高值7.31 mg/g,极显著高于其他处理,处理后40 d可溶性糖含量比处理后30 d下降3.42 mg/g;29/22 ℃处理可溶性糖含量一直呈下降趋势;17/10 ℃处理可溶性糖含量先升后降,处理后20 d植株逐渐显现低温胁迫状态,叶片呈现暗紫色,在嫩叶基部呈现水渍状凹陷。表明日温26~20 ℃处理后蝴蝶兰叶片可溶性糖含量在抽梗前先上升到最高值,抽梗后开始下降,且随着抽梗时间增加可溶性糖含量呈现下降趋势。
2.3 温度对蝴蝶兰叶片可溶性蛋白质含量的影响
由表4可知,26/19 ℃处理后20 d蝴蝶兰叶片可溶性蛋白含量达到最高值845.83 µg/g,之后呈现下降趋势;23/16 ℃处理后20 d可溶性蛋白含量达到最高值1 206.94 µg/g,显著高于其他处理,处理后30 d可溶性蛋白含量比处理后20 d下降729.16 µg/g,处理后40 d依然在下降;20/13 ℃处理后20 d可溶性蛋白含量达到最高值890.97 µg/g,显著高于26/19 ℃处理,处理后30 d可溶性蛋白含量比处理后20 d下降451.39 µg/g,处理后40 d可溶性蛋白含量总体还是下降;17/10 ℃、29/22 ℃处理可溶性蛋白含量呈现波动趋势。表明日温26~20 ℃处理后蝴蝶兰叶片可溶性蛋白含量在抽梗前先上升到最高值,抽梗后可溶性蛋白含量下降,且随着抽梗时间延长可溶性蛋白质含量呈现下降趋势。
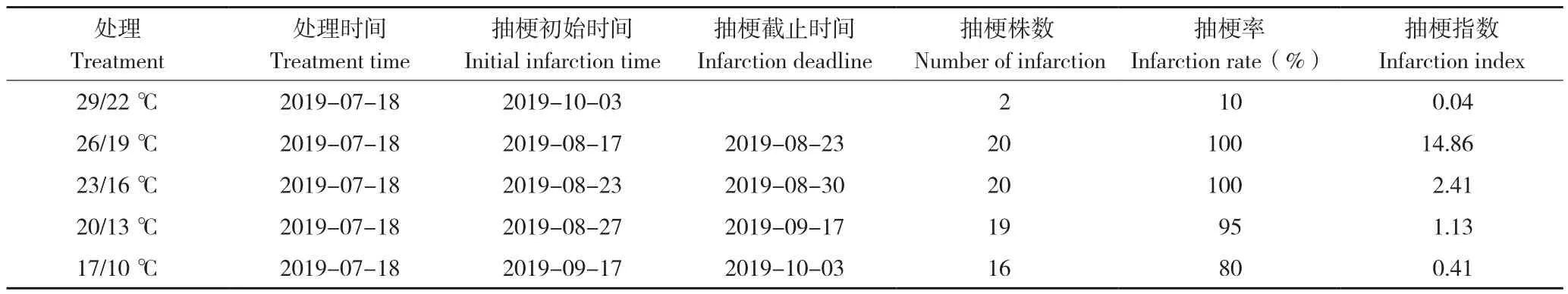
表1 温度对蝴蝶兰花芽诱导的影响Table 1 Effect of temperature on bud induction of P.amabilis
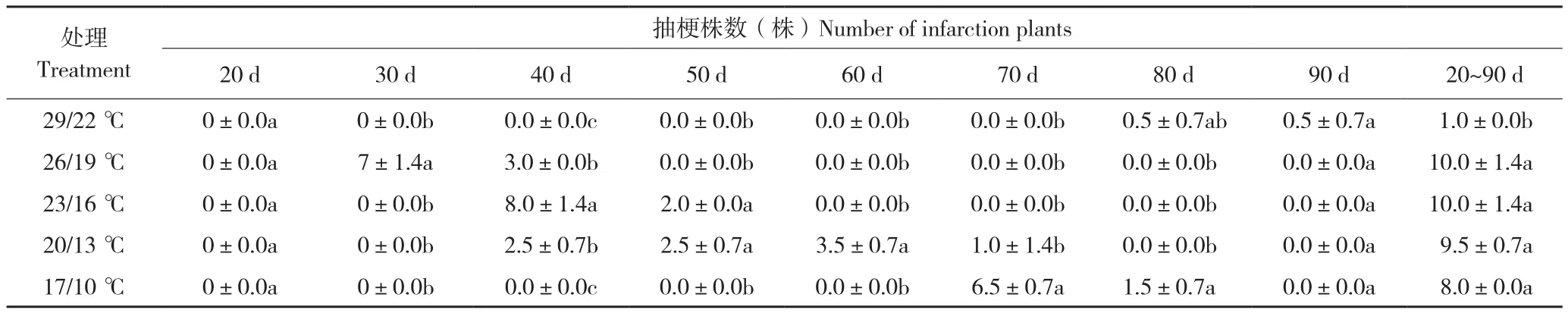
表2 温度对蝴蝶兰抽梗的影响Table 2 Effect of temperature on the number of pedicels in P.amabilis
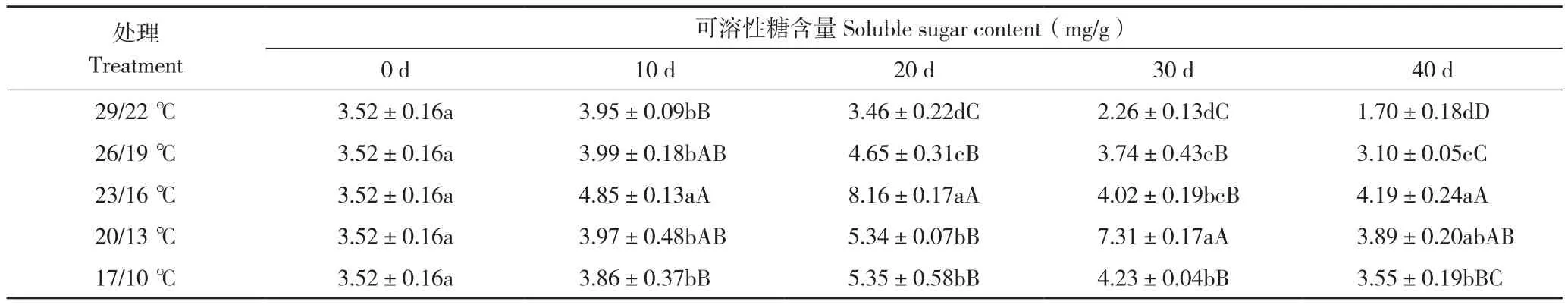
表3 温度对蝴蝶兰叶片可溶性糖含量的影响Table 3 Effect of temperature on soluble sugar content in P.amabilis leaves
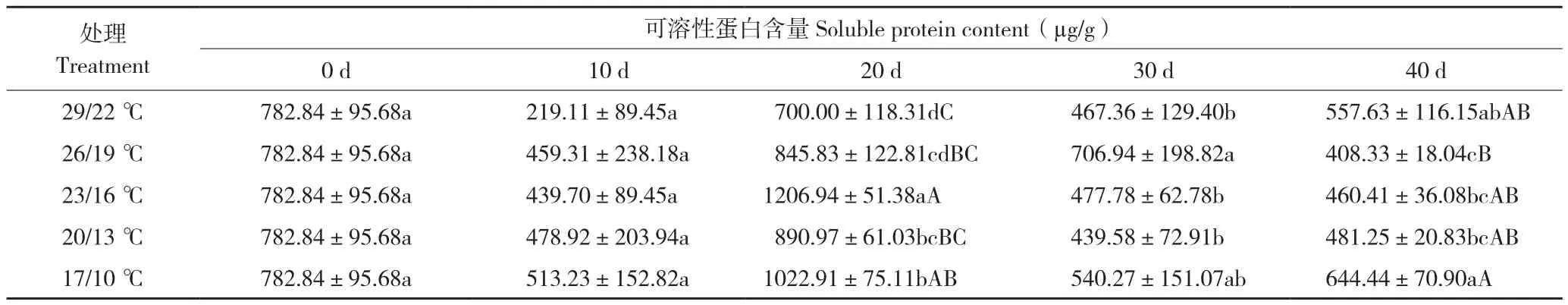
表4 温度对蝴蝶兰叶片可溶性蛋白质含量的影响Table 4 Effect of temperature on soluble protein content in P.amabilis leaves
2.4 温度对蝴蝶兰叶片丙二醛含量的影响
由表5可知,26/19 ℃处理后20 d蝴蝶兰叶片丙二醛含量为1.45 µmol/g(FW),处理后30 d比处理后20 d上升0.15 µmol/g(FW),显著高于其他处理,处理后40 d含量依然下降;23/16 ℃处理后20 d丙二醛含量达到最大值1.69 µmol/g(FW),之后逐渐下降;20/13 ℃处理丙二醛含量在抽梗前上升,抽梗后逐渐上升;17/10 ℃处理丙二醛含量总体呈现上升趋势,与其他处理比较达到显著水平,随着低温时间的延长呈现上升趋势;29/22 ℃处理丙二醛含量总体呈下降趋势且均低于其他处理。日温26~23 ℃处理蝴蝶兰叶片丙二醛含量在抽梗前呈上升趋势,抽梗后下降。
2.5 温度对蝴蝶兰叶片SOD活性的影响
由表6可知,26/19 ℃处理后30 d蝴蝶兰叶片SOD活性达到最高值379.42 µmol/g·h(FW),处理后40 d SOD活性比处理后30 d下降19.36 µmol/g·h(FW);23/16 ℃处理后20 d SOD活性达到最高值389.98 µmol/g·h(FW),处理后30 d酶活性下降,处理后40 d上升;20/13 ℃处理SOD活性一直呈现上升趋势;29/22 ℃处理SOD活性在整个过程中均呈下降趋势;17/10 ℃处理SOD活性呈波动状总体呈上升趋势,处理后20 d开始,17/10℃处理SOD活性与其他处理差异显著。日温26~20 ℃处理蝴蝶兰叶片SOD活性在抽梗前上升,日温23~20 ℃处理抽梗后SOD活性仍呈上升趋势。
3 讨论
高等植物花芽分化过程可概括为成花诱导、花的发端以及花器官的形成等,其中成花诱导是花的发端和花器官形成的基础,直接控制着开花时间[12]。黄胜琴等[13]研究表明,诱导蝴蝶兰开花的最适温度为25/20 ℃;陈春忠等[14]研究表明,适宜蝴蝶兰催花的温度为25~28 ℃/18~20 ℃。从本试验结果看,26/19 ℃是蝴蝶兰成花诱导的最佳温度,23/16 ℃次之,20/13 ℃会引起一定数量花芽败育,17/10 ℃会引起低温伤害,移到较高温度可以诱导抽出花梗、但花梗质量偏差,在29/22 ℃温度条件下则无法完成此过程,因此蝴蝶兰催花过程中日温过高、夜温过低均不利于诱导开花。蝴蝶兰的抽梗是需要一定的低温积累量,合理设置日夜温度及温差,可以使蝴蝶兰的抽梗时间缩短、抽梗整齐、花梗质量好。
从本试验结果来看,日温26~20 ℃蝴蝶兰抽梗前叶片可溶性糖含量上升,这与黄胜琴等[15]和秦建斌等[16]的研究结论一致;蝴蝶兰抽梗后,其叶片可溶性糖含量下降,这与黄胜琴等[15]的结论不同。李哖等[17]指出,蝴蝶兰在花芽发育时期叶片可溶性糖含量发生变化的原因是此时花芽作为生长中心,从无花芽期到开花期,可溶性糖大多分配到花芽中,导致叶片中可溶性糖含量逐渐降低。本试验中,日温26~20 ℃处理蝴蝶兰抽梗前叶片可溶性蛋白含量上升,抽梗后下降,与李淑娴[18]的研究结果一致,这可能是由于抽梗前可溶性蛋白含量升高有利于花芽形态发育,抽梗后可溶性蛋白含量降低可能是花芽开始分化,营养物质需要提供给花器官,导致叶片的可溶性蛋白含量减少。日温26~23 ℃处理蝴蝶兰叶片丙二醛含量在抽梗前上升、抽梗后下降,说明蝴蝶兰抽梗前处在低温的适应和积累中,积累了一定低温后,开始抽梗,之后也逐步适应低温,丙二醛含量开始下降。20/13 ℃处理前期也在适应低温,随着低温时间的增加,丙二醛含量上升,这可能是由于夜温长时间过低,慢慢接近低温伤害引起的。日温26~20 ℃处理蝴蝶兰叶片SOD活性在抽梗前呈现上升趋势,抽梗后变化不一,抽梗前是低温适应和积累中,保护酶系统活性相应增加,保护植物正常生长,抽梗后由于低温的积累量不同,植物会在不同程度的伤害,但未出现低温伤害,酶活性没有受到抑制,因此日温23~20 ℃在蝴蝶兰抽梗后保护酶活性依然在增加,这与高冬冬[19]的研究结果一致。今后可以温度结合可溶性糖、可溶性蛋白等共同处理,研究调控蝴蝶兰花芽分化基因。
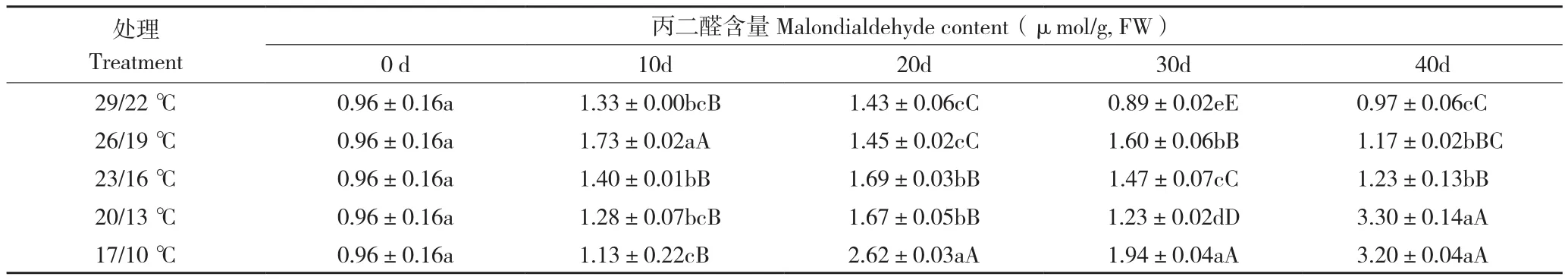
表5 温度对蝴蝶兰叶片丙二醛含量的影响Table 5 Effect of temperature on malondialdehyde content in P.amabilis leaves
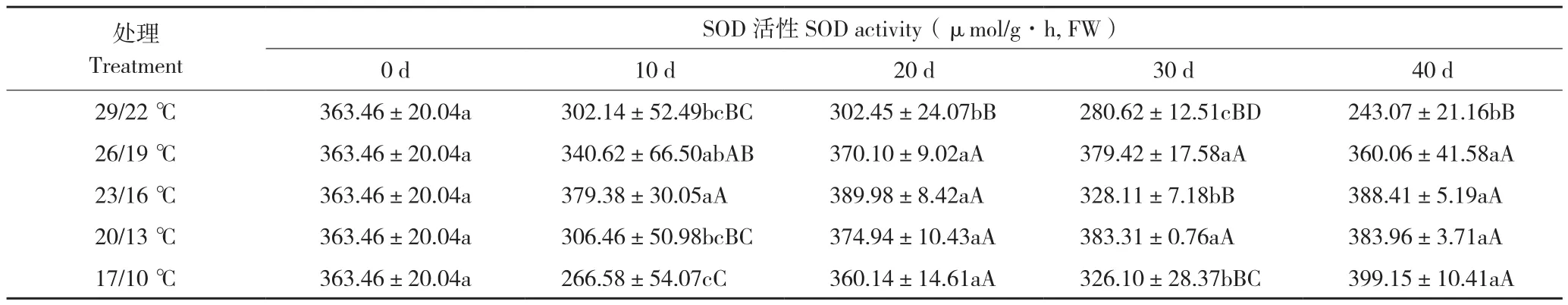
表6 温度对蝴蝶兰叶片活性的影响Table 6 Effect of temperature on SOD activity in P.amabilis leaves
4 结论
本试验结果表明,诱导蝴蝶兰抽梗的最适日/夜温度为26/19 ℃,抽梗时间最早,处理后30 d抽梗,抽梗率和抽梗指数均为最高,分别为100%及14.86,抽梗时间集中,有利于实际生产运用;23/16 ℃处理后36 d开始抽梗,抽梗率100%,但抽梗指数仅2.41,抽梗时间较晚且较分散,时间间隔较长;20/13 ℃处理后40 d开始抽梗,抽梗率95%,抽梗指数为1.13,抽梗时间晚且间隔更长,不利于实际生产运用;29/22 ℃处理蝴蝶兰未抽出花序轴,表明高温条件不能诱导蝴蝶兰开花;17/10 ℃处理会引起低温伤害,处理结束后转移到较高温度可以诱导花芽分化抽出花梗,但花梗质量偏差。蝴蝶兰抽梗前会先进行营养物质的积累,叶片可溶性糖含量和可溶性蛋白含量上升,抽梗过程营养物质消耗,抽梗后叶片可溶性糖含量和可溶性蛋白含量下降,且随着抽梗时间增加可溶性含量和可溶性蛋白质含量呈现下降趋势;蝴蝶兰抽梗前处在低温的适应和积累中,丙二醛含量和SOD活性上升,积累一定低温后开始抽梗,之后也逐步适应低温,丙二醛含量开始下降,SOD活性变化不一。
