基于mtDNACOI和mtDNACOⅡ分子标记的贵州省茶棍蓟马种群遗传多样性分析
2020-11-09罗林丽孟泽洪李帅赵兴丽周罗娜贺圣凌周玉锋
罗林丽 孟泽洪 李帅 赵兴丽 周罗娜 贺圣凌 周玉锋


摘要:【目的】研究貴州省茶棍蓟马不同地理种群间的遗传多样性,为掌握贵州省茶棍蓟马的遗传动态和扩散规律及制定防控措施提供理论依据。【方法】以贵州省11个不同地理区域的茶棍蓟马种群mtDNA CO I和mtDNA CO II基因序列为靶标,利用MEGA 6.0、DnaSP 5.10、Arlequin 3.5.2.2和Network 2.0等软件对种群遗传分化、基因流水平、分子变异及种群遗传多样性等进行分析。【结果】基于mtDNA CO I和mtDNA CO II基因分析时,分别检测到11种和9种单倍型,各地理种群的单倍型多样度(Hd)较高,分别为0.609和0.633;总体遗传固定指数(FST)分别为0.11902和0.09052,基因流(Nm)分别为2.00和2.51,表明贵州省茶棍蓟马各地理种群间的基因交流水平较高,种群间遗传分化较小。mtDNA CO I和mtDNA CO II基因序列的单倍型网状树分析均无明显分支;种群间的分子变异(AMOVA)分析结果表明,茶棍蓟马的遗传变异主要来自种群内部。总群体的中性检验Fus Fs不显著(P>0.05),且错配分布曲线呈现多峰,说明贵州省茶棍蓟马种群在较近的历史时期内保持相对稳定,未经历明显的种群扩张,或处于临界状态。【结论】贵州省茶棍蓟马种群遗传多样性较丰富,虽然尚未形成明显的种群扩张,但可能已处于临界状态,应积极采取综合防控措施,力争将茶棍蓟马种群数量控制在危害水平以下,以保证贵州省茶产业生产健康可持续发展。
关键词: 茶棍蓟马;mtDNA CO I基因;mtDNA CO II基因;地理种群;遗传多样性
中图分类号: S433.89 文献标志码: A 文章编号:2095-1191(2020)07-1684-09
Abstract:【Objective】The study was conducted to investigate genetic diversity among different geographical populations of Dendrothrips minowai Priesner in Guizhou, so as to provide theoretical foundation for the analysis of population genetic dynamics, population dispersion mechanism and formulating control measures. 【Method】The mtDNA CO I and mtDNA CO II sequences of D. minowai populations, which collected from 11 different geographical areas in Guizhou, were selected as molecular markers, population genetic differentiation, gene flow, molecular variance and genetic diversity of populations were analyzed by using software MEGA 6.0, DnaSP 5.10, Arlequin 3.5.2.2, Network 2.0 etc. 【Result】A total of 11 and 9 types of haplotype were detected when the mtDNA CO I and mtDNA CO II gene were analyzed, respectively, haplotype diversity(Hd) of different geographic population were high, which were 0.609 and 0.633, respectively. The total genetic fixations index(FST) were 0.11902 and 0.09052,the total gene flow(Nm) were 2.00 and 2.51, respectively, which indicated that the level of gene communication was high and the genetic differentiation among populations were small. The haplotype network of different geographical populations based on mtDNA CO I and mtDNA CO II showed no obvious branches, and the analysis of molecular variance(AMOVA) of different geographical populations indicated that the genetic variation mainly occurred within the same population. The total neutral test showed that Fus Fs were not significant(P>0.05), and the mismatch distribution curve had multiple peaks, which indicated the population of D. minowai in Guizhou were relatively stable in recent historical period, and has not experienced evident expansion or at critical state. 【Conclusion】The genetic diversity of D. minowai populations in Guizhou is relatively rich, which has not yet formed an obvious sudden expansion, but might approach to critical phase. Therefore, comprehensive prevention and control measures should be taken actively to control the D. minowai populations quantity under damage level and ensure the sustainable and healthy development of tea production in Guizhou.
Key words: Dendrothrips minowai Priesner; mtDNA CO I gene; mtDNA CO II gene; geographical population; genetic diversity
Foundation item: National Natural Science Foundation of China(31560515); National Modern Agricultural Industry Technology System Construction Project(CARS-19); Guizhou Science and Technology Plan Project(NY〔2015〕3011-2)
0 引言
【研究意义】茶棍蓟马(Dendrothrips minowai Priesner)又称茶棘皮蓟马,属缨翅目(Thysanoptera)蓟马科(Thripidae)(唐美君和肖强,2018),在我国主要分布于浙江、福建、广东、广西、海南和贵州等南方茶区,在山东等也有少量报道(王洪涛等,2018;李貌等,2020)。近年来,茶棍蓟马在贵州省多地为害且逐年加重,个别区域暴发成灾,严重影响茶叶的产量和品质,成为影响贵州省茶叶生产的主要害虫之一(彭萍等,2013;吕召云等,2015)。贵州省地貌以山地居多,受多种因素的影响,气候呈现多样性,生物多样性及群体遗传多样性也极其丰富,在此基础上探索茶棍蓟马种群内在的遗传变异与进化关系等,能从遗传学角度为有效防控茶棍蓟马提供理论指导。【前人研究进展】目前,针对蓟马遗传多样性的研究多集中在入侵性害虫西花蓟马上。武晓云等(2009)利用PCR克隆并分析了西花蓟马rDNA ITS2和mtDNA CO I基因序列的进化速率,发现rDNA ITS2序列的变异程度比mtDNA CO I高,提出mt-DNA CO I较rDNA ITS2更适合应用于西花蓟马的种内遗传分析;Brunner和Frey(2010)利用mtDNA CO I基因和微卫星分子标记对美国西部地区西花蓟马种群的遗传结构进行分析,发现在起源地西花蓟马种群发生了分化,且这种遗传分化与形态上的分化不一致,推测这种分化是由栖息地的环境不同(地理隔离)造成;乔玮娜(2012)运用DNA条形码技术对我国13个省(市)不同地理种群西花蓟马的175条mt-DNA CO I基因序列进行遗传多样性和遗传分化程度分析,推测我国西花蓟马各地理种群的可能来源;Yang等(2012a,2012b)用微卫星和mtDNA CO I分子标记研究西花蓟马在我国的入侵遗传学,发现传入我国的西花蓟马在遗传多样性上表现出一个明显的瓶颈效应,揭示西花蓟马可能首先传入我国云南,随后云南成为我国其他西花蓟马种群的源头。沈登荣等(2014)对蓟马科9个属27种的mtDNA-CO I基因序列变异进行分析,首次报道了茶棍蓟马的mtDNA-CO I基因序列。目前茶棍蓟马虽然已在贵州等多地为害,但其研究仅限于形态(王洪涛等,2018)、空间分布(张莉等,2019)和防治措施(赵志清和陈流光,1998;李慧玲等,2014;涂娟等,2016;董照锋和张小平,2018;曾明森,2019)等方面,鲜少有利用分子标记技术探讨茶棍蓟马遗传变异方面的相关研究,仅Lü等(2016)利用mtDNA CO I作为分子标记研究了贵州茶棍蓟马的遗传结构与多样性,认为贵州省茶棍蓟马种群在近期发生了种群扩张。【本研究切入点】线粒体基因已广泛运用于动物(尤其是昆虫)分子进化与系统发育研究(Dickey et al.,2015;Lü et al.,2016)。线粒体基因中的3个细胞色素氧化酶亚基编码基因(CO I、CO II和CO III)进化速率不同,CO II基因核苷酸序列及其推导氨基酸序列的进化速率均比其他2个亚基(CO I和CO III)高(Peterson et al.,2001)。本研究在Lü等(2016)的研究成果基礎上,选用mtDNA CO I和mtDNA CO II基因作为分子标记,同时增加每个地理种群的测序样本数,分析贵州省茶棍蓟马不同地理种群的遗传变异与进化关系。【拟解决的关键问题】对贵州省11个地理种群茶棍蓟马群体mtDNA CO I和mtDNA CO II基因的部分序列进行测序,研究贵州省茶棍蓟马群体的遗传多样性及遗传分化情况,探讨群体内在的遗传变异与进化关系,为掌握贵州省茶棍蓟马的遗传动态和扩散规律及制定防控措施提供理论依据。
1 材料与方法
1. 1 试验材料
以贵州省不同地理种群的茶棍蓟马为供试样本。在野外用小毛笔直接蘸取茶树上的茶棍蓟马,将其放入盛有无水乙醇的样本管中,记录样本采集时间、采集地点及其经纬度等信息,样本带回实验室在显微镜下进行鉴定后置于-20 ℃保存。具体采样信息见表1。
1. 2 基因组DNA提取
茶棍蓟马总DNA的提取参照张利娟等(2011)的盐析法,提取单头蓟马DNA,提取的DNA以20 μL无菌超纯水充分溶解后-20 ℃保存备用。
1. 3 PCR扩增与序列测定
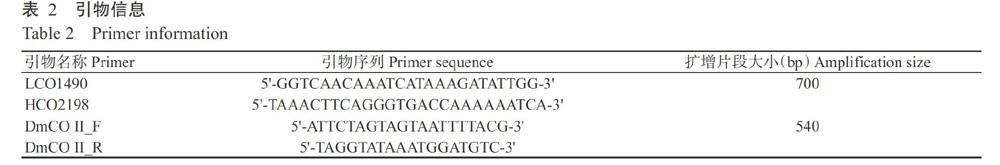
mtDNA CO I基因序列扩增使用DNA条形码标准引物LCO1490/HCO2198(Folmer et al.,1994);参照NCBI数据库中茶棍蓟马线粒体基因组DNA全长序列中的mtDNA CO II区域,设计mtDNA CO II基因引物DmCO II_F/DmCOI I_R(表2)。反应体系50.0 μL:TaKaRa PrimeSTAR HS DNA Polymerase 0.5 μL,5×PrimerSTAR Buffer 10.0 μL,dNTP Mixture 4.0 μL,上、下游引物各2.0 μL,DNA模板3.0 μL,无菌双蒸水28.5 μL。mtDNA CO I扩增程序:94 ℃预变性5 min;94 ℃ 1 min,53 ℃ 1 min,72 ℃ 80 s,进行32个循环;72 ℃延伸10 min,4 ℃保存。mtDNA CO II扩增程序:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,进行32个循环;72 ℃延伸10 min,4 ℃保存。取2.0 μL PCR产物进行电泳检测后,对确定含有目的片段的产物进行双向测序(引物合成和测序由北京擎科新业生物技术有限公司完成)。
1. 4 序列分析
利用Chromas 2.23对测序所得序列进行峰图质量验证,对序列进行人工读取和反复校验后,将正、反向序列进行拼接得到的完整序列片段在NCBI数据库中进行同源比对,以确定序列是否为所需的目的片段。
1. 5 遗传学参数计算与分析
利用MEGA 6.0分析序列的碱基组成与多态性位点、转换/颠换偏倚率等(Tamura et al.,2013);通过DnaSP 5.10计算核苷酸多样度(π)、单倍型多样度(Hd)、核苷酸平均差异数(K)及种群间遗传固定指数(FST)、基因流(Nm)等遗传学参数(Librado and Rozas,2009)。利用SAMOVA 2.0(Dupanloup et al.,2002)对不同地理种群间的分子空间变异进行分析,然后根据SAMOVA分组结果,应用Arlequin 3.5.2.2进行中性检验、分子遗传变异方差(AMOVA)和错配分布分析(Excoffier and Lischer,2010)。使用Network 5.0绘制基于Median-joining的单倍型中介网络图(Bandelt et al.,1999)。
2 结果与分析
2. 1 茶棍蓟马mtDNA CO I和mtDNA CO II基因序列特征分析结果
11个茶棍蓟马种群的mtDNA CO I基因经双向拼接和ClustalW序列比对分析后得到137条序列,片段长度665 bp,共检测到17个多态性位点,包括11个自裔位点和6个简约信息位点;所有序列的总突变数为17,其中发生转换的位点数为15,发生颠换的位点数为5,转换/颠换率为18.741;所有序列核苷酸A、T、C和G的平均含量分别为31.73%、37.95%、16.64%和13.68%,A+T含量为69.68%,序列碱基组成有明显的A/T偏好性。mtDNA CO II基因经双向拼接和比对分析后得到132条序列,片段长度525 bp,共检测到16个多态性位点,包括9个自裔位点和7个简约信息位点;所有序列的总突变数为16,其中发生转换的位点数为13,发生颠换的位点数为3,转换/颠换率为5.797;所有序列核苷酸A、T、C和G的平均含量分别为35.24%、37.27%、14.55%和12.95%,A+T含量为72.51%,序列碱基组成有明显的A/T偏好性。
2. 2 茶棍蓟马单倍型及遗传多样性分析结果
以mtDNA CO I为靶标基因时,在测序成功的137条序列中共观测到11种单倍型(Hap1~Hap11),其中,Hap2为共享单倍型,在11个茶棍蓟马种群中均有分布,Hap1为优势单倍型,在除SN外的10个种群中均有分布;Hap1和Hap2序列共计121条,占序列总数的88.32%;种群单倍型数的范围为2~5,CS2种群的单倍型数最多(表3)。以mtDNA CO II为靶标基因时,在测序成功的132条序列中共观测到9种单倍型(Hap1~Hap9),其中,Hap3为共享单倍型,在11个茶棍蓟马种群中均有分布,Hap2在除PX外的10个种群中均有分布;Hap2和Hap3序列共计111条,占序列总数的84.09%;种群单倍型数的范围为2~4(表4)。
基于mtDNA CO I基因进行分析,结果(表5)显示,贵州省11个茶棍蓟马地理种群总体Hd为0.609,Hd范围0.167~0.733,其中GY种群的Hd最大,CS1种群的Hd最小;总体π为0.00129,π范围为0.00025~0.00213;总体K为0.859,K范围为0.167~1.418;π和K均以CS2种群最大、CS1种群最小。基于mtDNA CO II基因进行分析,结果(表6)显示,贵州省11个茶棍蓟马地理种群总体Hd为0.633,Hd范围为0.248~0.778;总体π为0.00188,π范围为0.00047~0.00347;总体K为0.985,K范围为0.248~1.820;GY种群的Hd、π和K均最大,而PX种群的最小。
2. 3 遗传分化与分子变异分析结果
将11个茶棍蓟马种群作为一个整体进行分析,以mtDNA CO I基因为靶标时,总群体的FST为0.11902,变异范围为-0.08556~0.52427;总群体的Nm为2.00,变异范围为-36.02~58.57(表7)。以mtDNA CO II基因为靶标时,总群体的FST为0.09052,变异范围为-0.08211~0.54221;总群体的Nm为2.51,变异范围为-215.77~182.23(表8)。综合分析表明,贵州省不同地理区域的茶棍蓟马种群间基因交流水平较高,种群间遗传分化较小。但mtDNA CO I基因和mtDNA CO II基因反映各地理种群间的遗传分化水平并不完全一致。如以mtDNA CO I为靶标基因的分析结果显示,SN种群与DS和SQ种群间可能存在中度分化;而以mtDNA CO II为靶标基因显示,彼此间无明显遗传分化。
在SAMOVA 2.0中对不同地理种群茶棍蓟马间的分子空间变异进行分析,将各种群的地理信息与遗传信息结合,得到可能的种群组合方式,结果显示mtDNA CO I和mtDNA CO II基因的分组结果一致,均以K=2时的分组结果最佳,即将11个地理种群分成两组,PX、XY、CS1和CS2为第1组,LS、DZ、DS、SQ、SN、MT和GY为第2组。mtDNA CO I和mtDNA CO II基因的AMOVA分析结果显示(表9),同一种群内的遗传变异分别占总体变异的79.72%和81.63%,各种群内的FST均呈显著性差异(P<0.01),2个基因的分析均表明种群遗传变异主要来自种群内部。此外,2个基因分析均表明,不同组间的遗传变异(FCT)均表现出显著性差异(P<0.01),组内种群间的遗传分化顯著,而组内种群间的遗传变异(FSC)均表现为差异不显著(P>0.05,下同),组内种群间的遗传变异不明显。
2. 4 单倍型系统发育分析结果
基于Median-joining构建的单倍型中介网络树分析结果(图1)显示,mtDNA CO I基因与mtDNA CO II基因的单倍型中介网络图结果基本一致,贵州省11个茶棍蓟马地理种群均未表现出明显分支。mtDNA CO I基因序列定义了11种单倍型(3个共享单倍型和8个独享单倍型),其中,Hap1为其他单倍型的核心,出现频率较高的是Hap1和Hap2,为优势单倍型,基本分布在每个地理种群中,其他独享单倍型通过一步或几步突变与优势单倍型相连。mtDNA CO II基因序列定义了9种单倍型(4个独享单倍型和5个共享单倍型),其中,Hap3为其他单倍型的核心,Hap2和Hap3出现频率较高,为优势单倍型,基本分布在每个地理种群中,其他独享单倍型通过一步或几步突变与Hap2和Hap3相连。
2. 5 种群动态分析结果
从mtDNA CO I和mtDNA CO II基因的Taijimas D和Fus Fs中性进化模型检验结果(表5和表6)可知,11个种群作为一个整体进行分析时,mtDNA CO I和mtDNA CO II基因的Taijimas D检验结果达显著性负值(P<0.05),而Fus Fs检验结果为非显著性负值,二者结果相反,同时,各种群的Taijimas D和Fus Fs检验结果均不显著地偏离零。11个茶棍蓟马种群总体的错配分布曲线呈现多峰(图2),表明种群较稳定,种群近期历史上未经历明显的扩张,与Fus Fs检验一致。
3 讨论
本研究获得贵州省11个茶棍蓟马地理种群的137条mtDNA CO I基因序列和132条mtDNA CO II基因序列,2个基因的碱基组成均有明显的A/T偏好性,具有典型的昆虫mtDNA基因碱基组成特点(Jermiin and Crozier,1994;Simon et al.,1994)。另外,Simon等(1994)认为,亲缘关系较近的分类单元核苷酸碱基转换大于颠换,而亲缘关系远的分类单元则相反。本研究中,mtDNA CO I和mtDNA CO II基因序列的转换/颠换偏倚率R分别为18.741和5.797,与Simon等(1994)的观点一致。Knight和Mindell(1993)认为,转换/颠换偏倚率R的临界值为2,当R<2时,可认为基因突变达饱和状态;反之,当R>2时表示基因突变尚未达饱和状态。本研究中,贵州省11个茶棍蓟马地理种群所有mtDNA CO I和mtDNA CO II基因序列的转换/颠换偏倚率R均大于2,表明贵州省茶棍蓟马mtDNA CO I和mtDNA CO II基因序列的碱基突变尚未达饱和状态。
Hd和π主要用于衡量一个种群线粒体基因的遗传多样性(张桂芬等,2014)。本研究对贵州省11个茶棍蓟马地理种群基于mtDNA CO I和mtDNA CO II基因的研究结果显示,mtDNA CO I基因序列定义11种单倍型(3个共享单倍型和8个独享单倍型);mtDNA CO II基因序列定义9种单倍型(4个独享单倍型和5个共享单倍型),说明贵州省各地理种群茶棍蓟马的mtDNA既存在一定的交流,又有一定程度的遗传分化。基于mtDNA CO I基因和mtDNA CO II基因进一步对总群体的FST和Nm进行综合分析显示,总群体的FST均在0.05~0.15范围内,Nm均大于1,说明贵州省不同地理区域的茶棍蓟马种群间基因交流水平较高,种群间遗传分化较小(Balloux and Lugon-Moulin,2002)。另一方面,mtDNA CO I基因和mtDNACO II基因反映各地理种群间的遗传分化水平并不完全一致,Hua等(2008)研究认为不同线粒体基因和蛋白编码基因不同位点的进化速率不同,因此,可推测mtDNA CO I基因和mtDNACO II基因反映各地理种群间的遗传分化水平不一致是由基因突变的速率存在差异所造成。
Taijimas D(Tajima,1989)和Fus Fs(Fu,1997)检验是目前应用最广泛的两种中性检验模型,可用这2种模型来推算种群的历史动态变化(Nielsen,2005)。当中性检验结果为显著负值时,表明种群在历史上曾发生过规模扩张和定向选择;当中性检验结果为显著正值时,表明种群在历史上曾发生过萎缩和平衡选择;当中性检验结果不显著地偏离零时,中性零假说也不能被排除,表明种群在历史上保持相对稳定(Tajima,1989;Fu,1997)。从mtDNA CO I和mtDNACO II基因的中性进化模型检验结果可看出,各种群的Taijimas D和Fus Fs检验结果均未达显著差异水平;但将11个茶棍蓟马种群作为一个整体进行分析时,2个基因的Taijimas D检验结果达显著水平(P<0.05),而Fus Fs检验结果未达显著水平,结果正好相反。有研究表明,Fus Fs比Taijimas D能更好地檢验种群的扩张现象(Ramosonsins and Rozas,2002)。进一步进行错配分布分析发现,贵州省11个茶棍蓟马种群总的错配分布曲线为多峰;Harpending等(1998)认为最近形成的或发生了扩张现象的种群,其错配分布曲线呈单峰,相反,存在时间较长或相对稳定的种群,其错配分布曲线呈多峰。本研究中,2个分子标记的错配分布曲线为多峰,与Fus Fs检验结果一致,表明种群较稳定,近期历史尚未形成明显扩张。Lü等(2016)研究表明贵州省茶棍蓟马经历了明显的扩张,与本研究结果存在一定的分歧,究其原因:一方面可能是分析样本数引起的偏差;另一方面,从2个基因的错配分布曲线上看,除第一个峰外,后面的峰形很低,可能存在一种扩张与未扩张之间的临界状态。
本研究样本采集地仅限于贵州省部分地区,在遗传分化与多样性的分析上可能存在一定偏差。另外,关于茶棍蓟马目前在多省(区)茶区为害的情况,应对全国各省(区)为进行深入调查,如有必要可对全国范围内的茶棍蓟马遗传多样性进行系统研究,及时掌握种群动态,以防止该虫在全国各大茶区扩张和暴发。
4 结论
贵州省茶棍蓟马总体遗传多样性较高,种群间发生了一定分化,虽然尚未形成明显的种群扩张,但可能已处于扩张与未扩张之间的临界状态。因此,在农业生产中应重视对茶棍蓟马的防控工作,积极采取综合防控措施,力争将茶棍蓟马种群数量控制在危害水平以下,以保证贵州省茶产业生产健康可持续发展。
参考文献:
董照锋,张小平. 2018. 5种杀虫剂对茶棍蓟马、茶黄蓟马田间防效[J]. 东北农业科学,43(5):38-40. [Dong Z F,Zhang X P. 2018. Field control effect of 5 pesticides on Dendrothrips minowai Priesner and Scirtothrips dorsalis Hood[J]. Journal of Northeast Agricultural Sciences,43(5):38-40.]
李慧玲,张辉,王定锋,李良德,鄧福新,王庆森. 2014. 不同悬挂高度数字化色板对茶棍蓟马的诱集效果试验[J]. 茶叶科学技术,(4):45-46. [Li H L,Zhang H,Wang D F,Li L D,Deng F X,Wang Q S. 2014. Effects of different suspending heights of digital color boards on trapping Dendrothrips minowai Priesner[J]. Tea Science and Technology,(4):45-46.]
李貌,胡昌雄,吴道慧,陈国华,陈志星,殷红慧,徐天养,张晓明. 2020. 非施药植物上蓟马种群动态及优势种的生态位分析[J]. 河南农业大学学报,54(3):430-438. [Li M,Hu C X,Wu D H,Chen G H,Chen Z X,Yin H H,Xu T Y,Zhang X M. 2020. Population dynamics and niche analysis of dominant species of thrips in non-medicated plants[J]. Journal of Henan Agricultural University,54(3):430-438. ]
吕召云,郅军锐,周玉锋,孟泽洪,张骏,杨广明. 2015. 茶棍蓟马(Dendrothrips minowai Priesner)触角感器的扫描电镜观察[J]. 茶叶科学,35(2):185-195. [Lü Z Y,Zhi J R,Zhou Y F,Meng Z H,Zhang J,Yang G M. 2015. Scanning electron microscopic observations of antennal sensilla of tea stick thrips(Dendrothrips minowai Priesner)[J]. Journal of Tea Science,35(2): 185-195.]
彭萍,王小琴,李品武. 2013. 茶树病虫害测报与防治技术[M]. 北京: 中国农业出版社: 167. [Peng P,Wang X Q,Li P W. 2013. Pests forecast and control technology of tea plant[J]. Beijing:China Agriculture Press: 167.]
乔玮娜. 2012. DNA条形码技术在我国常见蓟马种类识别及西花蓟马传播扩散趋势分析中的应用[D]. 北京: 中国农业科学院. [Qiao W N. 2012. Application of DNA barcoding technology for species identification of common trips(Insecta:Thysanoptera) and spread trending analysis of Franklinella occodentialis in China[D]. Beijing: Chinese Academy of Agriculture Sciences.]
沈登荣,宋文菲,袁盛勇,田学军,和绍禹,张宏瑞. 2014. 蓟马科部分种类mtDNA-CO I序列变异及系统发育分析[J]. 应用昆虫学报,51(1):139-145. [Shen D R,Song W F,Yuan S Y,Tian X J,He S Y,Zhang H R. 2014. Phylogenetic analysis of some Thripidae species based on sequence variation in the mtDNA-CO I segment[J]. Chinese Journal of Applied Entomology,51(1): 139-145. ]
唐美君,肖强. 2018. 茶树病虫及天敌图谱[M]. 北京: 中国农业出版社:136.[Tang M J,Xiao Q. 2018. Colored pitiorial handbook of tea plant pests and natural enemies[J]. Beijing:China Agriculture Industry Press: 136.]
涂娟,金玲莉,谢枫,胡拥军,乐美旺,刘艳南. 2016. 不同黄、蓝板对茶园昆虫的诱捕效果[J]. 蚕桑茶叶通讯,(1):32-34. [Tu J,Jin L L,Xie F,Hu Y J,Yue M W,Liu Y N. 2016. Effects of yellow and blue trap boards on pests of tea garden[J]. Newsletter of Sericulture and Tea,(1):32-34.]
王洪涛,姜法祥,陈敏,王丽丽,王英姿. 2018. 不同颜色粘虫板对茶园主要害虫的诱集效果[J]. 中国植保导刊,38(6): 55-58. [Wang H T,Jiang F X,Chen M,Wang L L,Wang Y Z. 2018. Effects of different colors trap boards on main pests of tea garden[J]. China Plant Protection,38(6): 55-58.]
武晓云,程晓非,张仲凯. 2009. 西花蓟马(Frankliniella occidentalis) rDNA ITS2和CO I基因5'末端序列的克隆与比较分析[J]. 浙江大学学报(农业与生命科学版),35(4):355-364. [Wu X Y,Cheng X F,Zhang Z K. 2009. Clo-ning and comparative analysis of rDNA ITS2 and 5' terminal sequence of CO I gene of Frankliniella occidentalis[J]. Journal of Zhejiang University(Agriculture and Life Sciences),35(4):355-364.]
曾明森. 2019. 茶棍蓟马泡沫法施药防治试验[J].茶叶学报,60(2):75-79.[Zeng M S. 2019. Control of Dendrothrips Minowai Priesne with aqueou foam covering[J]. Acta Tea Sinica,60(2):75-79.]
张桂芬,乔玮娜,古君伶,闵亮,万方浩. 2014. 我国西花蓟马线粒体DNA-CO I基因变异及群体遗传结构分析[J]. 生物安全学报,23(3):196-209. [Zhang G F,Qiao W N,Gu J L,Min L,Wan F H. 2014. Genetic variability of mtDNA-CO I and population structure of Frankliniella occidentalis(Pergande) in China[J]. Journal of Biosafety,23(3):196-209.]
张莉,杨春,李帅,孟泽洪,赵兴丽,罗林丽,周玉锋. 2019. 贵州中部地区茶园茶棍蓟马的空间分布[J]. 贵州农业科学,47(12):52-54. [Zhang L,Yang C,Li S,Meng Z H,Zhao X L,Luo L L,Zhou Y F. 2019. Spatial distribution pattern of Dendrothrips minowai in tea garden in central Guizhou[J]. Guizhou Agricultural Sciences,47(12):52-54.]
張利娟,沈登荣,张宏瑞,张宏伟,李正跃. 2011. 蓟马基因组DNA提取方法的改进[J]. 应用昆虫学报,48(3):775-781. [Zhang L J,Shen D R,Zhang H R,Zhang H W,Li Z Y. 2011. Method improvement for extraction genomic DNA from thrips[J]. Chinese Journal of Applied Entomology,48(3):775-781.]
赵志清,陈流光. 1998. 茶棍蓟马的发生规律与防治技术[J]. 中国茶叶,(5):6-7. [Zhao Z Q,Chen L G. 1998. Deve-lopment regularity and control technique of Dendrothrips minowai[J]. China Tea,(5):6-7.]
Balloux F,Lugon-Moulin N. 2002. The estimation of population differentiation with microsatellite markers[J]. Mole-cular Ecology,11(2):155-165.
Bandelt H J,Forster P,R?hl A. 1999. Median-joining networks for inferring intraspecific phylogenies[J]. Molecular Biology and Evolution,16(1):37-48.
Brunner P C,Frey J E. 2010. Habitat-specific population structure in native western flower thrips Frankliniella occidentalis(Insecta,Thysanoptera)[J]. Journal of Evolutionary Biology,23(4):797-804.
Dickey A M,Vivek K,Hoddle M S,Funderburk J E,Kent M J,Antonella J C,Shatters R G,Osborne L S,Mckenzie C L,Mans B J. 2015. The Scirtothrips dorsalis species complex:Endemism and invasion in a global pest[J]. PLoS One 10(4):e0123747.
Dupanloup I,Schneider S,Excoffier L. 2002. A simulated annealing approach to define the genetic structure of populations [J]. Molecular Ecology,11(12):2571-2581.
Excoffier L,Lischer H E L. 2010. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows[J]. Molecular Ecology Resources,10(3):564-567.
Folmer O,Black M,Hoeh W,Lutz R,Vrijenhoek R. 1994. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates[J]. Molecular Marine Biology and Biotechnology,3(5):294-299.
Fu X Y. 1997. Statistical tests of neutrality of mutations against population growth,hitchhiking and background selection[J]. Genetics,147(2):915-925.
Harpending H C,Batzer M A,Gurven M,Jorde L B,Rogers A R,Sherry S T. 1998. Genetic traces of ancient demography[J]. Proceedings of the National Academy of Scien-ces of the United States of America,95(4):1961-1967.
Hua J M,Li M,Dong P Z,Cui Y,Xie Q,Bu W J. 2008. Comparative and phylogenomic studies on the mitochondrial genomes of Pentatomomorpha(Insecta: Hemiptera: Heteroptera)[J]. BMC Genomics,9(1):610.
Jermiin L S,Crozier R H. 1994. The cytochrome b region in the mitochondrial DNA of the ant Tetraponera rufoniger:Sequence divergence in Hymenoptera may be associated with nucleotide content[J]. Journal of Molecular Evolution,38(3):282-294.
Knight A,Mindell D P. 1993. Substitution bias,weighting of DNA sequence evolution,and the phylogenetic position of Fea s viper[J]. Systematic Biology,42(1):18-31.
Librado P,Rozas J. 2009. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data[J]. Bioinformatics(Oxford,England),25(11):1451-1452.
Lü Z Y,Zhi J R,Zhou Y F,Meng Z H,Yue W B. 2016. Genetic diversity and origin of Dendrothrips minowai (Thysanoptera: Thripidae) in Guizhou,China[J]. Journal of Asia-Pacific Entomology,19(4):1035-1043.
Nielsen R. 2005. Molecular signatures of natural selection [J]. Annual Review of Genetics,39(1):197-218.
Peterson M A,Dobler S,Holland J,Tantalo L,Locke S. 2001. Behavioral,molecular,and morphological evidence for a hybrid zone between Chrysochus auratus and C. cobaltinus(Coleoptera: Chrysomelidae)[J]. Annals of the Entomological Society of America,94(1):1-9.
Ramosonsins S E,Rozas J. 2002. Statistical properties of new neutrality tests against population growth[J]. Molecular Biology and Evolution,19(12):2092-2100.
Simon C,Frati F,Beckenbach A,Crespi B,Liu H,Flook P. 1994. Evolution,weighting,and phylogenetic utility of mitochondrial gene sequences and a compilation of conserved polymerase chain reaction primers[J]. Annals of the Entomological Society of America,87(6):651-701.
Tajima F. 1989. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics,123(3): 585-595.
Tamura K,Stecher G,Peterson D,Filipski A,Kumar S. 2013. MEGA 6:Molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution,30(12):2725-2729.
Yang X M,Sun J T,Xue X F,Li J B,Hong X Y. 2012a. Invasion genetics of the western flower thrips in China: Evidence for genetic bottleneck,hybridization and bridgehead effect[J]. PLoS One,4(7):e34567.
Yang X M,Sun J T,Xue X F,Zhu W C,Hong X Y. 2012b. Development and characterization of 18 novel EST-SSRs from the western flower thrips,Frankliniella occidentalis (Pergande)[J]. International Journal of Molecular Scien-ces,13(3):2863-2876.
(責任编辑 麻小燕)
