水稻B-box锌指蛋白基因OsBBX26的克隆及表达分析
2020-11-09邓军罗正良朱菲莹陈希方勇任鄄胜任光俊高方远
邓军 罗正良 朱菲莹 陈希 方勇 任鄄胜 任光俊 高方远


摘要:【目的】克隆水稻B-box鋅指蛋白基因(OsBBX26),并分析其在非生物胁迫下的表达模式,为探究水稻B-box蛋白的非生物胁迫响应机制提供理论依据。【方法】以水稻模式品种日本晴为材料,采用RT-PCR克隆OsBBX26基因,对其进行生物信息学分析,并通过构建pBA-OsBBX26-YFP植物表达载体进行亚细胞定位。同时,采用实时荧光定量PCR检测分析OsBBX26基因的组织特异性及非生物胁迫(干旱、ABA、低温和高盐)下的表达模式。【结果】克隆获得的OsBBX26基因(LOC_Os08g42440)cDNA全长序列为1467 bp,编码488个氨基酸,其编码蛋白分子量为51.86 kD,理论等电点(pI)为6.63,包含1个B-box锌指结构域和1个CCT结构域,其中B-box结构域位于第13~60位氨基酸,CCT结构域位于第435~478位氨基酸,该蛋白定位于细胞核中。OsBBX26基因位于8号染色体上,启动子区域除了含有TATA-Box和CAAT-Box等基本转录元件外,还含有与逆境相关的顺式作用元件,包括低温响应元件LTR、脱落酸响应元件ABRE、水杨酸响应元件TCA-element、厌氧响应元件ARE、茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif,以及MYB转录因子结合位点。OsBBX26蛋白与粳稻B-box蛋白亲缘关系最近,其次与籼稻B-box蛋白亲缘关系较近,与其他植物B-box蛋白也存在较高的相似性,其中与小米、大麦、高粱、玉米和短柄草B-box蛋白的氨基酸序列相似性分别达72%、72%、71%、69%和68%。OsBBX26基因在幼叶中的表达量最高,其次是在成熟叶片中,在幼根、成熟根、茎和幼穗中的表达量均极低,表明该基因表达具有明显的组织表达特异性。干旱、高盐、ABA和低温胁迫处理下OsBBX26基因均上调表达,干旱、高盐和ABA胁迫处理12 h达峰值,但低温胁迫处理在24 h后才达峰值。【结论】OsBBX26基因受干旱、高盐、ABA和低温胁迫诱导均上调表达,推测其参与水稻植株响应多种非生物胁迫,在逆境响应中发挥重要调控作用。
关键词: 水稻;B-box蛋白;克隆;非生物胁迫;表达分析;组织表达
中图分类号: S511.035.3 文献标志码: A 文章编号:2095-1191(2020)07-1606-08
Abstract:【Objective】The research cloned B-box zinc-finger protein gene(OsBBX26) from rice,analyzed its bioinformatics information and expression under abiotic stress,in order to provide a theoretical basis for the further study of the role of B-box protein in the abiotic stress response system of rice. 【Method】Taking rice variety Nipponbare as material, OsBBX26 gene was cloned by RT-PCR,bioinformatics was also conducted. pBA-OsBBX26-YFP expression vector was established for subcellular localization. At the same time,real-time fluorescent quantitative PCR was adopted for expressing OsBBX26 gene tissue specific expression and abiotic stress(drought,ABA,low temperature and high salt). 【Result】The full length cDNA sequence of OsBBX26 gene(LOC_Os08g42440) was 1467 bp which encoded 488 amino acids. Its molecular weights was 51.86 kD with isoelectric points(pI) being 6.63. This gene contained a B-box zinc finger domain which located in the 13-60 amino acids and a CCT domain located in the 435-478 amino acids. The subcellular localization analysis showed that OsBBX26 protein was in the nucleus, and OsBBX26 gene located on chromosome 8. The promoter regions contained not only the TATA-Box and CAAT-Box,but some adversity stress related cis elements,such as low temperature response element LTR,abscisic acid response element ABRE,salicylic acid response element TCA-element,anaerobic response element ARE,methyl jasmonic acid response element CGTCA-motif and TGACG-motif,and MYB transcription factor binding sites. Furthermore,the sequence alignment and phylogenetic tree analysis showed that OsBBX26 protein had the closest relationship with B-box protein of Japonica rice,followed by b-box protein of Indica rice,and had high similarity with B-box protein sequences of other plants,and the similarity with Setaria italica,Hordeum vulgare,Sorghum bicolor,Zea mays and Brachypodium distachyon reached 72%,72%,71%,69% and 68%,respectively. OsBBX26 was expressed the highest in young leaves,followed by mature leaves,and the expression level was very low in young roots,mature roots,stems and young ears. Moreover,results showed that the expression of OsBBX26 gene was up-regulated under drought,high salt,ABA and low temperature stresses. And the the maximum value was reached under drought,high salt and ABA treatment at 12 h while 24 h under low temperature treatment. 【Conclusion】OsBBX26 gene is up-regulated in response to drought,high salt,ABA and low temperature stresses. Therefore,it is speculated that OsBBX26 gene participates multiple abiotic stresses in rice and plays significant role in response to various abiotic stresses.
Key words: rice; B-box protein; cloning abiotic stresses; expression analysis;tissue expression
Foundation item: National Key Research and Development Program(2018YFD0301001); Agricultural Science and Technology Innovation Fund Project of Hunan(2018QN36)
0 引言
【研究意义】对植物生存和生长发育不利的环境因子可分为非生物胁迫(干旱、盐害、高温、低温、霜冻等)和生物胁迫(病虫害、杂草等),其中,非生物胁迫严重影响植物生长发育,是制约农作物产量的主要环境因素(郑晓瑜等,2011;曾露桂等,2020)。尤其是近年来,在全球气候变暖的大背景下,我国极端天气(高温、干旱、洪涝和冰冻等)频繁发生,导致作物产量下降,甚至死亡,对农业生产造成严重损失(向建华等,2012)。B-box(BBX)蛋白是植物生长发育过程中重要的转录因子,参与植物形态建成、花器官发育及逆境胁迫响应过程中的多种生命活动(Gangappa and Botto,2014)。水稻是世界上重要的粮食作物,克隆其B-box基因并分析其在逆境胁迫下的表达情况,可为深入研究水稻B-box基因参与非生物胁迫的响应机制提供理论参考,对提高水稻抗逆性及品种改良具有重要意义。【前人研究进展】B-box是锌指蛋白的亚家族成员之一,在N端包含由1或2个B-Box基序组成的B-box结构域,C端还含有1个特异的CCT结构域(CONSTANS、CO-like和TOC1)(Huang et al.,2012)。其中,拟南芥B-box蛋白家族由32个具有B-box结构域的蛋白组成,统一命名为AtBBX1~AtBBX32(Khanna et al.,2009);水稻B-box蛋白家族有30个成员,统一命名为OsBBX1~OsBBX30(Huang et al.,2012)。研究表明,B-box蛋白参与植物幼苗去黄化、下胚轴伸长、花青素产生、叶绿素积累、侧根伸长和子叶展开等光形态建成过程,且与植物光周期及花期的信号通路相关(Datta et al.,2006,2007,2008;Fan et al.,2012)。另外,B-box蛋白在抗生物胁迫和非生物胁迫方面发挥重要作用,可调控植物相关基因表达以抵抗逆境胁迫。拟南芥AtBBX24/STO蛋白参与植株盐胁迫信号通路,可提高转AtBBX24/STO基因酵母对高盐的耐受性(Indorf et al.,2007);AtBBX18基因下调表达后能增强植物的耐热性,但超表达后耐热性减弱(Wang et al.,2012);转水稻OsBBX25基因的拟南芥植株过表达可显著提高其耐盐性(刘焱等,2012)。近年来,油菜(胡茂龙等,2016)、水稻(骆鹰等,2017;黎妮等,2019)、山梨(王日红等,2019)等植物的B-box基因功能已得到研究与鉴定,均证实其与非生物逆境胁迫密切相关。【本研究切入点】目前,有关水稻B-box基因家族成员如OsBBX6和OsBBX22(骆鹰等,2017)等基因功能的研究相对较少,对其在非生物胁迫中的作用机制尚不清楚,且未见有关水稻OsBBX26基因克隆及表达分析的研究报道。【拟解决的关键问题】以水稻模式品种日本晴为材料,采用RT-PCR克隆OsBBX26基因并进行生物信息学分析,构建GFP表达载体并进行亚细胞定位分析,同时通过实时荧光定量PCR检测分析OsBBX26基因的组织表达特异性及非生物胁迫下的表达模式,为进一步了解水稻B-box基因在非生物胁迫中的响应机制提供理论依据,也为水稻抗逆分子育种提供新的基因资源。
1 材料与方法
1. 1 试验材料
供试水稻品种为日本晴,其种子由四川省农业科学院作物研究所提供。扩增引物委托生工生物工程(上海)股份有限公司合成。克隆载体Trans-T1和pEASY-Blunt购自北京全式金生物技术有限公司;RNA提取试剂盒、胶回收试剂盒和质粒提取试剂盒购自OMEGA公司;荧光定量PCR试剂购自瑞士Roche公司;cDNA第一链合成试剂盒、限制性内切酶和高保真酶购自宝生物工程(大连)有限公司(TaKaRa);大肠杆菌DH5α由湖南省农业生物技术研究所实验室保存提供。
1. 2 材料处理
选取饱满日本晴种子,用清水冲洗并浸泡48 h后置于35 ℃培养箱催芽。将催芽后露白的种子平铺在垫有湿润滤纸的培养皿中,于28 ℃、16 h光照/8 h黑暗的条件下培养至3叶期。取部分水稻幼苗分别进行干旱(15% PEG-8000)、高盐(200 mmol/L NaCl)、脱落酸(ABA,100 μmol/L)及低温(4 ℃)等胁迫处理,以不作胁迫处理的水稻幼苗为对照,在胁迫处理0、2、4、6、8、10、12和24 h时分别剪取幼根和幼叶各100 mg,用液氮速冻后-80 ℃保存,用于非生物胁迫下OsBBX26基因表达分析。此外,取20株水稻幼苗移栽于湖南省农业科学院高桥基地,常规田间管理,分别于3叶期取幼叶和幼根,孕穗期取幼穗及成熟的根、茎、叶,用液氮速冻后-80 ℃保存,用于基因组织特异性分析。上述材料均进行3次重复取样。
1. 3 总RNA提取及cDNA合成
取100 mg水稻组织样品在液氮中速冻并研碎,参照植物RNA提取试剂盒说明抽提总RNA,使用核酸蛋白仪测定RNA浓度,用1%琼脂糖凝胶电泳检测其完整性。然后将提取质量较好的RNA反转录合成cDNA第一链,-20 ℃保存备用。
1. 4 基因克隆
以水稻基因组中OsBBX26基因序列(LOC_Os08g 42440)為参考序列,采用Primer Premier 5.0设计2对巢式PCR引物(G2OE-F1:5'-CAAAAGTCGTCGT AGACCCCC-3';G2OE-R1:5'-GCATGGATATGCCT ATCAGAAT-3'和G2OE-F2:5-CCCAAAGCTTGGT TTGCGAGATGAAGGATG-3';G2OE-R2:5'-GCTT CTA GAATCAGGGATTGCAGGGATGA-3')。以日本晴3叶期叶片cDNA为模板,采用Primer STAR高保真酶进行第一次巢式PCR扩增。反应体系25.00 μL:1.00 μL cDNA模板,10 μmol/L上、下游引物各1.00 μL、10×Buffer 2.50 μL,dNTPs 2.00 μL,Primer STAR高保真酶0.25 μL,用ddH2O补足至25.00 μL。扩增程序:98 ℃预变性3 min;98 ℃ 10 s,57 ℃ 15 s,72 ℃ 90 s,共进行34个循环;72 ℃延伸5 min,12 ℃保存。取第一次PCR产物1.00 μL为模板进行第二次巢式PCR,反应体系和扩增程序同第一次巢式PCR。PCR产物经1%琼脂糖凝胶电泳检测后,用胶回收试剂盒回收纯化目的片段,连接到pEASY-Blunt克隆载体上,热激转化大肠杆菌DH5α感受态细胞,通过蓝白斑筛选和菌落PCR鉴定,将阳性克隆送生工生物工程(上海)股份有限公司测序。
1. 5 生物信息学分析
采用DNAMAN 6.0进行基因序列分析及多序列比对。利用水稻基因组注释数据库(http://rice.plantbiology.msu.edu/cgi-bin/gbrowse/rice/#search)预测分析OsBBX26基因的开放阅读框(ORF)及其编码蛋白的理论等电点(pI)和分子量;在PlantCARE对基因启动子区域进行顺式作用元件分析;通过NCBI数据库对OsBBX26蛋白的氨基酸序列进行BLASTp同源比对,选取其他植物中相似性高的蛋白氨基酸序列,用ClustalX 2.1进行多序列比对,并以MEGA 5.0构建系统发育进化树。
1. 6 亚细胞定位
根据OsBBX26基因的ORF序列,采用Primer Premier 5.0设计亚细胞定位表达载体引物OsBBX26-F:5'-CCCTCGAGATGAAGGATGGTGGTGGAGG A-3'(下劃线处为Xho I酶切位点);OsBBX26-R:5'-C GGGATCCCCCGCCATTGCTGACATCATC-3'(下划线处为BamH I酶切位点),其中,下游引物Os-BBX26-R不包含终止密码子。PCR反应体系和扩增程序同1.4,连接至pEASY-Blunt克隆载体上,热激转化DH5α感受态细胞,挑选阳性克隆送至生工生物工程(上海)股份有限公司测序。用Xho I和BamH I双酶切pEASY-Blunt-OsBBX26质粒与pBA-YFP表达载体质粒,回收目的片段与pBA-YFP载体连接后转化DH5α感受态细胞,经菌落PCR鉴定阳性克隆,再提取其质粒进行双酶切鉴定,挑选酶切鉴定正确的阳性单克隆进行测序(腾海艳,2020)。重组质粒命名为pBA-OsBBX26-YFP,最后利用Biolistic PDS-1000/He基因枪轰击洋葱表皮细胞,25 ℃培养16 h(朱建楚等,2003;腾海艳,2020),然后采用激光共聚焦显微镜观察并拍照。
1. 7 实时荧光定量PCR
根据OsBBX26基因cDNA序列,采用Primer Premier 5.0设计荧光定量PCR引物(G2RT-F:5'-AG TG CCACCAACCCAGATA-3';G2RT-R:5'-TCGTTGTC CCAGAAGAAATC-3'),在LightCycler[?] 96 Instrument型荧光定量PCR仪中进行实时荧光定量PCR检测。反应体系20.00 μL:包括cDNA模板2.00 μL,10 μmol/L上、下游引物各0.40 μL,2×SybrGreen qPCR Mix 10.00 μL,用蒸馏水补足至20.00 μL。扩增程序:95 ℃预变性1 min;95 ℃ 7 s,55 ℃ 20 s,72 ℃ 15 s,进行40个循环。以水稻actin基因作为内参,其引物为actin-F:5'-CCACTATGTTCCCTGGCATT-3';actin-R:5'-GTACTCAGCCTTGGCAATCC-3'。采用2-??Ct法计算基因相对表达量。
2 结果与分析
2. 1 OsBBX26基因克隆及序列分析结果
以日本晴3叶期叶片cDNA为模板进行巢式PCR扩增,获得1条约1500 bp的片段(图1)。经过测序、拼接和验证,获得OsBBX26基因cDNA全长序列为1467 bp,编码488个氨基酸残基,其编码蛋白分子量为51.86 kD,pI为6.63,该蛋白包含1个B-box结构域和1个CCT结构域,其中,B-box结构域位于第13~60位氨基酸,CCT结构域位于第435~478位氨基酸(图2)。
2. 2 OsBBX26基因启动子顺式作用元件分析结果
OsBBX26基因(LOC_Os08g42440)位于水稻8号染色体上,其启动子区域顺式作用元件分析结果显示,除了含有TATA-Box和CAAT-Box等基本转录元件外,还含有与逆境相关的顺式作用元件,包括低温响应元件LTR、脱落酸响应元件ABRE、水杨酸响应元件TCA-element、厌氧响应元件ARE、茉莉酸甲酯响应元件CGTCA-motif和TGACG-motif,以及MYB转录因子结合位点。此外,含有大量光响应元件,如MRE、BOX4、TCT-motif、GT1-motif、G-Box、ATC-motif和AE-box等。
2. 3 OsBBX26蛋白同源比对及系统发育进化树分析结果
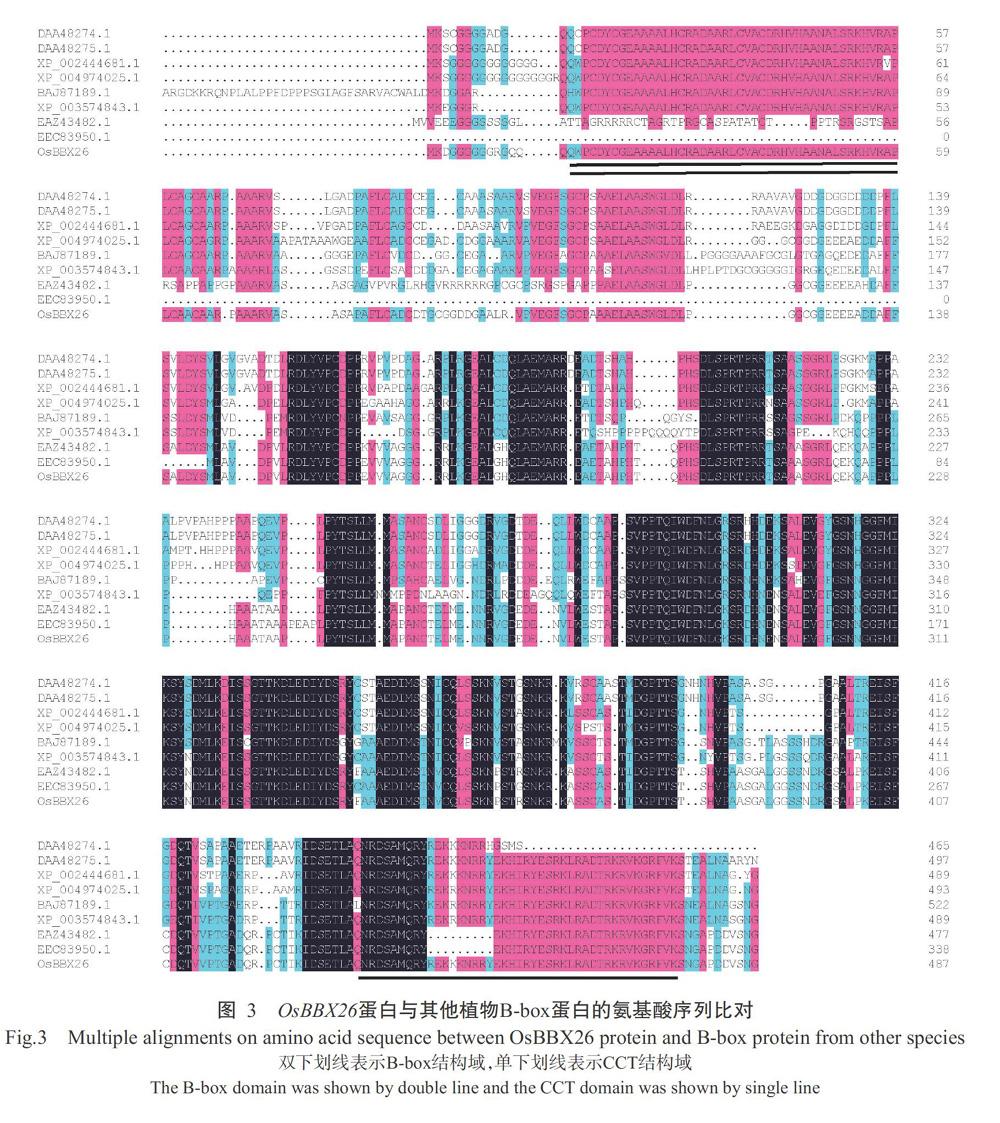
通过NCBI数据库进行BLASTp同源比对,结果发现,OsBBX26蛋白与其他植物B-box蛋白具有较高的相似性,其中与小米(Setaria italic)CONSTANS-LIKE 15-like(XP_004974025.1)、大麦(Hordeum vulgare subsp. Vulgare)partial predicted protein(BAJ87 189.1)、高粱(Sorghum bicolor)SORBIDRAFT_07g 025940(XP_002444681.1)、玉米(Zea mays)ZEAM MB73_333025(DAA48275.1)和短柄草(Brachypodium distachyon)CONSTANS-LIKE14-like(XP_003574843.1)的氨基酸序列性分别达72%、72%、71%、69%和68%(图3)。系统发育进化树分析结果显示,OsBBX26蛋白与粳稻(Oryza sativa Japonic)OsJ_28089(EAZ43482.1)亲缘关系最近,其次是与籼稻(O. sativa Indica)OsI_30045(EEC83950.1)(图4)。
2. 4 OsBBX26蛋白亚细胞定位分析结果
利用基因枪法在洋葱表皮细胞中瞬时表达OsBBX26-YFP融合蛋白。使用激光共聚焦显微镜在白光(明场)、荧光(暗场)及合成(白光+荧光)3种条件下进行观察,发现OsBBX26-YFP融合蛋白主要在细胞核内表达(图5),说明OsBBX26蛋白定位于细胞核中。
2. 5 OsBBX26基因的组织表达分析结果
实时荧光定量PCR检测OsBBX26基因在水稻不同组织中的表达情况,结果显示,OsBBX26基因在幼叶中表达量最高,其次是在成熟叶片,在幼根、成熟根、成熟茎和幼穗中表达量均极低(图6),表明Os-BBX26基因具有明显的组织表达特异性。
2. 6 非生物胁迫处理下OsBBX26基因的表达模式
干旱、高盐、ABA和低温胁迫处理下,日本晴幼根和幼叶中OsBBX26基因的表达模式分析结果如图7所示。在4种胁迫处理下,OsBBX26基因表达量在幼根中无明显变化,均表达量极低,但在幼叶中表达量存在明显差异,其中ABA和干旱胁迫处理0~12 h OsBBX26基因表达量整体上呈上升趋势,均在胁迫处理12 h达峰值,胁迫处理24 h降至最低值,但干旱胁迫处理后OsBBX26基因表达量明显高于ABA胁迫处理;高盐和低温胁迫处理0~24 h,OsBBX26基因的表达量均呈波动式变化,但不同的是,高盐胁迫处理6~12 h的表达量较其他时间点高,胁迫处理12 h达峰值,胁迫处理24 h降至最低值,而低温胁迫处理6~24 h的表达量较其他时间点高,且呈先降低后升高的变化趋势,于胁迫处理24 h达峰值,低温胁迫下Os-BBX26基因表达量整体高于高盐胁迫。综上所述,水稻幼叶OsBBX26基因在低温、高盐、ABA和干旱胁迫响应中均发挥重要作用。
3 讨论
锌指蛋白是一类重要的转录因子,是植物转录因子中相对较大的基因家族(约占转录因子总数的15%),在调控植物生长发育和响应逆境胁迫过程中发挥重要作用(Liu et al.,2007;Kim et al.,2008;Jan et al.,2013;姚琦园等,2018)。B-box蛋白是锌指蛋白的亚家族成员之一,是植物生长发育过程中重要转录因子,当植物受逆境胁迫后能诱导该蛋白基因上调表达,表明B-box蛋白在逆境响应中发挥重要作用。宁露云等(2014)研究发现,矮牵牛PhBBX8基因在低温、干旱、ABA、茉莉酸甲酯(MeJA)、高鹽和高渗透胁迫处理下不同程度上调表达,故推测该基因参与矮牵牛非生物胁迫响应;王日红等(2019)研究发现,山梨PuBBX24基因在ABA、光、低温、高渗透及高盐胁迫处理下显著上调表达,表明山梨PUBBX24可能参与ABA、光及非生物胁迫响应。本研究结果表明,OsBBX26基因在水稻受到干旱、高盐、ABA和低温胁迫后均能诱导上调表达,说明OsBBX26基因是正调控响应非生物胁迫,与上述研究结果基本一致。但黎妮等(2019)研究发现,水稻OsBBX13基因在逆境胁迫下呈下调表达,表明其可能负调控响应非生物胁迫。此外,B-box锌指蛋白基因在不同逆境胁迫下的表达量及峰值出现时间存在明显差异。刘焱等(2012)研究结果显示,水稻OsBBX25基因表达量分别在高盐胁迫4 h后达峰值,干旱胁迫1 h后达峰值,ABA胁迫3 h后达峰值;窦锦青等(2015)研究发现,低温、干旱、ABA和盐胁迫等非生物逆境可诱导BLCOL13基因表达,其表达量分别在干旱胁迫后12 h达峰值,低温胁迫后24 h达峰值,盐胁迫后6 h达峰值;胡茂龙等(2016)研究发现,高盐、干旱和高温能显著诱导油菜BnSTO-1和BnSTO-2基因表达,但出现峰值的时间不同,BnSTO-1和BnSTO-2基因表达量分别在高盐胁迫6 h后达峰值,干旱胁迫3 h后达峰值,高温胁迫12 h后达峰值。本研究结果显示,Os-BBX26基因在表达量均在干旱、高盐和ABA胁迫处理后12 h达峰值,但低温胁迫处理24 h后达峰值。综上所述,推测不同物种不同B-box基因对非生物胁迫响应机制不同。本研究后续工作将构建植物过表达载体和基因编辑载体并遗传转化水稻,从而验证OsBBX26基因在水稻非生物胁迫中的调控功能。
4 结论
OsBBX26基因受干旱、高盐、ABA和低温胁迫诱导均上调表达,推测其参与水稻植株响应多种非生物胁迫,在逆境响应中发挥重要作用。
参考文献:
窦锦青,程龙军,徐凤华,张俊红,童再康. 2015. 光皮桦BBX类基因BICOL13的克隆与表达分析[J]. 园艺学报,42(7):1367-1377. [Dou J Q,Cheng L J,Xu F H,Zhang J H,Tong Z K. 2015. Cloning and expression analysis of a B-box-type protein gene BICOL13 in Betula luminifera[J]. Acta Horticulturae Sinica,42(7):1367-1377.]
胡茂龙,龙卫华,高建芹,张洁夫,陈松,浦惠明. 2016. 油菜B-box型锌指蛋白基因BnSTO的克隆和表达[J]. 中国农学通报,32(36):96-103. [Hu M L,Long W H,Gao J Q,Zhang J F,Chen S,Pu H M. 2016. Cloning and expression of BnSTO encoding B-box-type zinc-finger proteins in rapeseed[J]. Chinese Agricultural Science Bulletin,32(36):96-103.]
黎妮,张超,王伟平. 2019. 水稻锌指蛋白基因OsBBX13的克隆、表达及生物信息学分析[J]. 分子植物育种,17(5):1393-1400. [Li N,Zhang C,Wang W P. 2019. Cloning,expression and bioinformatics analysis of zinc finger protein gene OsBBX13 in rice[J]. Molecular Plant Breeding,17(5):1393-1400.]
刘焱,邢立静,李俊华,戴绍军. 2012. 水稻含有B-box锌指结构域的OsBBX25蛋白参与植物对非生物胁迫的响应[J]. 植物学报,47(4):366-378. [Liu Y,Xing L J,Li J H,Dai S J. 2012. Rice B-box zinc finger protein OsBBX25 is involved in the abiotic response[J]. Chinese Bulletin of Bo-tany,47(4):366-378.]
骆鹰,谢旻,张超,王伟平,朱建华,万向元,汪启明,饶力群. 2018. 水稻锌指蛋白基因OsBBX22响应热胁迫的功能分析[J]. 基因组学与应用生物学,37(2):836-844. [Luo Y,Xie M,Zhang C,Wang W P,Zhu J H,Wan X Y,Wang Q M,Rao L Q. 2017. Function analysis of rice zinc finger protein gene OsBBX22 in response to heat stress[J]. Genomics and Applied Biology,37(2):836-844.]
宁露云,李蓓,李佩,包满珠,张蔚. 2014. 矮牵牛B-box型锌指蛋白基因PhBBX8的克隆与表达分析[J]. 园艺学报,41(12):2437-2445. [Ning L Y,Li B,Li P,Bao M Z,Zhang W. 2014. Cloning and expression analysis of a B-box-type zinc-finger protein gene PhBBX8 in Petunia hybrid[J]. Acta Horticulturae Sinica,41(12):2437-2445.]
腾海艳. 2020. 水稻Ossp1基因的亚细胞定位及其干旱条件下的表达[J]. 江苏农业学报,36(3):529-534. [Teng H Y. 2020. Subcellular localization and expression under drou-ght conditions of rice Ossp1 gene[J]. Jiangsu Journal of Agricultural Sciences,36(3):529-534.]
王日红,宋敏燕,王然,杨英杰. 2019. 山梨B-box基因PuBBX24表达特性及其在童期调控中的功能分析[J]. 园艺学报,46(8):1458-1472. [Wang R H,Song M Y,Wang R,Yang Y J. 2019. Expression pattern and function in juvenile regulation of B-box gene PuBBX24 in Pyrus ussuriensis[J]. Acta Horticulturae Sinica,46(8):1458-1472.]
向建华,李灵之,陈信波. 2012. 植物非生物逆境相关锌指蛋白基因的研究进展[J]. 核农学报,26(4):666-672. [Xiang J H,Li L Z,Chen X B. 2012. Progress in the study of abio-tic stress-related zinc finger protein genes in plants[J]. Journal of Nuclear Agricultural Sciences,26(4):666-672.]
姚琦园,李纷芬,张林成,周升恩. 2018. 植物MADS-box转录因子参与调控非生物胁迫的研究进展[J]. 江西农业学报,30(5):73-79. [Yao Q Y,Li F F,Zhang L C,Zhou S E. 2018. Research progress in MADS-box transcription factors involved in regulation of abiotic stress of plants[J]. Acta Agriculturae Jiangxi,30(5):73-79.]
曾露桂,羅倩,吴宇瑶,聂琼. 2020. 烟草转录因子NtMYC2对激素及非生物因素胁迫的响应[J]. 河南农业大学学报,54(3):386-391. [Zeng L G,Luo Q,Wu Y Y,Nie Q. 2020. Response of tobacco transcription factor NtMYC2 to hormone and abiotic stress[J]. Journal of Henan Agricultural University,54(3):386-391.]
郑晓瑜,郭晋艳,张毅,李秋莉. 2011. 植物非生物胁迫诱导启动子顺式作用元件的研究方法[J]. 植物生理学报,47(2):129-135. [Zheng X Y,Guo J Y,Zhang Y,Li Q L. 2011. Research methods of cis-acting elements in plant abiotic stress inducible promoters[J]. Plant Physiology Journal,47(2):129-135.]
朱建楚,布都会,于新智,王新中. 2003. Biolistic PDS-1000/He基因枪的使用方法[J]. 陕西农业科学,(6)81-82. [Zhu J C,Bu D H,Yu X Z,Wang X Z. 2003. The usage me-thod of Biolistic pds-1000/He gene gun[J]. Shaanxi Journal of Agricultural Sciences,(6):81-82.]
Datta S,Hettiarachchi C,Johansson H,Holm M. 2007. SALT TOLERANCE HOMOLOG2,a B-box protein in Arabidopsis that activates transcription and positively regulates light-mediated development[J]. The Plant Cell,19(10):3242-3255.
Datta S,Johansson H,Hettiarachchi C,Irigoyen M L,Desai M,Rubio V,Holm M. 2008. LZF1/SALT TOLERANCE HOMOLOG3,an Arabidopsis B-box protein involved in light-dependent development and gene expression,undergoes COP1-mediated ubiquitination[J]. The Plant Cell,20(9):2324-2338.
Datta S,Hettiarachchi G H,Deng X W,Holm M. 2006. Arabidopsis CONSTANS-LIKE3 is a positive regulator of red light signaling and root growth[J]. The Plant Cell,18(1):70-84.
Fan X Y,Sun Y,Cao D M,Bai M Y,Luo X M,Yang H J,Wei C Q,Zhu S W,Sun Y,Chong K,Wang Z Y. 2012. BZS1,a B-box protein,promotes photomorphogenesis downstream of both brassinosteroid and light signaling pathways[J]. Molecular Plant,5(3):591-600.
Gangappa S N,Botto J F. 2014. The BBX family of plant transcription factors[J]. Trends Plant Science,19(7):460-470.
Huang J Y,Zhao X B,Weng X Y,Wang L,Xie W B. 2012. The rice B-box zinc finger gene family:Genomic identification,characterization,expression profiling and diurnal analysis[J]. PLoS One,7(10):e48242.
Indorf M,Cordero J,Neuhaus G,Rodríguez-Franco M. 2007. Salt tolerance(STO),a stress-related protein,has a major role in light signaling[J]. The Plant Journal,51(4):563-574.
Jan A,Maruyama K,Todaka D,Kidokoro S,Abo M,Yoshimura E,Shinozaki K,Nakashima K,Yamaguchi-Shinozaki K. 2013. OsTZF1,a CCCH-tandem zinc finger protein,confers delayed senescence and stress tolerance in rice by regulating stress-related genes[J]. Plant Physiology,161(3):1202-1216.
Khanna R,Kronmiller B,Maszle D R. 2009. The Arabidopsis B-box zinc finger family[J]. The Plant Cell,21(11):3416-3420.
Kim S K,Yun C H,Lee J H,Jang Y H,Park H Y,Kim J K. 2008. OsCO3,a CONSTANS-LIKE gene,controls flowe-ring by negatively regulating the expression of FT-like genes under SD conditions in rice[J]. Planta,228(2):355-365.
Liu K,Wang L,Xu Y,Chen N,Ma Q,Li F,Chong K. 2007. Overexpression of OsCOIN,a putative cold inducible zinc finger protein,increased tolerance to chilling,salt and drought,and enhanced proline level in rice[J]. Planta,226(4):1007-1016.
Wang Q M,Tu X J,Zhang J H,Chen X B,Rao L Q. 2012. Heat stress-induced BBX18 negatively regulates the thermo tolerance in Arabidopsis[J]. Molecular Biology Reports,40(3):2679-2688.
(責任编辑 陈 燕)
