血府逐瘀汤对肺纤维化大鼠肺组织上皮间质转化的影响及其机制研究
2020-11-09武运邦谢红王金义肖开苹潘欣阳杨邯捷赵惠亮渠景连
武运邦 谢红 王金义 肖开苹 潘欣阳 杨邯捷 赵惠亮 渠景连


【摘 要】 目的:研究血府逐瘀湯对肺纤维化(PF)大鼠肺组织上皮间质转化(EMT)的影响,并探讨其可能机制。方法:将48只雄性SD大鼠随机分为正常组、模型组、地塞米松组(0.000405 g·kg-1·d-1)和血府逐瘀汤高、中、低剂量组(14.04、7.02、3.51 g·kg-1·d-1),每组8只。除正常组外,其余各组大鼠均于气管内滴注博来霉素溶液建立PF模型。造模后第2天开始灌胃给药,正常组和模型组予蒸馏水溶液(10 mL·kg-1·d-1);各给药组灌胃相应药物,每日1次,连续28 d。末次给药24 h后,采用免疫组化法检测大鼠肺组织中E-钙黏蛋白(E-cadherin)和α-平滑肌肌动蛋白(α-SMA)的表达情况,采用Western blot法检测大鼠肺组织中TGF-β1、Smad3的表达情况。结果:模型组大鼠肺组织E-cadherin表达显著低于正常组(P<0.01),而α-SMA、TGF-β1、Smad3表达均显著高于正常组(P<0.01);与模型组比较,血府逐瘀汤高、中、低剂量组肺组织E-cadherin表达显著升高(P<0.05或P<0.01),而α-SMA、TGF-β1、Smad3表达均显著降低(P<0.05或P<0.01);与地塞米松组比较,血府逐瘀汤低剂量组的E-cadherin表达显著降低(P<0.05),而α-SMA、TGF-β1、Smad3表达均显著升高(P<0.05或P<0.01)。结论:血府逐瘀汤可通过干预上皮间质转化来减轻肺纤维化,其机制可能与抑制TGF-β1/Smad3信号通路有关。
【关键词】 血府逐瘀汤;肺纤维化;上皮间质转化
【中图分类号】R285 【文献标志码】 A 【文章编号】1007-8517(2020)17-0011-06
Abstract:Objective To investigate the effects of Xuefu Zhuyu Tang on epithelial-mesenchymal transition (EMT) of lung tissue in pulmonary fibrosis(PF) model rats,and to explore its potential mechanism. Methods 48 Male SD rats were randomly divided into normal group, model group, dexamethasone group(0.000405 g·kg-1·d-1), Xuefu Zhuyu Tang high-dose, medium-dose and low-dose groups(14.04、7.02、3.51 g·kg-1·d-1), with 8 rats in each group. Except for normal group, other groups were given endotracheal injection of bleomycin to induce PF model. On the second day after modeling, normal group and modelgroup were given water intragastrically (10 mL·kg-1·d-1), administration groups were given relevant medicine intragastrically, once a day, for consecutive 28 days. 24hs after last medication, the expression of E-cadherin and α-SMA in lung tissue of rats were detected by immunohistochemistry method. The expression of TGF-β1 and Smad3 were detected by Western blotting assay. Results Compared with normal group, the expression of E-cadherin were decreased significantly in lung tissue of model group(P<0.01), while the expression of α-SMA, TGF-β1 and Smad3 were increased significantly(P<0.01). Compared with model group, the expression of E-cadherin in lung tissue of rats were increased significantly in Xuefu Zhuyu Tang high-dose, medium-dose and low-dose groups(P<0.05 or P<0.01), while the expression of α-SMA, TGF-β1 and Smad3 were decreased significantly(P<0.05 or P<0.01). Compared with dexamethasone group, the expression of E-cadherin were decreased significantly, the expressipon of α-SMA, TGF-β1 and Smad3 were increased significantly(P<0.01). Conclusion Xuefu Zhuyu Tang can relieve PF of model rats by intervening in EMT,the mechanism of which may be associated with inhibiting TGF-β1/Smad3 signaling pathway.
Keywords:Xuefu Zhuyu Tang; Pulmonary Fibrosis; Epithelial-Mesenchymal Transition
肺纤维化(Pulmonary Fibrosis,PF)是一种多病因且发病机制不明确的肺部疾病,其主要病理变化是初期的弥漫性肺泡炎和后期的成纤维细胞增殖、转化以及细胞外基质的过度沉积[1]。其中,肺泡上皮细胞的易损性、异常重塑、表型改变是肺纤维化发生的关键[2]。上皮间质转化(Epithelial-mesenchymal Transition,EMT)是上皮细胞向间质表型转化的过程,在这一过程中,上皮细胞标志物如E-钙黏蛋白(E-cadherin) 逐渐丢失,而间质细胞标志物如α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达升高[3]。研究表明,EMT与肺纤维化密切相关,它被证明是肌成纤维细胞的主要来源,而肌成纤维细胞通过分泌细胞外基质参与组织纤维化[4]。在EMT过程中,转化生长因子-β(transforming growth factor-β,TGF-β)信号通路被激活,Smad3作为TGF-β信号通路中一个重要的组成部分,对于TGF-β1介导的EMT极其重要[5]。
中医学理论认为肺纤维化的病变实质是“肺络瘀滞”,故活血化瘀通络是该病的主要治法。血府逐瘀汤出自于清代医家王清任《医林改错》,是活血化瘀的代表方剂。临床研究表明,血府逐瘀汤对肺纤维化的抑制与改善作用明显[6-7],关于该方药理作用的研究也逐渐增多,但尚未见从EMT角度进行研究的报道。本研究以EMT为切入点,探讨血府逐瘀汤对PF模型大鼠肺组织EMT的影响,并从TGF-β1/Smad3出发进一步分析其可能机制,以期为阐明该方防治PF的作用机制提供参考。
1 材料
1.1 动物 SPF级SD大鼠48只,雄性,体质量(200±20)g,购自长沙市天勤生物技术有限公司,合格证号:SCXK(湘)2014-0011。
1.2 药物与试剂 血府逐瘀汤由桃仁、川芎、桔梗、赤芍、枳壳、甘草、柴胡、红花、当归、生地黄、牛膝组成,药物购自贵阳同仁堂药房。其中:桃仁(批号:170401, 产地:山东);川芎(批号:170701, 产地:安徽);桔梗(批号:170301, 产地:安徽);赤芍(批号:170401 ,产地:内蒙古);枳壳(批号:170401,产地:江西);甘草(批号:180301,产地:新疆);柴胡(批号:170301,产地:山西);红花(批号:171201,产地:新疆);当归(批号:170701,产地:甘肃);生地黄(批号:171201,产地:河南);牛膝(批号:170401,产地:河南)。分别煎制浓缩为含生药0.351、0.702、1.404 g·mL-1的合剂,每次制备3 d药量,4 ℃冰箱保存备用。
醋酸地塞米松片(批号:151238,浙江仙琚制药股份有限公司);博来霉素(批号:16032311,海正辉瑞制药有限公司);α-SMA抗体(一抗,兔源,批号:AG02247616,北京博奥森生物技术公司);Smad3抗体(一抗,兔源,批号:GR3190902-12,英国abcam公司) ;TGF-β1抗体(一抗,兔源,批号:55e6713,Affinity公司);E-钙黏蛋白(E-cadherin)抗体(一抗,兔源,批号:18k0657,Affinity公司);β-actin抗体(一抗,小鼠源,批号:48k2671)、山羊抗兔辣根过氧化酶标记二抗(批号:3825j63)、山羊抗小鼠辣根过氧化酶标记二抗(批号:1292k61)均购自美国Affinity Biosciences公司;Mayer苏木素染液(批号:20170526)、DAB显色试剂盒(批号:20170511)均购自北京索莱宝科技有限公司;BCA蛋白定量试剂盒(批号:SE248353,美国Thermo Scientific公司);ECL发光液(批号:1716501)、PVDF膜(批号:MB0323)均购自默克密理博有限公司。
1.3 主要仪器 Allegra X-30R离心机(美国BECKMAN公司);GNP-9080隔水式电热恒温培养箱(苏州威尔实验用品有限公司);1150H石蜡包埋机(德国Leica公司);RM2265轮转切片机(德国Leica公司);PL303电子天平(梅特勒-托利多仪器公司);BX 53显微图像采集系统(日本OLYMPUS公司);PowerPacTMBasic电泳仪(美国Bio-Rad公司);ChemiDocTM XRS+with Image LabTM Software凝胶成像系统(美国Bio-Rad 公司)等。
2 方法
2.1 动物分组及模型制备 将大鼠常规适应性饲养7d后,随机分为6组:正常组、模型组、地塞米松组、血府逐瘀汤高、中、低剂量组,每组8只。除正常组外,其余各组均采用气管滴注博来霉素复制PF模型[8]:用10%水合氯醛3 mL·kg-1麻醉大鼠后,颈部皮肤消毒,剪去颈部鼠毛,行颈正中切口,分离暴露气管。经气管软骨环间隙向心端穿刺注入博来霉素5 mg /kg,在注射过程中必须非常缓慢的注入,并且边注射边观察大鼠胸廓的起伏,防止堵塞气道,导致大鼠的死亡。注射完成后立即将动物直立并旋转,使药液在肺内分布充分、均匀,然后缝合皮肤。正常组动物在同样条件下注入等量生理盐水。术后让大鼠自由饮水、进食。
2.2 给
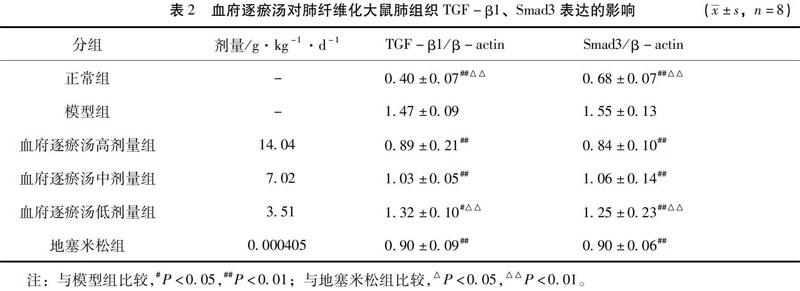
3.2 血府逐瘀汤对肺纤维化大鼠肺组织TGF-β1、Smad3表达的影响 模型组大鼠肺组织TGF-β1、Smad3的表达显著高于正常组(P<0.01)。与模型组比较,血府逐瘀汤高、中、低剂量组肺组织TGF-β1、Smad3表达均显著降低(P<0.05或P<0.01);与地塞米松组比较,血府逐瘀汤低剂量组的TGF-β1、Smad3表达显著升高(P<0.01)。見表2、图3。
4 討论
PF是肺组织受损后人体自身修复的结果,也是以成纤维细胞增殖以及细胞外基质过度沉积并伴炎症损伤、组织结构破坏为特征的多种肺部疾病的最终结局。临床主要表现为干咳、进行性呼吸困难,且随着病情加重,呼吸功能不断恶化,严重影响患者的生活质量。如前所述,EMT是上皮细胞在形态学上发生间充质细胞表型的转变,其在PF和肌成纤维细胞活化的发展中起关键作用。EMT发生时,上皮细胞极性消失,上皮细胞标志物下调,细胞骨架重排,迁移和运动能力增强,同时获得间质细胞特性,间质细胞标志物上调[3]。
研究表明,多种细胞因子参与了EMT过程,尤其是TGF-β1,是目前公认的促进EMT的核心细胞因子[9],在此过程中,TGF-β1促进了上皮细胞表型的丢失。TGF-β1介导EMT的途径众多,但主要依赖Smad途径[10]。Smad蛋白家族是一类细胞内TGF-β受体激酶的底物[11],其本身既是转录因子,也是其他转录因子如Slug、Snail、Scatter、淋巴增强因子1、β连环蛋白等的诱导物[12]。Smad3控制一系列Smad依赖的靶基因转录[13],TGF-β1受体丝氨酸-苏氨酸激酶激活Smad2/3后,使其磷酸化,Smad3与Smad4结合形成复合物进入到细胞核,从而与其他转录因子共同调控靶基因的转录,最终导致EMT及PF的发生。Wang等[14]在博来霉素诱导的肺纤维化模型小鼠中发现,热休克蛋白27和Smad3表达均增加,进而激活细胞外调节蛋白激酶信号通路促进EMT。
中医学认为PF的病变实质是“肺络瘀滞”。肺为娇脏,外易受六淫之邪,内可生瘀血为患,诸因素均可闭阻气机,导致肺络之气血运行受阻,气血不畅,更易酿生瘀血,从而造成肺络瘀滞而发病[15]。李菊莲等[16]也认为本病早期毛细血管增生、扩张、充血,管壁增厚,晚期由于大量纤维结缔组织增殖而收缩,毛细血管数量减少甚至闭锁,说明PF存在肺络瘀滞病机。“络以通为用”,因此,治疗本病当以活血通络为主。血府逐瘀汤是王清任所创的活血化瘀五大名方之一,由桃仁、红花、当归、生地黄、川芎、赤芍、牛膝、桔梗、柴胡,枳壳、甘草组成。诸药合用,不仅可行血分之瘀滞,又可解气分之郁结,寓行气于活血之中,寓养于行散之中,活血而不耗血,袪瘀又能生新,升降同用,使瘀血下行,气机畅达,脏腑和调。现代药理研究表明,血府逐瘀汤可通过抑制Smad3、MMP-7的蛋白表达来降低肺纤维化程度[17],此外对氧自由基损伤也有不同程度的干预作用,并可通过降低血清HA、肺组织HYP、胶原蛋白含量及提高弹性纤维含量来改善其细胞外基质代谢[18]。在此基础上,本研究以疗效较好的地塞米松为阳性对照,探讨了血府逐瘀汤对PF模型大鼠肺组织中上皮细胞标志物、间质细胞标志物表达以及TGF-β1/Smad3信号通路的影响。
本研究结果显示,模型组大鼠肺组织E-cadherin表达较正常组显著降低,而α-SMA表达较正常组显著升高,提示模型复制成功。给予不同剂量的血府逐瘀汤后,各给药组大鼠E-cadherin表达显著升高,而α-SMA表达显著降低,表明该方可不同程度地上调E-cadherin表达,下调α-SMA表达,提示该方防治PF的作用可能与抑制EMT有关。进一步研究结果显示,模型组大鼠肺组织中TGF-β1、Smad3的表达显著升高,提示PF发生后TGF-β1/Smad3信号通路被激活,给予不同剂量的血府逐瘀汤后,大鼠肺组织TGF-β1、Smad3表达均显著降低,提示血府逐瘀汤治疗PF的机制可能与抑制TGF-β1/Smad3信号通路有关。此外,本研究结果还显示,血府逐瘀汤低剂量组大鼠肺组织E-cadherin表达显著低于地塞米松组,α-SMA、TGF-β1、Smad3表达显著高于地塞米松组,而中、高剂量组与地塞米松组比较差异无统计学意义,提示中剂量组(7.02g·kg-1·d-1)、高剂量组(14.04 g·kg-1·d-1)血府逐瘀汤对PF模型的改善作用与地塞米松相当。
综上所述,血府逐瘀汤可通过干预EMT来减轻模型大鼠的肺纤维化,其机制可能与抑制TGF-β1/Smad3信号通路有关,但其具体机制还有待进一步研究。
参考文献
[1]黄云鉴. 肺纤维化中医治疗数据挖掘及养肺活血方干预机制研究[D]. 南京:南京中医药大学,2017.
[2]李洪,王昌明. 肺纤维化发病机制的研究进展[J]. 广西医学,2018,40(19):2325-2327,2331.
[3]NIETO M A, HUANG R Y J, JACKSON R A, et al. EMT: 2016 [J]. Cell, 2016,166(1): 21-45.
[4]BARTIS D,MISE N, MAHIDA R Y, et al. Epithelial-mesenchymal transition in lung development and disease: does it exist and is it important[J]. Thorax, 2014,69(8):760-765.
[5]BAE E,KIM S J,HONG S, et al. Smad3 linker phosphorylation attenuates Smad3 transcriptional activity and TGF-β1/Smad3-induced epithelial–mesenchymal transition in renal epithelial cells[J]. Biochemical & Biophysical Research Communications, 2012,427(3):593-599
[6]宋远瑛. 血府逐瘀汤治疗老年特发性肺纤维化患者的临床疗效[J]. 实用临床医药杂志, 2016,20(9):155,159.
[7]吴琼,马海洋,王志武,等. 活血化瘀法对肺癌放疗后肺纤维化的抑制作用[J]. 中国临床研究,2017,30(9):1261-1263.
[8]TAOOKA Y,MAEDA A,HIYAMA K,et al. Effects of neutrophilelastase inhibitor on bleomycin-induced pulmonary fibrosisin mice[J]. AM J Respi Crit Care Med,1997,156 (1):260-265.
[9]GASIOR K, WAGNER N J, CORES J,et al. The role of cellular contact and TGF-beta signaling in the activation of the epithelial mesenchymal transition (EMT)[J]. Cell Adhesion & Migration, 2019,13(1):63-75.
[10]CHITRA P, SAIPRASAD G, MANIKANDAN R, et al. Berberine inhibits Smad and non-Smad signaling cascades and enhances autophagy against pulmonary fibrosis[J]. J Mol Med, 2015,93(9):1015-1031.
[11]张秀莉,邱静,李万成. 肺纤维化中microRNA-29对TGF-β1/Smad3通路调控机制[J].国际呼吸杂志,2018,38(8):627-630.
[12]COWARD W R, SAINI G, JENKINS G.The pathogenesis of idiopathic pulmonaryfibrosis[J]. Ther Adv Respir Dis, 2010,4(6) :367-388.
[13]SAVAGNER P. Leaving the neighborhood:molecular mechanisms involved during epithelial-mesenchymal transition [J]. Bioessays, 2001,23(10):912-923.
[14]WANG G, JIAO H, ZHENG J N, et al. HSP27 regulates TGF-β mediated lung fibroblast differentiation through the Smad3 and ERK pathways[J]. Int J Mol Med,2017,39(1): 183-190.
[15]渠景連. 养肺通络法干预Notch信号通路防治肺纤维化的机制研究[D]. 南京:南京中医药大学.2015.
[16]李菊莲,王宇,邓海娟. 肺痹与肺间质纤维化关系探讨[J]. 甘肃科技,2003,19(12):113-114.
[17]王祺,于雪峰,齐越,等. 血府逐瘀汤干预肺纤维化大鼠作用机制研究[J]. 实用药物与临床,2019,22(6):580-584.
[18]黄霞,刘惠霞,刘超,等. 血府逐瘀汤对肺间质纤维化动物氧化应激及细胞外基质代谢的干预作用[J]. 北京中医药大学学报,2012,35(11):752-756.
(收稿日期:2020-04-09 编辑:刘斌)
