基于质量标志物的当归抗炎功效近红外快速评价
2020-11-09闫孟琳丛龙飞张子玥
闫孟琳,丛龙飞,张子玥,姜 民,聂 磊,白 钢*
(1.南开大学 药学院 药物化学生物学国家重点实验室,天津 300353;2.山东大学 药学院,山东 济南 250100)
中药材的质量控制研究一直是行业关注的焦点问题之一。现有质量控制方法的样品前处理繁琐复杂,仅适用于实验室研究[1]。如何建立简便快捷的质量评价方法,为中药品质提供有力保障是目前中药质量控制亟需解决的问题。近红外光谱技术(NIRS)是一种整合分析技术,具有简便快捷、低成本、绿色环保、不损坏样品且可实现全程自动化检测等特点。近年来,NIRS技术不断发展,已被广泛应用于制药、农业、食品以及医学等各个领域[2-5],为中药质量的快速评价提供了新的分析手段。
当归(AS)为伞形科植物当归Angelicasinensis(Oliv.)Diels 的干燥根,始见于《神农本草经》,具有补血活血、调经止痛、润肠通便之功效[6]。目前当归以甘肃岷县的质量最好,称为“道地药材”[7]。市场上流通的当归均为栽培品种,主产自甘肃、云南、湖北、四川等地[8]。由于受品种、栽培种植方法、产地气候、采收加工方法、运输贮藏条件等因素的影响,当归质量存在着较大差异。目前《中国药典》(2020年版)虽然对当归的水分、灰分、浸出物、挥发油、阿魏酸等的含量进行了限定,但这些指标缺乏与当归功效的直接关联,不能充分反映当归药材的质量属性。质量标志物(Q-marker)概念的提出为当归药材的质量控制提供了新的思路,其特点是利用能够体现中药有效性及安全性并可以检测的化学指标,对与中药质量相关的物质基础进行评价[9]。因此建立以Q-marker为核心的简便快捷的分析体系用于当归质量的评价具有重要意义。
核转录因子NF-κB被认为是炎症过程的主要介质,在人体大多数炎症疾病中呈高度激活状态[10-11]。而当归在临床上可用于治疗动脉粥样硬化、肺纤维化等疾病,可能与其能够影响NF-κB的转录,进而抑制组织炎症、纤维化等过程有关[12-13]。本研究拟通过NF-κB抑制活性对当归抗炎Q-marker进行筛选,运用近红外光谱技术及化学计量学方法探讨其含量与整体抗炎功效的关系,建立一种以中药质量标志物为导向的当归品质快速管理体系,为当归的品质监管提供新的研究思路和方法。
1 实验部分
1.1 仪器与试剂
UPLC/Q-TOF Premier液质联用仪、UPLC®BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)(美国Waters公司);高速台式冷冻离心机(MIKRO 220R,德国Hettich公司);CO2恒温培养箱(FORMA311,美国Thermo公司);荧光检测仪(Modulus,美国Turner Designs公司);布鲁克傅里叶变换近红外光谱仪(Tensor37,德国Brucker公司);OPUS 7.0软件(德国Brucker公司)。
色谱纯乙腈、甲醇、甲酸(美国Sigma公司);细胞培养用试剂(美国Gibco公司);双荧光素酶报告基因试剂盒(美国Promega公司);绿原酸(Chlorogenicacid,CA)、欧当归内酯A(Levistilide A,Lev A)(纯度≥ 98%,上海源叶生物科技);阿魏酸(Ferulicacid,FA)(纯度≥ 99%,上海麦克林生化科技);洋川芎内酯I(Senkyunolide I,SK I)、Z-藁本内酯(Z-Ligustilide,Z-Lig)(纯度≥ 98%,上海麦克林生化科技);其他试剂均为市售分析纯。
1.2 药材与细胞
200批当归药材购自甘肃陇西当归药材市场,经甘肃数字本草检验中心王浩亮工程师鉴定为伞形科药材当归Angelicasinensis(Oliv.)Diels。人胚肾上皮细胞293T细胞系(HEK 293T)购于北京博奥派克生物科技(批号:SL401)。
1.3 实验方法
1.3.1 当归提取物的制备取当归药材,粉碎,过100目筛得当归粉末。称取0.5 g加入50 mL 70%(7∶3,体积比)甲醇水溶液,25 ℃超声30 min,离心取上清,经0.22 μm微孔滤膜过滤,收集续滤液,用于高效液相色谱(UPLC)分析。取500 μL剩余续滤液于96孔深孔板中,真空干燥后,-20 ℃保存备用。
1.3.2 UPLC/Q-TOF测定参照文献方法对当归提取物进行分析测定[14-15]。流出液经10∶1分流,其中1/10部分直接进行质谱检测,另外9/10部分每间隔30 s收集至96孔深孔板中,真空干燥,得UPLC馏分。
1.3.3 基于双荧光报告基因的NF-κB抑制活性检测将HEK 293T细胞置于96孔板中,于37 ℃,5% CO2培养箱中静置培养,待细胞融合度为70%时,分别加入NF-κB荧光素酶报告基因质粒pGL 4.32(100 ng/孔)、内参Renilla(9.6 ng/孔)和转染试剂PEI(1 mg/mL)进行瞬时共转染。20 h后细胞给药,实验分对照组(Con)、模型组(Mod,10 ng/mL TNF-α)、阳性药组(Dex,10-5mol/L地塞米松)和当归提取物组(10-4、10-5、10-6g/mL),以及不同浓度(10-4、10-5、10-6mol/L)抑制剂对照品组(绿原酸、阿魏酸、洋川芎内酯I、Z-藁本内酯、欧当归内酯A)、混合对照品组(Mixed standard,MS)(0.06 mg绿原酸+0.14 mg洋川芎内酯I+1.21 mg Z-藁本内酯溶于1 mL二甲基亚砜)、UPLC馏分组以及50批当归提取物组(10 mg/mL)。给药6 h后,收集细胞,按照荧光素酶报告基因试剂盒的说明测定荧光强度值,并计算NF-κB相对抑制活性(荧光比率=NF-κB荧光值/Renilla荧光值)。
1.3.4 UPLC含量测定参照文献液相条件进行UPLC定量分析[14]。以绿原酸、阿魏酸、洋川芎内酯I、Z-藁本内酯、欧当归内酯A对照品为对照,分别绘制标准曲线,并计算相应含量。
1.3.5 近红外光谱法检测采用布鲁克傅里叶变换近红外光谱仪,参照文献方法[14]对当归样品进行红外光谱扫描。选择其中50批活性成分差异较大的样品光谱以及对应Q-marker的UPLC含量测定结果,运用OPUS 7.0软件进行定量建模,分别建立近红外光谱快速检测方法。
1.3.6 药效成分含量与NF-κB抑制活性的拟合与应用为了建立Q-marker含量、绿原酸(X1)、阿魏酸(X2)、洋川芎内酯I(X3)、Z-藁本内酯(X4)、欧当归内酯A(X5)与当归NF-κB抑制活性(Y)之间的函数关系,依据样本数是变量数5倍的原则[16],选取25批当归样品,采用SIMCA(12.0)软件进行正交偏最小二乘判别分析(OPLS-DA)建模,获得“量-效”关联拟合函数。同时,另选取9批当归样品对所建模型进行验证,建立拟合函数方程。利用所建立的拟合函数,将近红外光谱法所测药材中Q-marker的含量导入拟合函数中计算Y值,通过Y值来综合预测药材的抗炎活性。
2 结果与讨论
2.1 当归中NF-κB抑制成分的谱效筛选
采用UPLC/Q-TOF谱效筛选方法对当归提取物中的NF-κB抑制成分进行筛选与鉴定。结果如图1A~C所示,当归提取物中的各成分在UPLC的UV检测及质谱检测(BPI)中得到较好分离。收集各时间段馏分进行抑制活性检测,发现2.5、3.5、5、9、12 min馏分处显示了明显的NF-κB抑制效果(图1D),经质谱解析及对照品指认(图1E),确认其分别为绿原酸(m/z353.087 3[M-H]-)、阿魏酸(m/z193.053 3[M-H]-)、洋川芎内酯I(m/z207.102 1[M+H-H2O]+)、Z-藁本内酯(m/z191.107 5[M+H]+)和欧当归内酯A(m/z381.207 9[M+H]+),初步确认了潜在的Q-marker。
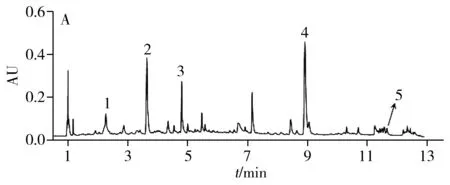
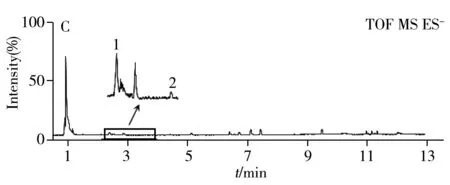
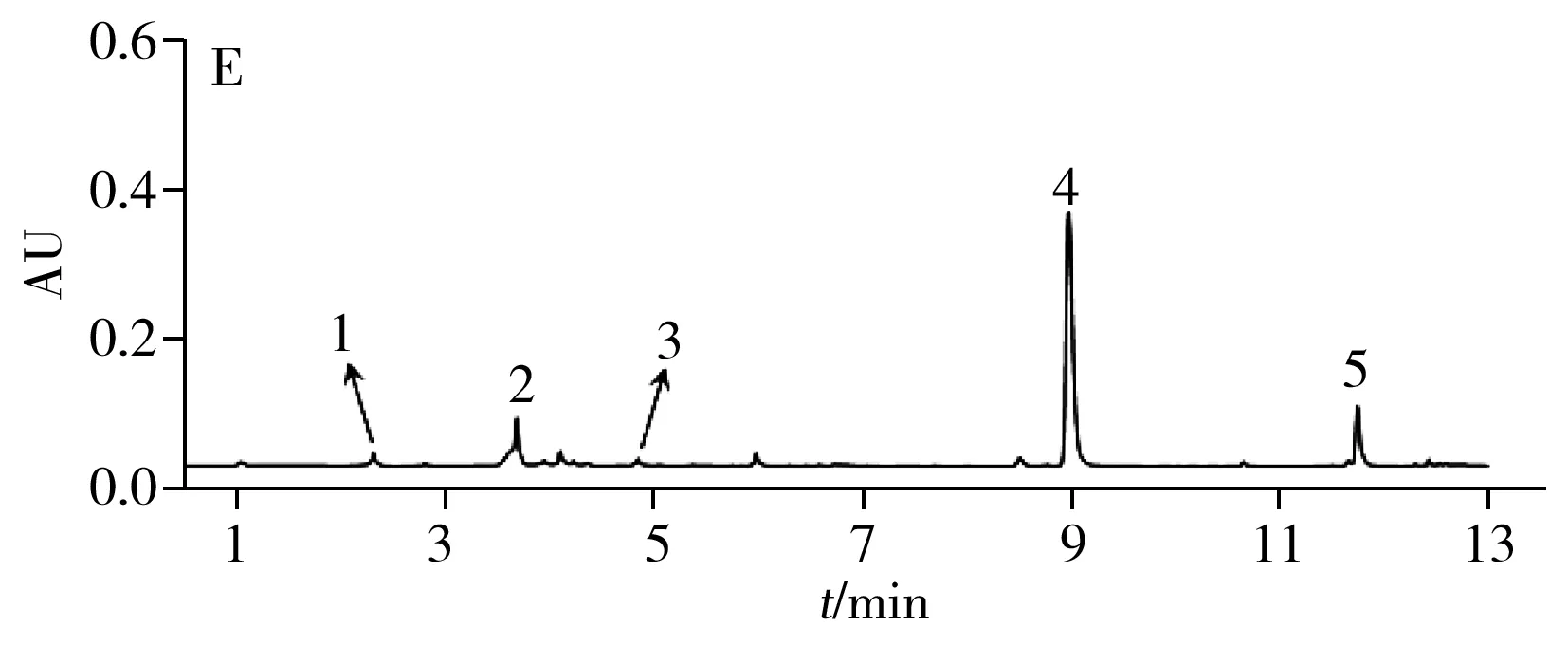
图1 当归药材中NF-κB抑制活性成分的UPLC/Q-TOF谱效筛选Fig.1 UPLC/Q-TOF combined with NF-κB inhibitory activity screening for ASA.UPLC chromatogram of AS extractive;B.BPI in positive mode;C.BPI in negative model;D.UPLC combine with NF-κB inhibitory activity screening;E.UPLC for mixed reference substances;1.CA,2.FA,3.SK I,4.Z-Lig,5.Lev A;compare with Mod group,*p<0.05;**p<0.01;***p<0.001;compare with Con group,###p<0.001;(x± s,n = 4)
2.2 NF-κB抑制成分的验证及含量测定
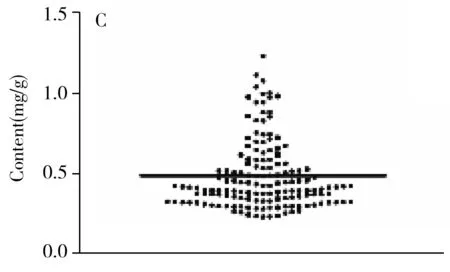
分别取绿原酸、阿魏酸、洋川芎内酯I、Z-藁本内酯、欧当归内酯A的对照品,依据上述NF-κB抑制活性检测方法对其活性进行验证。结果如图2所示,所筛选出的5种成分均能剂量依赖地抑制由TNF-α诱导的NF-κB的表达(图2),验证了该5种成分均具有NF-κB抑制活性。同时,选取50批当归样品,以UPLC检测上述各活性成分的含量。其中,绿原酸的含量范围为0.106 1~1.054 mg/g,均值为0.251 6 mg/g;阿魏酸的含量范围为0.193 4~0.744 2 mg/g,均值为0.526 9 mg/g;洋川芎内酯I的含量范围为0.080 8~1.911 mg/g,均值为0.841 3 mg/g;Z-藁本内酯的含量范围为2.248~12.30 mg/g,均值为5.853 mg/g;欧当归内酯A的含量范围为0.110 5~0.760 7 mg/g,均值为0.301 5 mg/g。

图2 当归药材中5种NF-κB抑制活性成分的评价Fig.2 Evaluation of 5 NF-κB inhibitory activity of AS compare with Mod group,*p<0.05;**p<0.01;***p<0.001;compare with Con group,###p<0.001;(x±s,n=5)
2.3 当归NF-κB抑制活性与含量的关系拟合

2.4 当归抗炎Q-marker的近红外光谱拟合
采用交叉验证的方法,分别对光谱预处理方法、光谱区段的选择进行优化。以相关系数(R2)、交叉验证均方差(RMSECV)以及相对分析误差(RPD)为评价指标,对模型预测性能进行评判。其中RMSECV越小,R2越接近1,模型的准确度及预测效果越好;RPD>3.0,则认为所建模型具有较高可靠性,可用于后续分析[17-18]。
2.4.1 光谱预处理方法的选择采用合适的光谱预处理方法对原始光谱进行处理,可减小光谱基线漂移,增强光谱的差异性,有利于特征信息的提取。本研究分别采用一阶导数、二阶导数、消除常数偏移量(ECO)、多元散射校正(MSC)、正态变量校正(SNV)等方法对50批当归样品的原始光谱(图4A)进行预处理。结果如图4B~D所示,优选后的预处理方法分别为:绿原酸采用一阶导数+SNV,洋川芎内酯I采用ECO,Z-藁本内酯采用MSC。
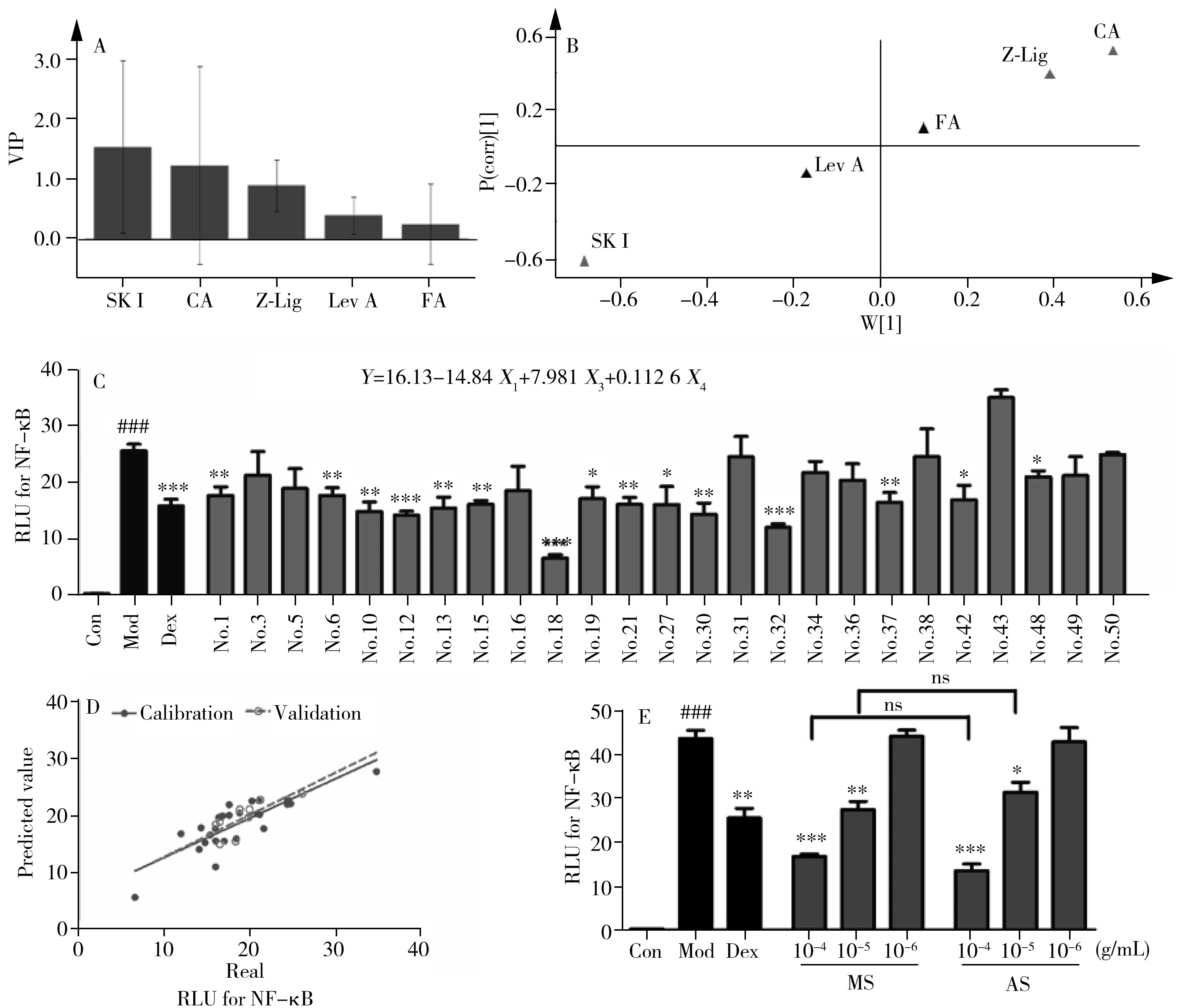
图3 当归NF-κB抑制活性与Q-marker含量的关系拟合Fig.3 The fitting relationship between NF-κB inhibitory activity and Q-marker content of AS A.VIP plot;B.S-plot;C.NF-κB inhibitory activity for 25 batches of AS;D.regression trend of true value and predicted value;E.equivalence verification(x±s,n=3,ns:not significant)
2.4.2 光谱区间以及主因子数的确定为了提高近红外光谱拟合的准确性,进一步对上述3种Q-marker的最佳波数区间进行筛选和优化,并确定其最佳建模区间:绿原酸为7 502.8~6 098.7 cm-1及5 450.6~4 598.1 cm-1区段,洋川芎内酯为9 400.7~7 498.9 cm-1及6 102.5~5 774.6 cm-1区段,Z-藁本内酯为7 502.8~5 446.8 cm-1及4 602~4 247.1 cm-1区段。所选最佳波段区间有效提取了光谱差异信息,较好地屏蔽了噪音等不良信号的干扰。同时,为了确保模型预测的稳健性,对建模的最佳主因子数进行了考察。综合模型R2、RMSECV和RPD的检测结果,最终确定建模的主因子数,绿原酸为13,洋川芎内酯I为7,Z-藁本内酯为12。绿原酸、Z-藁本内酯的主因子数相对洋川芎内酯I偏大说明其近红外预测更为复杂。本研究基于建模效果,选择较少的主因子数,在保障模型预测能力的同时兼顾了分析效率。
2.4.3 定量模型的建立以“2.3”部分的50批当归样品作为样本集,根据上述UPLC的含量测定结果,采用交叉检验模式,选用最佳光谱预处理方法、波数区间以及主因子数,通过偏最小二乘法进行建模,得到3种Q-marker的定量模型。结果如图4E~G所示,NIRS模型预测值与UPLC测定值表现出良好的线性关系,模型拟合能力良好,R2、RMSECV及RPD均可以满足预测要求。
2.5 当归药材抗炎活性的快速评价
本文尝试基于Q-marker的含量搭建近红外光谱技术与抗炎活性之间的关系。首先,依据上述所建立的近红外定量模型,分别对另外的150批当归药材中的3种Q-marker含量进行测定。得到绿原酸的含量范围为0.111 4~1.032 mg/g,均值为0.524 1 mg/g(图5A);洋川芎内酯I的含量范围为0.096 8~1.341 mg/g,均值为0.624 5 mg/g(图5B);Z-藁本内酯的含量范围为2.300~12.23 mg/g,均值为4.850 mg/g(图5C)。将获得的含量测定结果分别导入上述NF-κB抑制活性预测的拟合方程,获得相应抗炎活性的预测Y值,最终通过近红外光谱整合“量-效”关联拟合分析,实现了对当归药材抗炎功效的快速、精准评价(图5D)。
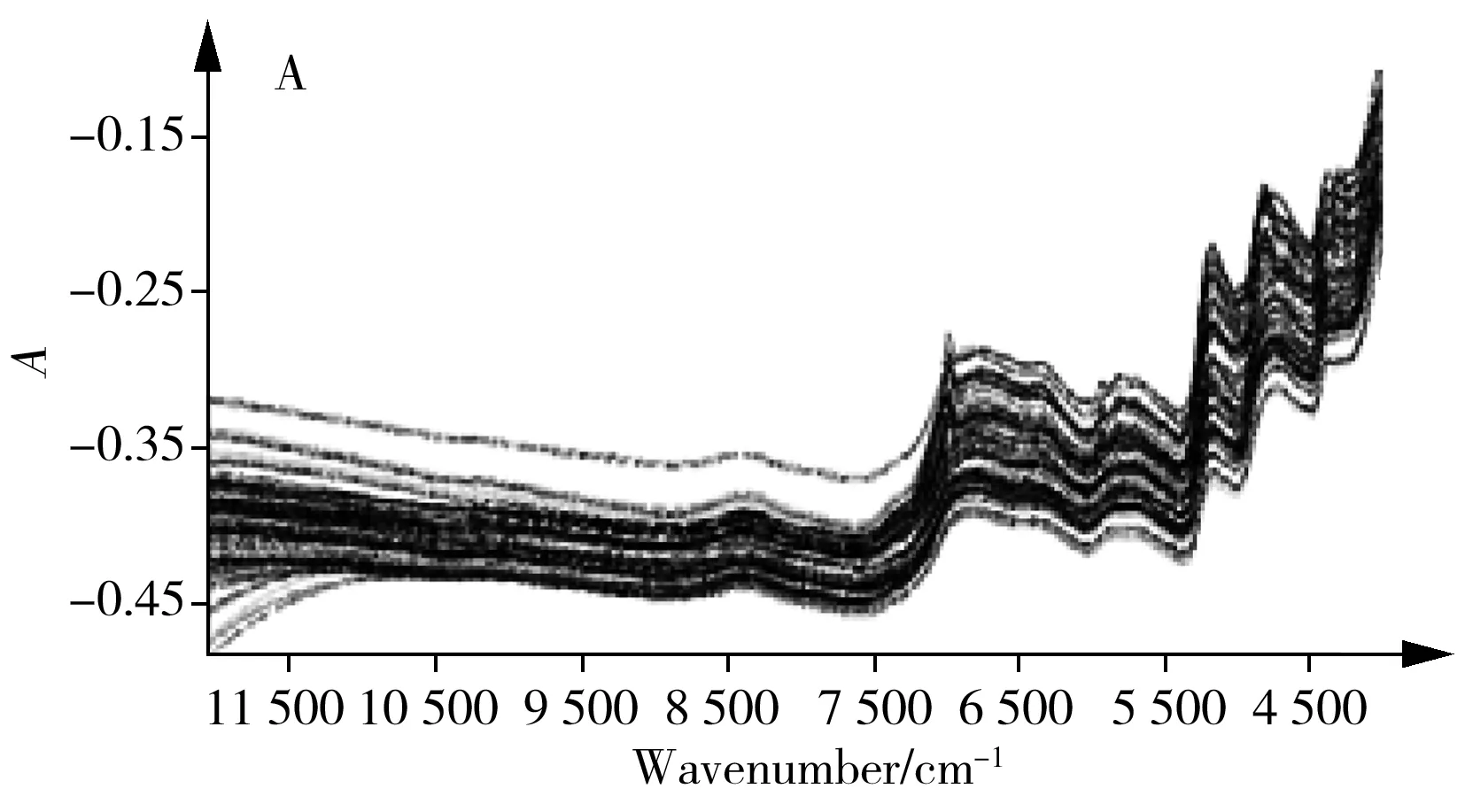
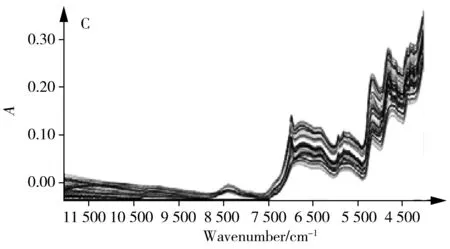
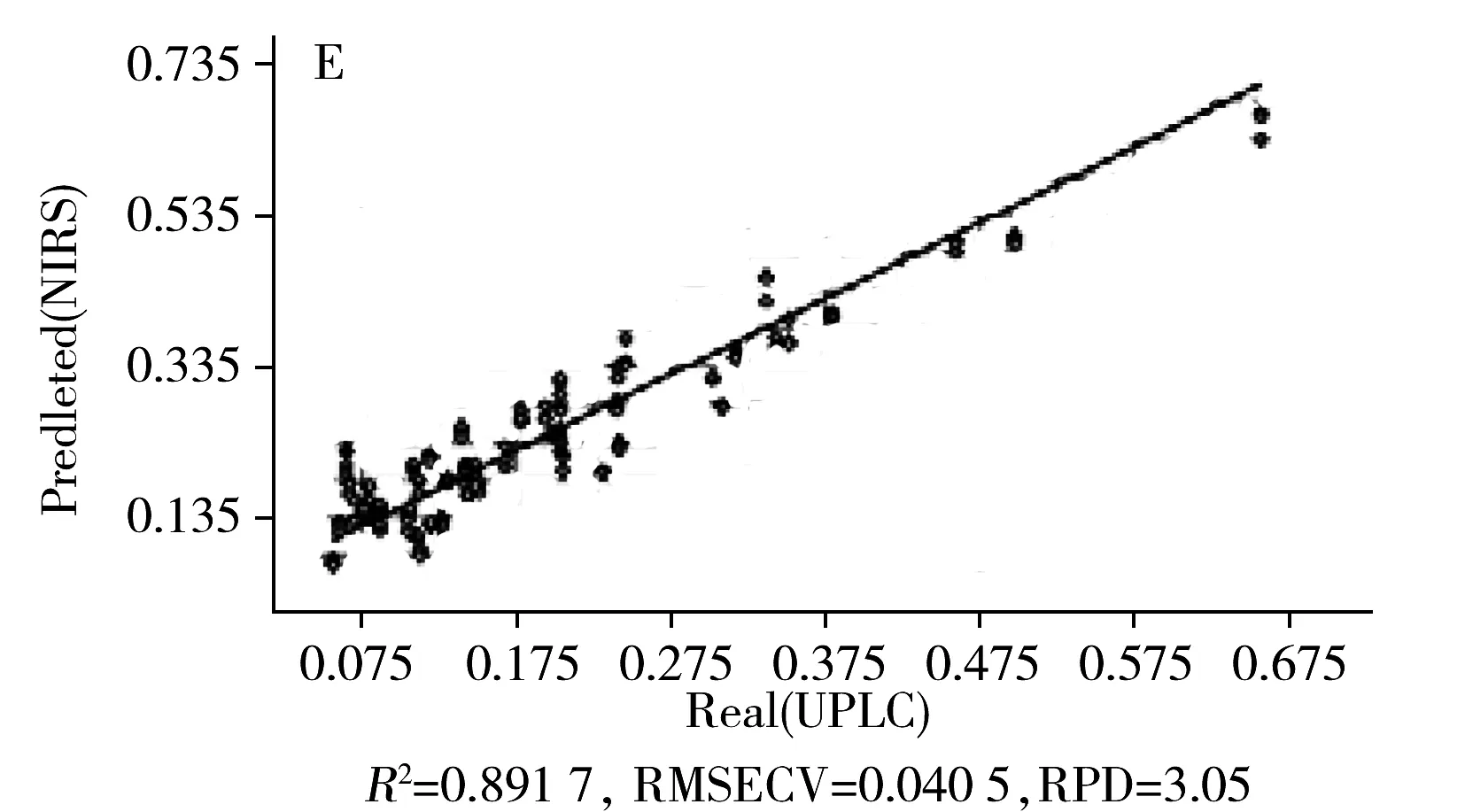

图4 当归药材中3种Q-marker的近红外光谱分析Fig.4 NIR spectroscopy analysis for three Q-markers of ASA.original spectra;B,C and D.pre-processed spectra for CA,SK I and Z-Lig,respectively;E,F and G .quantitative model of CA,SK I and Z-Lig,respectively
3 结 论
本研究采用UPLC/Q-TOF技术结合NF-κB双荧光素酶报告基因谱效筛选方法,对当归药材中具有NF-κB抑制作用的Q-marker成分进行了筛选、鉴定与评价,确认绿原酸、洋川芎内酯I、Z-藁本内酯为当归发挥抗炎作用的关键Q-marker。并通过近红外光谱技术建立了上述Q-marker成分的快速检测方法。此外还运用化学计量学手段,建立了Q-marker成分含量与整体抗炎功效的拟合关系函数,最终实现了以Q-marker为核心,通过近红外光谱扫描对当归抗炎功效的快速评价,为当归药材品质的快速评价与监管提供了创新方法。