超声模型在甲状腺乳头状癌中央区淋巴结转移预测中的应用
2020-11-09田晓琦罗渝昆
田晓琦,罗渝昆,张 颖,宋 青,任 玲,张 艳,姜 波
1南开大学医学院影像医学与核医学专业,天津 300071 2中国人民解放军总医院超声科,北京 100853
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是一种预后良好的疾病,但其中央区淋巴结转移率高达24.1%~64.1%[1- 3],预防性中央区淋巴结清扫(central compartment lymph node dissection,CLND)一直存在较大争议[4- 6]。由于中央区淋巴结的解剖位置较复杂且受气管内气体回声的干扰,超声检查对于中央区淋巴结转移(central compartment lymph node metastasis,CLNM)的检出率非常有限,据报道敏感性仅为10.9%~36.2%[7]。如何于术前进行风险评估,筛选出最有可能发生CLNM的患者,对治疗方式的选择尤为重要。本研究旨在联合患者临床特点及超声特征,构建预测PTC CLNM的量化模型,为下一步开展基于风险分层的PTC治疗决策提供依据。
资料和方法
资料来源2018年1月至2019年1月首次行甲状腺癌手术并于术前在中国人民解放军总医院超声科行超声检查的患者。入选标准:(1)术前经超声检查发现至少1个疑似恶性结节,并行穿刺活检证实为恶性;(2)于我院接受初次甲状腺手术(腺叶切除或任何类型的甲状腺切除术)并行CLND;(3)术后病理证实为PTC;(4)术前未接受其他治疗;(5)术前3个月内于我院超声科接受甲状腺超声检查且图像信息完整。排除标准:(1)术后病理类型非PTC;(2)未清扫中央区淋巴结;(3)发生淋巴结跳跃转移,即侧区淋巴结转移而中央区淋巴结未转移;(4)有头颈部放射治疗史及远处转移;(5)合并其他部位恶性肿瘤的患者;(6)患者超声图像信息不全。共有577例患者入选,其中,男148例(25.6%),女429例(74.4%),平均年龄(43.8±11.4)岁(15~78岁),结节平均最大径(1.13±0.69)cm(0.3~5.1 cm)。根据相同的入排标准,从2019年2月至7月于我院行甲状腺癌手术患者中筛选出278名患者纳入验证组,其中,男71例(25.5%),女207例(74.5%),平均年龄为(43.1±10.6)岁(16~76岁),结节平均最大径(1.45±0.63)cm(0.4~5.5 cm)。本研究经中国人民解放军总医院伦理委员会批准,所有患者均豁免知情同意。
超声检查常规超声检查采用IU22型超声诊断仪(荷兰飞利浦公司),探头频率7~12 MHz;Siemens S2000超声诊断仪(德国西门子公司),频率为7~12 MHz。检查时患者取平卧位,对患者甲状腺双侧腺体及峡部和颈部各区进行常规扫查。记录患者资料,临床指标包括患者年龄、性别;超声指标包括肿瘤多灶性(单灶、多灶),肿瘤最大径(D≤1 cm,1 cm
CLNM评价方法以代入模型所得危险评分为检验变量,以术后病理结果为金标准,构建受试者工作特征(receiver operating characteristic,ROC)曲线,确定灵敏度与特异度之和最大时的诊断临界值。以此临界值为标准,评估PTC患者CLNM情况。当把患者资料代入模型得出结果大于或等于临界值时,该患者记为阳性,即提示其中央区淋巴结评估为转移。
统计学处理采用SPSS 25.0及STATA 15.0统计软件,符合正态分布的计量资料以均数±标准差表示,分类变量用率或比描述,两组间率的比较采用χ2检验;多因素分析采用二元Logistic回归分析;模型评估临界点的确定采用ROC曲线,诊断临界点选择灵敏度和特异度之和最大时的数值;以术后病理诊断为金标准,计算诊断试验四格表资料的灵敏度、特异度和约登指数;统计学显著性设为0.05,均为双侧。
结 果
577例患者中,有262例(45.4%)经手术病理证实发生CLNM,CLNM组与非CLNM组患者在年龄(χ2=25.885,P<0.001)、性别(χ2=30.402,P<0.001)、结节数目(χ2=4.172,P=0.041)、结节最大径(χ2=75.939,P<0.001)、与被膜关系(χ2=16.942,P<0.001)、伴微钙化(χ2=59.426,P<0.001)及血流分级(χ2=43.320,P<0.001)方面差异均有统计学意义(表1)。
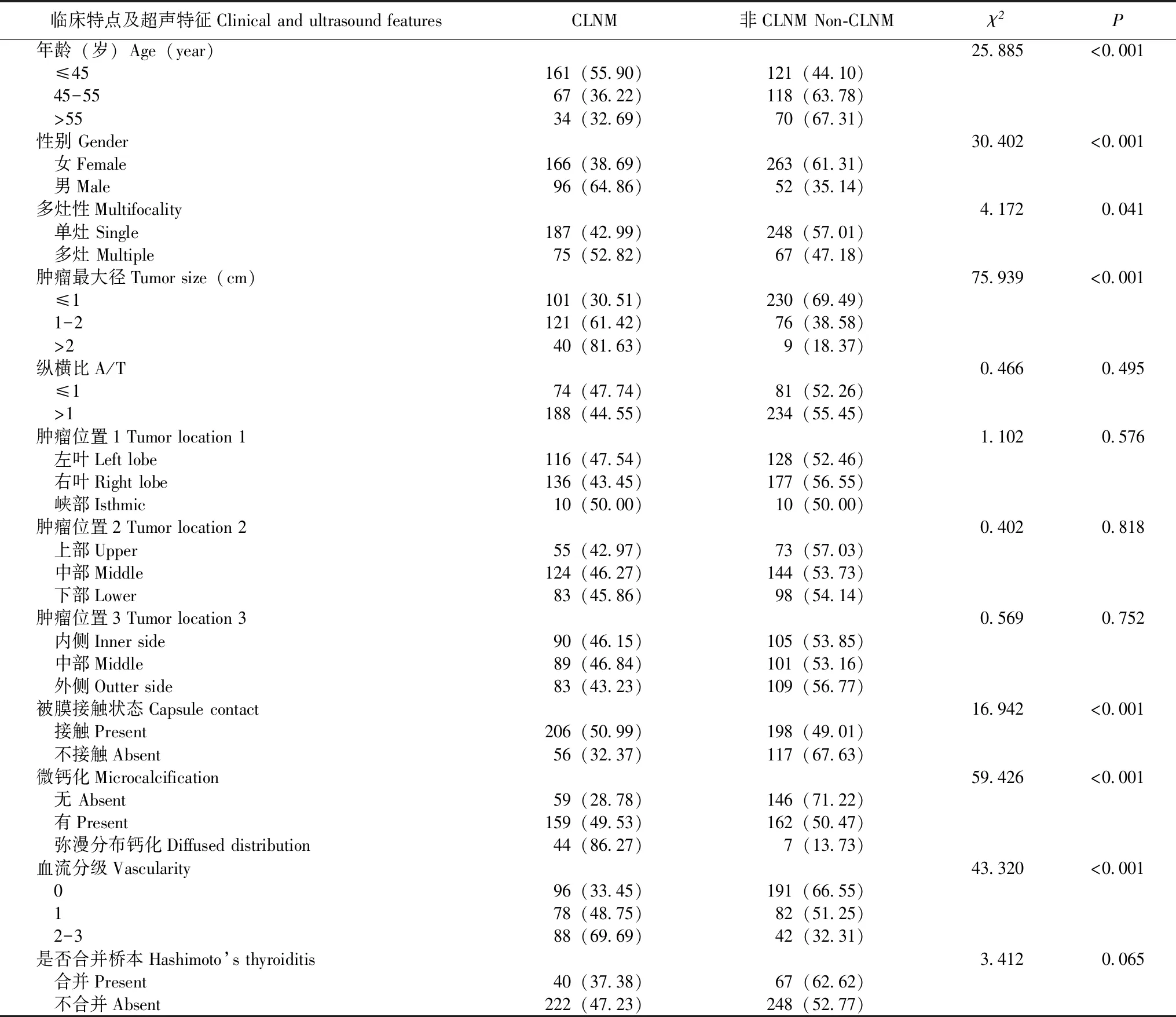
表1 建模组患者临床特点及超声特征的单因素分析[n(%)]
将建模组PTC患者所有资料均纳入Logistic回归分析,通过逐步向前向后法,以赤池信息量准则为标准筛选最优模型,最终纳入患者性别(P<0.001)、年龄45~55岁(P=0.004),≥55岁(P=0.003)、结节最大径1~2 cm(P<0.001)、最大径>2 cm(P=0.008)、结节多灶性(P=0.029)、合并微钙化(P=0.019)、微钙化呈弥漫性分布(P=0.001)和血流分级2~3级(P=0.002)构建预测模型方程(表2),进入模型的变量均设为哑变量。建模组的校对曲线显示,CLNM预测概率与实际CLNM概率拟合度较好,AUC为0.78(95%CI:0.74~0.82)(图1)。
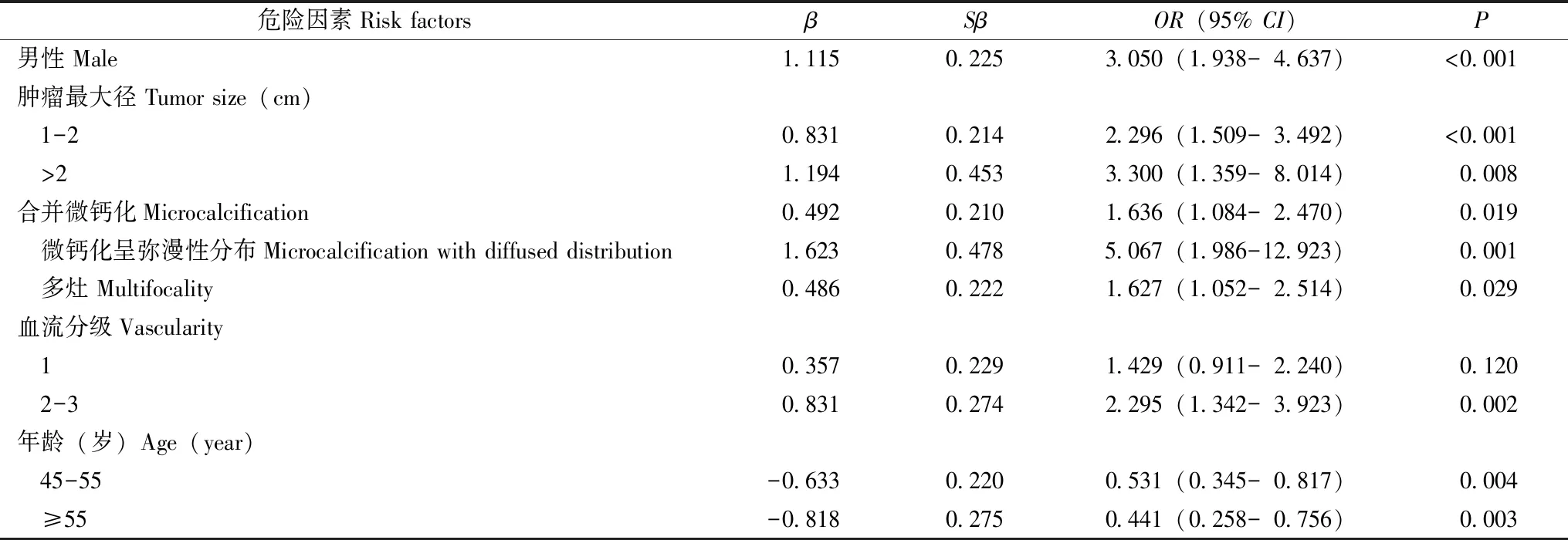
表2 多因素Logistic回归分析结果
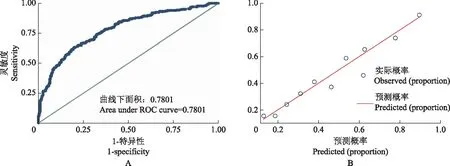
A.预测模型在建模组中的ROC曲线;B.预测模型在建模组中的校对曲线
验证组278例患者中,有140例(50.36%)经手术病理证实发生CLNM,将验证组患者参数代入模型,计算每个患者发生CLNM的概率即危险评分,以术后病理为金标准,所得AUC为0.70(95%CI:0.67~0.76),因此模型具有较好的预测效能(图2)。采用ROC曲线确定诊断临界点,当危险评分为0.35时,此模型预测CLNM的灵敏度、特异度和约登指数分别为 73.5%、61.7%和0.352。
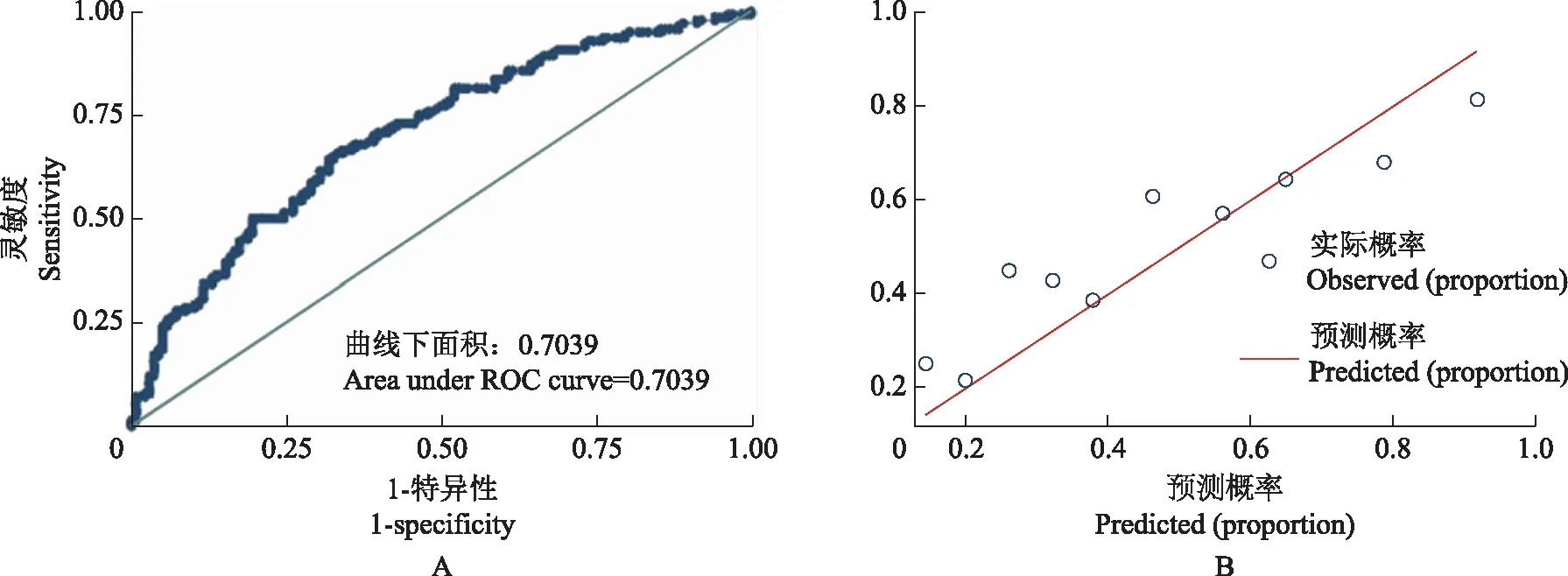
A.预测模型在验证组中的ROC曲线;B.预测模型在验证组中的校对曲线
讨 论
关于PTC的预防性CLND,一部分学者认为可降低其复发率,并且可改变部分患者的TNM分期[9],影响术后复发风险评估及I131治疗决策[6]。另一部分认为目前仍缺乏足够的证据表明预防性CLND在降低复发率和改善预后等方面有益,而且会增加潜在的手术风险[10]。因此针对PTC患者CLNM的可能性进行风险分层是很有必要的。
本研究结果显示,较大体积或多灶性结节发生CLNM的可能性更大,这些因素已在多项研究中得到证实[11- 13]。此外,年轻及男性均对CLNM具有较高的预测作用[14]。作为术前工具,模型的预测性能依赖超声检查的准确性,Zhao等[15]将PTC患者肿瘤大小的超声测量与病理进行了比较,发现超声的判断比较准确,与病理测量具有良好的相关性。一项针对多灶性PTC的研究发现,多发病灶在75.9%病例中都能被准确识别[13],超声检查确定的多灶性与组织病理学结果比较无统计学差异,因此基于超声特征的预测模型是相对准确且稳定的。此外本研究发现,富血供PTC病灶容易发生CLNM,其机制可能与血管内皮生长因子过表达相关[16],随着结节增大瘤内血管受各种血管生成因子的诱导而快速增殖,形成大量紊乱的血管网,血供逐渐丰富PTC血管生成越活跃,颈部淋巴结转移的可能性越大。本研究还发现,微钙化尤其是弥漫性分布微钙化的存在与CLNM高度相关,病灶内伴有弥漫性微钙化的患者,86.27%均发生了CLNM。Bai等[17]研究发现,PTC中砂砾体的存在与淋巴结转移及临床分期具有显著相关性,砂砾体在超声上主要表现为微钙化,有微钙化存在的肿瘤中一些细胞因子如骨形态发生蛋白- 1、骨桥蛋白等呈高表达[18],与PTC侵袭性相关。因此,超声征象在一定程度上可反映PTC的病理生物学行为,有助于预测PTC的侵袭性。目前,有多个研究报道PTC CLNM的高危因素[19-20],然而这些研究结果各有不同,也存在广泛争议,而且应用的一些指标如腺外侵犯、癌细胞分化程度等仅能通过术后病理得知,术前评估的价值有限。
综上,本研究建立的预测模型是基于患者术前可确定的临床及超声特征进行评分,危险评分为0.35时模型预测CLNM的灵敏度为73.5%,远高于超声检查的敏感度。本课题组还将就此模型开发在线应用程序,进一步推进PTC患者的个性化精准诊治。本研究的局限性在于,此模型的建立基于单中心样本的回顾性分析,下一步需开展多中心、前瞻性验证。
