营养干预对食管癌同步放化疗期间骨骼肌的影响
2020-11-09杨秋安
任 朋,杨秋安
山东大学齐鲁医院放疗科,济南 250012
食管癌是世界第8大常见肿瘤,死亡率位居第6[1];在中国的发病率位居第5,死亡率位居第4[2]。放化疗是治疗食管癌的标准方案之一,相比单纯放疗,同步放化疗(concurrent chemoradiotherapy,CCRT)不仅可以提高食管癌的局部控制率,而且显著延长了患者的生存时间(overall survival,OS)[3- 5]。
代谢和营养恶化对癌症患者预后有负面影响,常见问题包括营养不良、肌肉减少症和恶液质[6-7]。恶性肿瘤相关营养不良在癌症患者中非常普遍[8],被认为是由肿瘤相关炎症引起的。肿瘤相关炎症会抑制食欲,进而导致体质量减轻和蛋白质分解。肌肉减少症是与衰老或疾病相关的肌肉进行性丧失[9]。有研究证明,在肝癌、结直肠癌和小细胞肺癌等多种恶性肿瘤中,肌肉减少症与较差的预后相关[10- 12]。骨骼肌损失不仅受原发恶性肿瘤的影响,而且还受化疗、放疗和手术等多种抗肿瘤治疗影响。最终,能量摄入减少和负氮平衡的共同作用导致了骨骼肌损失,其中能量摄入减少主要是食物摄入减少和代谢异常引起的。
良好的营养状态可以减轻患者症状,提高患者健康状况和预后,是癌症治疗成功的标志之一[13- 16]。营养支持可以减少放化疗对营养状况的负面影响,避免放化疗中断[15],并可以提高肿瘤患者的体质量、体能状况和治疗耐受性,提高总OS和生活质量[17]。有研究显示,乳清蛋白、氨基酸和维生素D的补充,可以增加肌肉减少症患者肌肉的质量和强度,提高机体功能及生活质量,减少炎症[18]。
肌肉质量可以使用不同的身体组成数据来测量,常用方法包括生物电阻抗分析,双能X射线吸收法(dual-energy X-ray absorptiometry,DXA)和CT[19],CT用于分析肌肉质量的研究越来越多[20]。通过CT扫描L3横断面可以计算出L3的骨骼肌面积(skeletal muscle area,SMA),SMA被证实与总的骨骼肌质量相关[21-22]。使用SMA除以身高的平方会产生骨骼肌指数(skeletal muscle index,SMI),这是相对肌肉质量的一种测量方法[23]。与生物电阻抗分析和DXA相比,CT的一个优点是可以区分器官和肌肉中的瘦体质量成分。此外,CT图像还可以用来测量肌肉放射衰减(muscle radiation attenuation,MRA),这是一种与肌肉中脂肪含量成反比的肌肉质量指标[24]。CT分析的另一个优点是,由于腹部CT检查是肿瘤患者常规检查的一部分,因此使用L3 CT图像并不会增加患者的经济负担[19]。
本研究回顾性对比分析了两组食管癌患者CCRT前后营养状态及放化疗不良反应发生情况,统计了食管癌患者L3 SMA、MRA、SMI放化疗前后的数据变化,评估了营养干预对食管癌CCRT的营养支持作用,并对这些人群中SMI下降的危险因素进行了探索,以期为中国恶性肿瘤患者的营养研究提供相关的身体组成数据。
资料和方法
资料来源2017年4月至2019年11月在山东大学齐鲁医院放疗科行食管癌CCRT且随访资料完整的患者。纳入标准:(1)年龄大于18岁;(2)病理证实为食管鳞癌;(3)入院时营养风险筛查2002(Nutrition Risk Screening 2002,NRS2002)评分[25]≥3分;(4)接受CCRT;(5)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态(performance status,PS)[26]评分≤2分。排除标准:(1)合并其他部位原发恶性肿瘤者;(2)合并其他脏器严重疾病者(如严重肝功能受损、慢阻肺急性发作等);(3)接受除肠内肠外之外的其他营养干预;(4)缺失能够分析L3骨骼肌数据的CT图像;(5)患有其他代谢疾病;(6)未完成治疗。研究期间共连续收治食管鳞癌放化疗患者315例,其中,图像缺失190例,合并其他脏器严重疾病者3例,使用管饲3例,糖尿病患者37例,未完成治疗3例,共93例患者纳入本研究。本研究获山东大学齐鲁医院科研伦理委员会批准,所有患者均豁免知情同意(KYLL- 2020- 468)。
数据采集包括:年龄、性别、身高、体质量、NRS2002评分、ECOG PS评分、体质量指数(body mass index,BMI)、前白蛋白(prealbumin,PA)、原发肿瘤的分期[美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版食管癌分期系统][27]、放疗方案、化疗方案、放化疗延迟时间等。以放疗前患者的数据为基线,观察的终点为CCRT结束30 d,采集放疗定位时包含L3水平的CT图像,如定位CT缺乏L3水平的图像,则采用定位前2周内患者的CT图像,放化疗结束后30 d内收集患者复查CT图像。
放化疗方法均采用累及野照射,三维适形放疗、调强放疗和螺旋断层放射治疗,总放射剂量为50.4~59.4 Gy(28~33次,每次1.8 Gy),每周5次。化疗方案包括:(1)替吉奥(30 mg/m2)每天口服2次,放疗第1天开始口服替吉奥胶囊,14 d为1个疗程,21 d/周期,共2个周期;(2)紫杉醇(135~175 mg/m2)21 d/周期,共2个周期;(3)紫杉醇(135~175 mg/m2)联合替吉奥(30 mg/m2)21 d/周期,共2个周期;(4)紫杉醇(135~175 mg/m2)联合顺铂(25 mg/m2d1~d3),21 d/周期,共2个周期。在治疗期间,每周至少进行1次血液检查。不良事件评价采用常见不良反应事件评价标准(Common Terminology Criteria for Adverse Events,CTCAE)4.0[28]。在本研究中如果发生由CTCAE确定的3级或4级不良事件,则停止放疗或化疗,在症状改善时恢复治疗。
营养支持及分组采用膳食回顾分析法计算患者入院时平均每日摄入能量,静息能量消耗Harris-Benedict公式[29]计算出患者的能量消耗,最终计算出全营养素标准食物的用量。口服营养补充(oral nutritional supplements,ONS)采用3餐间补充的方式给予,在放化疗前、中、后给予ONS营养干预,入院后开始,出院后患者继续ONS 90d。住院期间进行营养宣教,允许患者更换营养素标准食物种类,在普通食物中添加全营养素标准食物。如患者未能满足目标能量,或不能耐受肠内营养,则给予患者肠外营养(parenteral nutrition,PN)支持,如患者口服营养达到目标能量需求,则停止PN。具体的干预措施是由临床医生根据患者的具体情况决定的。采用上述营养支持方案的患者纳入营养干预组,未采用上述营养干预方案的患者纳入对照组。营养干预组中根据具体干预方法可分为ONS组、PN组和ONS+PN组。
骨骼肌参数测量对采集的CT图像进行编码匿名处理后,2位放疗科医生分别把CT图像导入瓦里安Eclipse 13.5治疗计划系统中,CT值范围设定在-30+150 HU,通过使用半自动勾画功能在L3水平上选择勾画目标区域,并记录目标区域范围内的平均HU值为MRA。计算其中骨骼肌(包括腰大肌、竖脊肌、腰方肌、腹横肌、腹外斜肌、腹内斜肌)的横截面积之和(图1)即SMA,取其平均值再除以身高的平方(cm2/m2)[30]即可得到L3 SMI,以男性L3 SMI≤52.4 cm2/m2,女性L3 SMI<38.5 cm2/m2作为肌肉减少症的诊断标准[31]。
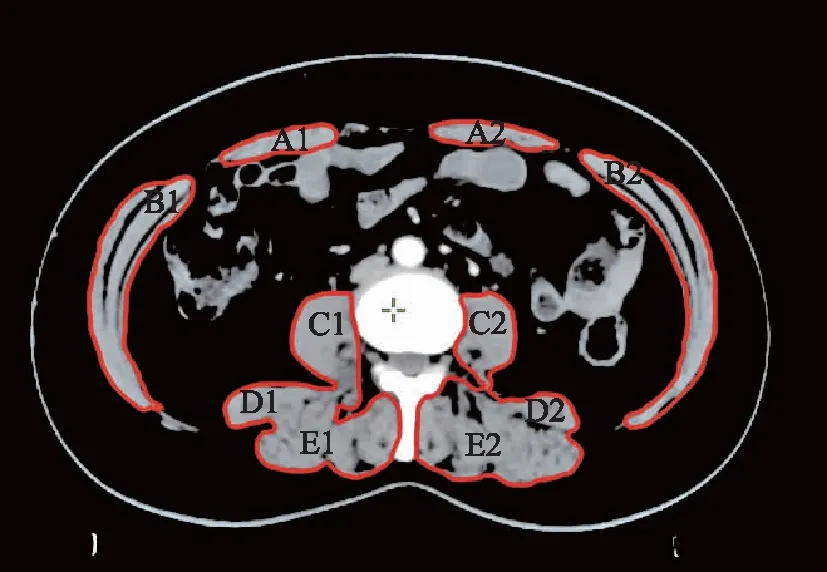
A1:右腹直肌;A2:左腹直肌;B1:右腹横、(内、外)斜肌;B2:左腹横、(内、外)斜肌;C1:右腰大肌;C2:左腰大肌;D1:右腰方肌;D2:左腰方肌;E1:右竖脊肌;E2:左竖脊肌
统计学处理采用SPSS 20.0统计软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验;计数资料的组间比较采用卡方检验或Fisher确切概率法检验;多组间比较采用方差分析;SMI下降与食管癌危险因素相关分析采用多元线性回归分析;P<0.05为差异有统计学意义。
结 果
营养干预组和对照组基线人口学特征比较营养干预组共入选49例,平均年龄(65.2±10.5)岁(44~84岁),其中,男42例,女7例,平均体质量(61.9±9.8)kg(42~85 kg),平均BMI(22.0±3.2)kg/m2(15.6~31.2 kg/m2)。对照组共入选44例,平均年龄(63.2±10.9)岁(38~89岁),其中,男36例,女8例,平均体质量(63.6±9.7)kg(45~96 kg),平均BMI(22.9±3.6)kg/m2(15.9~32.8 kg/m2)。两组在年龄、性别、体质量、身高、NRS2002评分、PS评分、BMI、SMA,SMI、MRA、骨骼肌减少症患病率、PA、T分期、N分期、M分期、放疗方式和化疗方案方面差异均无统计学意义(P均>0.05)(表1)。

表1 对照组和营养干预组治疗前基线人口统计学和临床特征的比较
营养干预组能量摄入情况将49例营养干预组患者根据具体的营养干预方法进行分层分析发现,ONS组、PN组和ONS+PN组平均干预时间分别为(47.3±16.6)、(40.2±10.0)和(37.8±14.0)d,差异无统计学意义(F=2.049,P=0.140);平均每人每日能量摄入分别为(273.5±252.8)、(310.6±311.2)和(745.3±637.8)kcal(1 kcal=4.1868 kJ),差异有统计学意义(F=5.870,P=0.005)。ONS组能量摄入小于400 kcal、400~600 kcal和大于600 kcal的例数分别为有13、1和2,PN组分别为14、1和5,ONS+PN组分别为6、1和6。
CCRT后营养干预组和对照组营养状况比较CCRT后,营养干预组有40例(40.3%)出现肌肉减少症,明显低于对照组的42例(45.2%)(χ2=4.247,P=0.038);营养干预组SMI丢失值为(1.4±8.3)cm2/m2,明显低于对照组的(5.4±9.1)cm2/m2(t=2.187,P=0.031);营养干预组分别有18、10例出现放、化疗延迟,均明显低于对照组的25(χ2=4.501,P=0.039)、19例(χ2=8.929,P=0.005);营养干预组放、化疗延迟时间分别为(2.3±4.4)、(0.9±1.3)d、均明显短于对照组的(4.2±5.3)(t=0.691,P=0.047)、(2.2±3.2)d(t=0.847,P=0.041)。两组在体质量丢失、PA、NRS2002评分、SMA、BMI、SMI和MRA方面差异均无统计学意义(P均>0.05)(表2)。
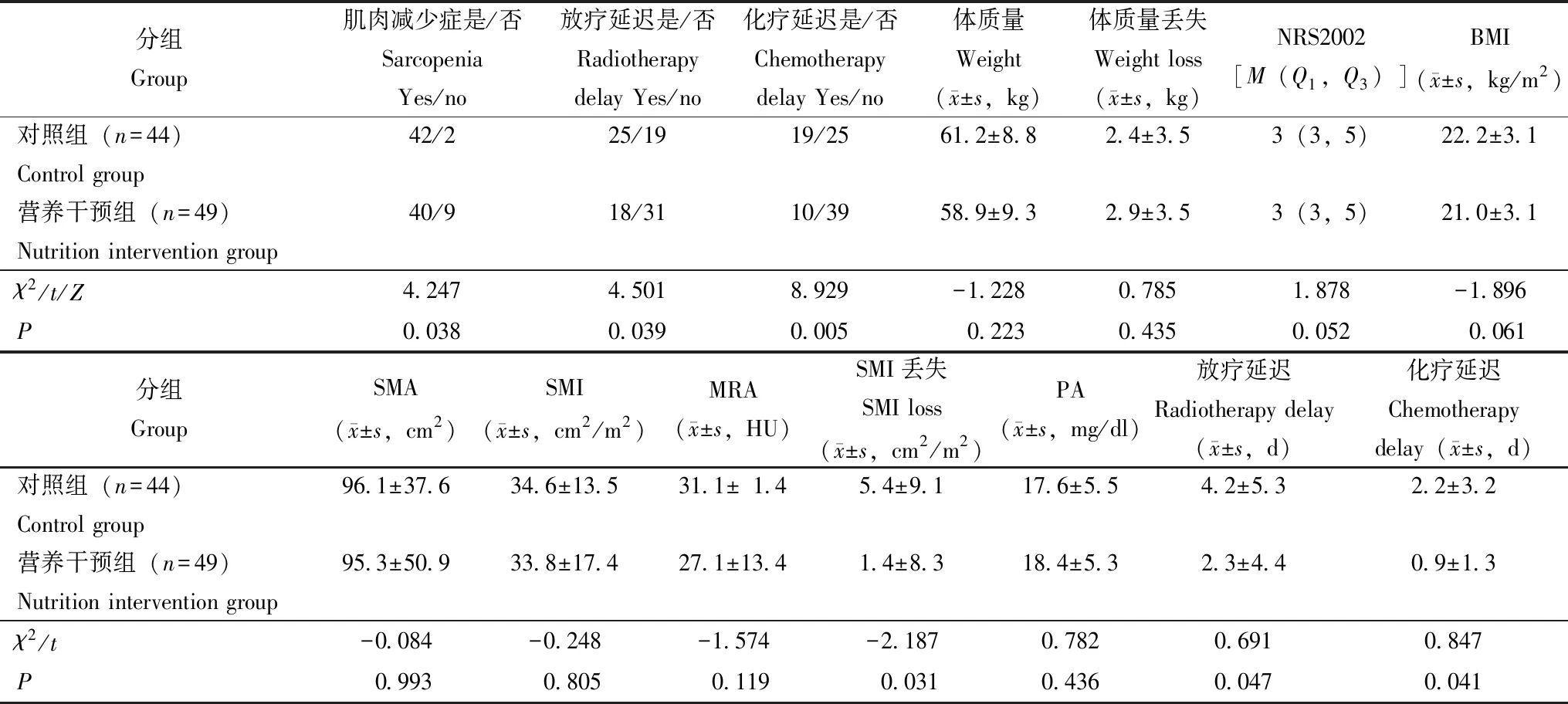
表2 同步放化疗后对照组和营养干预组营养状况的比较
CCRT前后肌肉减少症患病情况CCRT前,93例患者中,70例(75.2%)出现肌肉减少症;CCRT后,93例患者中,82例(88.2%)出现肌肉减少症;差异有统计学意义(χ2=5.183,P=0.023)。
影响L3 SMI下降的多元线性回归分析以CCRT后SMI下降值为因变量,患者入院时的一般资料为自变量,建立多元线性回归方程,SMI下降相关危险因素的变量说明见表3。全变量回归分析的决定系数R2=0.482,调整决定系数R2=0.458,方程经方差分析检验具有统计学意义(F=42.388,P<0.001)。多元线性回归结果显示,T分期(P=0.007)、N分期(P<0.001)和营养干预(P=0.014)是影响患者SMI下降的危险因素(表3、4)。

表3 骨骼肌指数下降相关危险因素的变量说明

表4 通过多元线性回归分析影响L3 SMI的重要因素
讨 论
高达80%的食管癌患者会出现营养不良,这可能与疾病或治疗相关[32]。晚期食管癌患者严重的营养不良可导致肿瘤恶液质,这是食管癌高死亡率的原因之一[33]。恶液质的特征包括进行性的体质量丢失、厌食、虚弱、疲劳、脂肪储备的消耗和骨骼肌蛋白质的严重分解[34-35]。合理的营养干预对于维持CCRT的治疗强度很重要[17],但营养干预对食管癌放化疗中改善骨骼肌质量的证据有限。
本研究发现,尽管给予患者进行了营养咨询和宣教,患者的依从性仍不足。在亚组分析中发现,ONS组平均每人每日摄入能量为(273.5±252.8)kcal,未能满足ONS对能量摄入的要求。高能量的ONS依从性普遍较差,Baldwin等[36]研究显示,肿瘤患者ONS 1周后依从性明显下降,在ONS结束时只有19%的受试者能够消耗完所规定的食物。按照营养不良治疗的五阶梯原则[37],当营养干预措施从ONS升级到PN时,患者的能量摄入应增多。但在本研究中,PN组能量摄入低于ONS+PN组。在前期315病例资料审查中我们发现,在放化疗期间接受管饲的患者仅有3例,PN组和ONS+PN组中可能包含了管饲适应证患者,造成了能量摄入没有随治疗阶梯上升而增加。在本研究中,管饲使用率低的原因可能需要更多的社会心理学研究来揭示。有研究表明,在食管癌术后4个月内,管饲管道给患者带来的并发症、睡眠中断及焦虑等都在一定程度上制约了管饲的使用[38]。
本研究入组的患者均存在营养不良,结果显示,营养干预组放疗、化疗延迟的发生率更低。Odelli等[39]在食管癌放化疗的研究中也对营养状况进行了分析,结果显示使用营养干预的患者放疗完成率更高,再次入院的发生率更低,与本研究结果相似。
肌肉减少症被定义为骨骼肌质量和力量的严重损耗,是恶液质的标志[30]。恶性肿瘤患者放化疗后的体质量减轻是由放化疗和肿瘤恶液质引起的,这两个因素相互影响且密不可分的。本研究显示,与治疗前相比,治疗后患者肌肉减少症的患病率明显上升,且SMI指数明显下降。Reisinger等[40]研究发现,食管癌放化疗前108例患者中有60例出现肌肉减少症,而放化疗后111例患者中有74例出现肌肉减少症,同时L3 SMI显著下降,与本研究结果相似,且本研究显示营养干预组的SMI丢失值明显少于对照组,提示营养干预可能降低了放化疗过程中的骨骼肌损失。
加拿大的一项纳入8160例肿瘤患者的研究结果显示,基线时BMI分布:肥胖比例为17%、超重比例为35%、正常体质量比例为36%、体质量不足比例为12%,但治疗结束后所有类别BMI的患者在体质量丢失和肌肉损失方面差异很大[30]。Tan[41]等对62例胰腺癌患者的研究显示,平均BMI为23.9,其中40%的患者处于超重或肥胖范围,但采用CT图像分析后发现,56%的患者被诊断为肌肉减少症。本研究结果显示,基线时BMI与SMI的下降无相关性。有研究证实在肿瘤患者出现体质量丢失前已经发生了肌肉蛋白质的分解[34],对于超重或肥胖的患者来说,骨骼肌的损失更具有隐匿性,这些患者的BMI可以在正常范围,但骨骼肌早已严重丢失,所以对于超重或者肥胖患者来说,用CT诊断骨骼肌减少症更重要。
在普通人群中,年龄是肌肉减少症的重要危险因素,从20到60岁,普通人群的肌肉质量下降约40%[42]。但在本研究中,食管癌患者的年龄对肌肉减少症的影响并没有表现出统计学差异。同样,国内一项研究也显示食管癌患者的年龄并不是肌肉减少症的重要危险因素[43]。这一结果仍需要更大样本量的研究来证实。
对于晚期癌症患者来说,肿瘤负荷、心理压力、不适感加重了恶液质和营养不良。本研究结果显示,肿瘤T、N分期与患者SMI下降呈正相关。晚期恶性肿瘤可能会增加宿主的静息能量消耗(resting energy expenditure,REE)。Cirillo等[44]发现,Ⅲ~Ⅳ期的结直肠肿瘤患者REE明显升高,这些患者SMI下降的速度明显高于早期患者。此外,Bachmann等[45]研究显示,胰腺癌患者分期越晚,肌肉减少症的发病率更高,患者的死亡率也更高。这表明晚期癌症患者可能经历了更严重的骨骼肌损耗。
虽然降低肿瘤负荷可以减轻骨骼肌的消耗[46]。然而,在放化疗降低肿瘤负荷的同时,也带来了剧烈的毒性,严重的不良反应限制了患者能量的摄入,从而恶化了患者的营养状况[13]。本研究结果显示,化疗方案、放射治疗方式对骨骼肌的影响未表现出统计学差异。
本研究存在以下局限性:(1)单一机构数据不足以得出普遍结论;(2)数据为非前瞻性收集;(3)采集图像所用CT型号随机,可能对CT HU值有影响。今后的研究方向是开展前瞻性随机对照研究。综上,本研究结果显示,营养干预能够改善食管癌CCRT过程中放化疗延迟的发生率,减少SMI丢失,降低肌肉减少症的发生率。SMI下降主要和基线时T分期、N分期和营养干预相关。
