慢性肾脏病继发结核病患者的临床特征及预后
2020-11-08许书添胡伟新王兆峰袁冬梅李世军
李 喆 陶 磊 许书添 胡伟新 王兆峰 袁冬梅 蒋 静 李世军
慢性肾脏病(CKD)和结核病(TB)都是现阶段我国重要的公共卫生问题,目前我国CKD的患病率为10.8%[1],活动性肺结核患病率为459/10万[2]。“十三五”全国结核病防治规划要求加强重点人群的防治,特别是非艾滋病免疫功能抑制患者。个体固有免疫、非免疫防御和个体细胞介导的免疫功能水平等内源性因素决定着结核分枝杆菌(MTB)感染后发病的风险[3]。合并多种疾病者更易进展至活动性TB,既往MTB感染者进展至活动性TB的风险:维持性血液透析患者相对风险(OR)为10~25,糖尿病患者为2~4,器官移植者为20~70,免疫抑制剂治疗者为10[4]。目前对于CKD非透析患者继发TB的研究多为个案报道,免疫抑制剂治疗前是否需要筛查结核潜伏感染(LTBI)以及TB发病后如何调整药物治疗,国内暂无相关指南。本研究回顾性分析CKD患者治疗过程中初次确诊TB的临床表现和影像学特征及预后,提高对CKD患者结核病的防控意识。
对象和方法
研究对象在国家肾脏疾病临床医学研究中心电子病历系统中,通过国际疾病分类ICD-10诊断编码检索出2010年1月至2020年1月确诊的CKD并发TB患者330例。所有患者均符合KDIGO-CKD诊断标准[5]。肺结核和结核性胸膜炎确诊依据《肺结核诊断WS288-2017标准》[6]。结核性脑膜炎诊断参照《2019中国中枢神经系统结核病诊疗指南》[7]。结核性心包炎诊断参照《2015年欧洲心脏病学会心包疾病诊断和治疗指南》[8]。排除标准:(1)肾移植患者;(2)陈旧性TB新发CKD患者;(3)重新评估,TB诊断依据不充分;(4)临床资料不完整。本研究最终纳入符合上述标准的CKD继发TB患者71例(图1)。
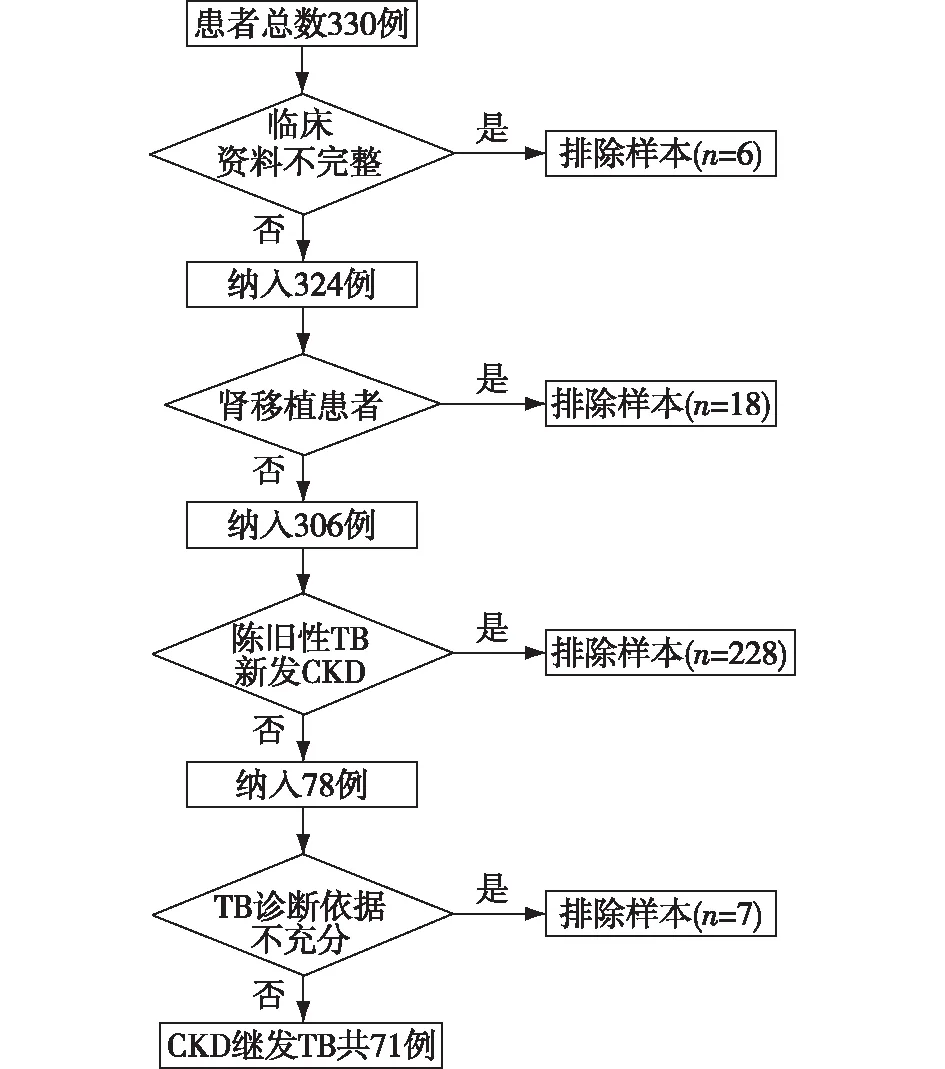
图1 慢性肾脏病(CKD)继发结核病(TB)患者筛选流程
临床资料及实验室指标记录患者的性别,年龄,CKD起病至确诊TB时间,出现TB相关症状至TB确诊时间,肺结核及肺外结核类型,肾活检病理,实验室指标,TB起病前免疫抑制治疗方案。对CT影像学特征由影像科和呼吸科医师重新评估。门诊以及电话随访远期预后。
统计学方法使用《SPSS 19.0》软件进行数据分析,正态分布计量资料以均数±标准差表示,偏态分布计量资料以中位数(四分位间距)表示。依据数据是否符合正态分布,组间比较用t检验或Mann-Whiteny非参数检验。计数资料以百分比表示,组间比较用χ2检验或者Fisher精确检验。P<0.05为差异有统计学意义。
结 果
一般资料71例患者中男性43例(60.56%),CKD起病年龄为34.25±16.41岁,51例长期居住于农村。TB发病年龄为37.78±16.0岁,确诊TB至CKD起病中位时间为17(8,66)月,TB确诊时体质量指数(BMI)21.67±3.28 kg/m2,出现TB症状至确诊TB中位时间为14(9,30)d。63例接受肾活检,其中狼疮性肾炎15例、膜性肾病和足细胞病各12例、IgA肾病11例、糖尿病肾病3例、局灶节段性肾小球硬化、抗中性粒细胞胞质抗体(ANCA)相关性肾炎和多发性骨髓瘤肾病各2例,C3肾小球病、膜增生性肾小球肾炎、过敏性紫癜性肾炎、Kimura病各1例。合并高血压10例,类固醇性糖尿病10例,2型糖尿病 4例,慢性阻塞性肺疾病2例。64例曾接受免疫抑制剂治疗,其中泼尼松60例、雷公藤多苷29例、环磷酰胺19例、他克莫司16例、吗替麦考酚酯15例、来氟米特7例、环孢素A 4例、硫唑嘌呤和利妥昔单抗各1例。累计使用免疫抑制剂数目:1种14例、2种22例、3种20例、4种3例、5种5例。
TB起病临床表现及实验室检查本研究患者确诊TB时与前期确诊CKD时比较,尿蛋白、血白蛋白、球蛋白、白细胞、血小板、总胆固醇、三酰甘油、血清肌酐、尿素氮以及免疫学指标均无明显差异,仅C反应蛋白(CRP)显著升高(P=0.001)(表1)。以确诊TB时的CD4+T细胞数值进行分组比较发现,CD4+T细胞<300个/μl组累计使用免疫抑制剂数目、TB确诊时发热的比例、CRP均明显高于CD4+T细胞≥300个/μl组,血白细胞、总淋巴细胞计数、血红蛋白、CD3+T细胞、CD4+T细胞、CD8+T细胞、免疫球蛋白M则低于CD4+T细胞≥300个/μl组,余临床表现及实验室检查两组无明显差异(表2)。
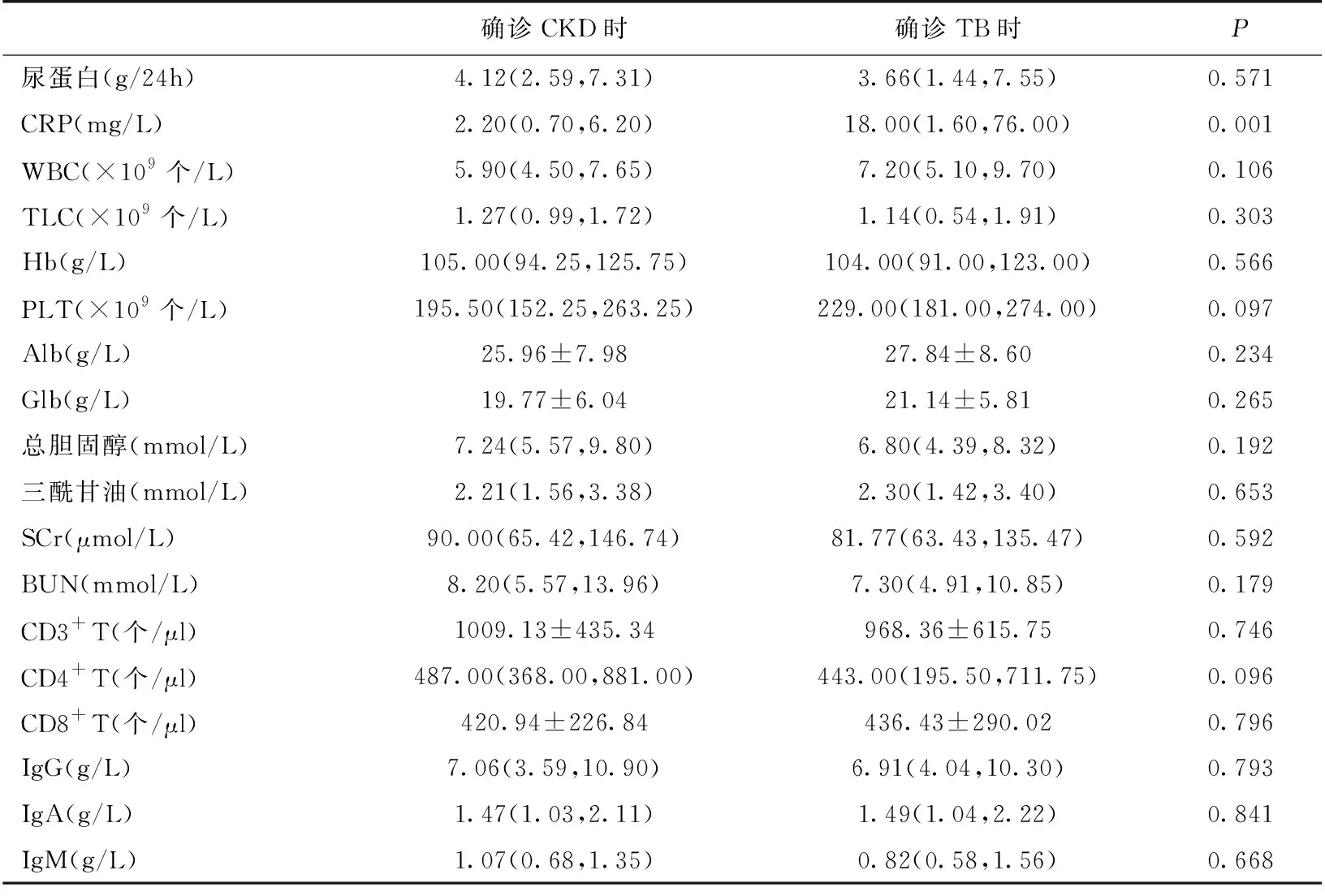
表1 确诊CKD时和确诊TB时的实验室检查结果

表2 CKD患者继发TB时的临床表现、实验室检查
66例患者确诊肺结核,其中合并结核性胸膜炎7例,骨结核1例,结核性脑膜炎1例,喉结核1例。5例患者仅有肺外结核,其中结核性脑膜炎3例,结核性心包炎2例。肺结核确诊方法:10例因痰液抗酸染色显微镜检查阳性确诊;37例根据血液结核感染T细胞γ干扰素释放试验(IRGA)阳性联合胸部CT特征确诊;19例根据临床表现联合胸部CT特征确诊。结核性胸膜炎确诊方法:6例胸水IRGA阳性联合胸部CT特征、胸腔积液特征(渗出液,腺苷脱氨酶升高、淋巴细胞为主)符合临床诊断标准;1例根据结核菌素(TST)皮肤试验阳性联合胸腔积液特征确诊。结核性脑膜炎确诊方法:2例根据发热、意识不清等症状,脑脊液抗酸染色显微镜检查阳性、脑脊液特征(蛋白、白细胞增多,低糖、低氯)确诊;2例根据发热、头痛等症状、脑脊液特征、神经影像学表现符合临床诊断标准。
胸部CT 66例肺结核患者在TB起病时均行胸部CT检查,其中CD4+T细胞<300个/μl组弥漫粟粒性阴影的比例高于CD4+T细胞≥300个/μl组,肺空洞的比例低于CD4+T细胞≥300个/μl组,不同CD4+T细胞水平肺结核CT影像学特点举例见图2,余影像学特征两组无明显差异(表3)。有19例患者CKD确诊时也完善了胸部CT,对比CKD确诊和肺结核确诊时的两次胸部CT,发现有10例CKD确诊时即有可疑TB病灶(图3)。

图2 不同CD4+T细胞水平慢性肾脏病继发肺结核CT影像学特点举例A:患者确诊狼疮性肾炎,泼尼松、他克莫司治疗,4个月后CT见两肺多发弥漫粟粒性阴影,CD4+T细胞203个/μl;B:患者确诊C3肾小球病,泼尼松、吗替麦考酚酯、雷公藤多苷治疗,6个月后CT见右肺下叶不均匀厚壁空洞,左肺下叶见斑片影,CD4+T细胞420个/μl
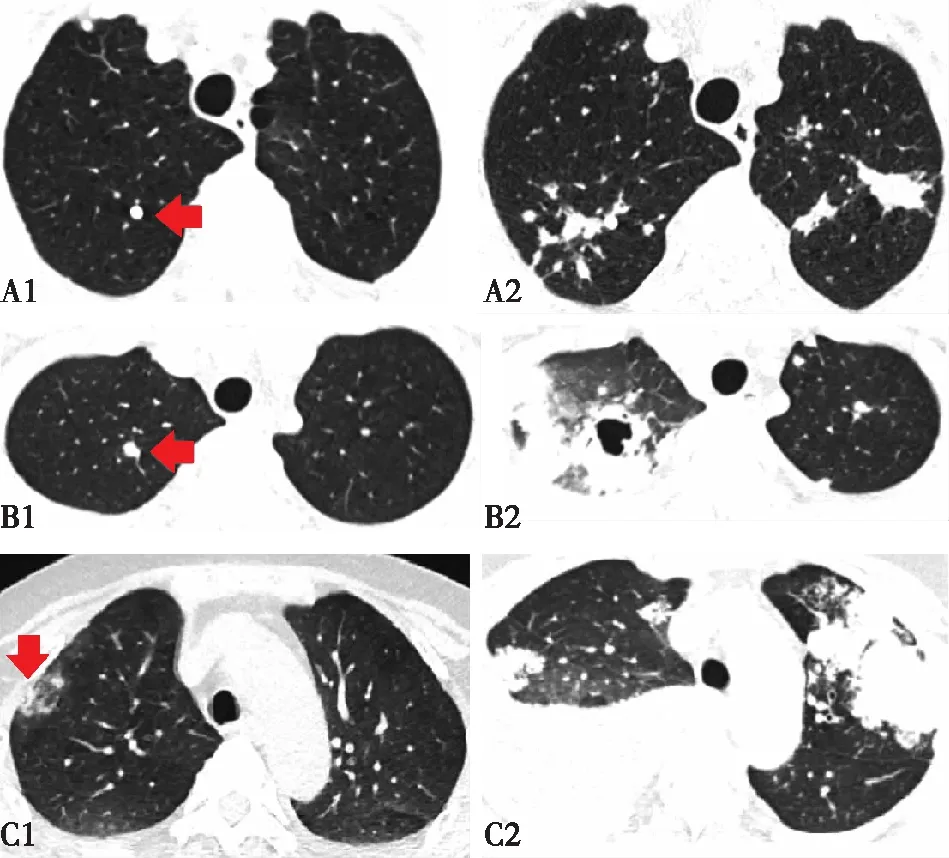
图3 CKD患者TB起病前CT可疑病灶变化举例CKD:慢性肾脏病;TB:结核病;ANCA:抗中性粒细胞胞质抗体;A:患者确诊ANCA相关性肾炎时CT见右肺上叶小钙化灶(A1),泼尼松、环磷酰胺、硫唑嘌呤治疗,15个月后CT见两肺多发结节、斑片影(A2);B:患者确诊狼疮性肾炎时CT见右肺上叶尖段小结节(B1),泼尼松治疗,1个月后CT见两肺多发粟粒样结节,右肺上叶空洞性病变(B2);C:患者确诊足细胞病时CT见两肺上叶胸膜下斑片、云絮影(C1),泼尼松、他克莫司治疗,36个月后CT见两肺多发实性结节、斑片影,右肺下叶膨胀不全,右侧大量胸腔积液(C2)
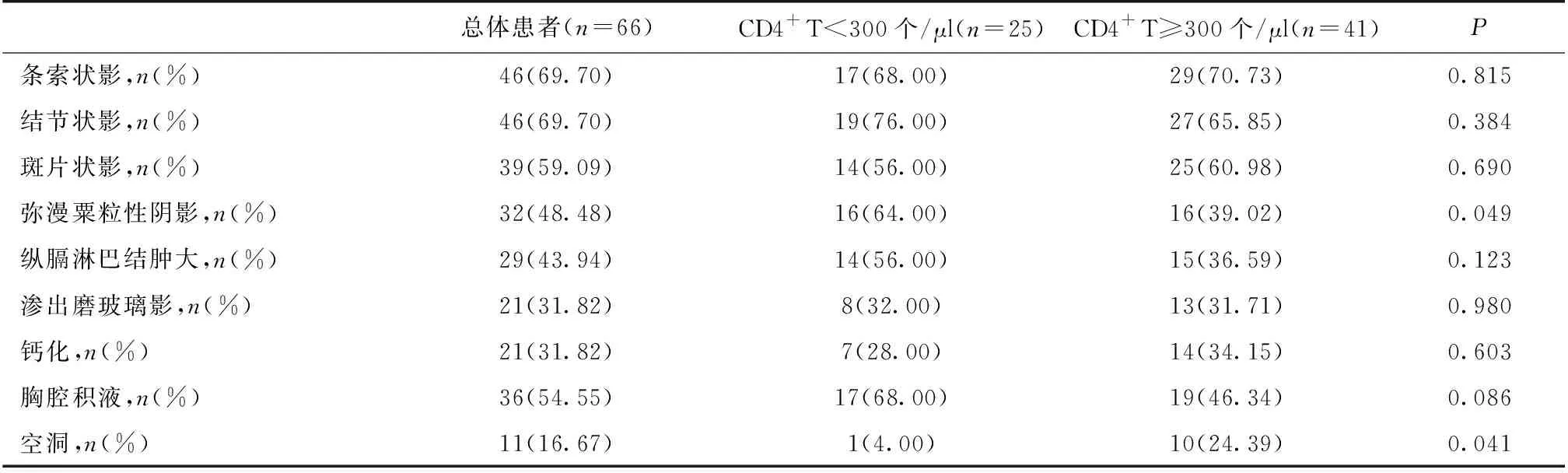
表3 肺结核患者的胸部CT影像特征
随访和预后本研究71例患者均在当地结核病专科医院接受规范化抗结核治疗,其中失访6例,中位随访时间58(28,78)个月。24例(36.92%)患者在49(40,63.5)岁时进展至透析治疗,11例(16.92%)患者在随访12(2,45)个月后的65(47,70)岁时死亡。4例结核性脑膜炎患者中死亡3例,2例死亡原因与结核病直接相关,均为结核性脑膜炎继发的脑积水。其余患者结核病均有效控制,无复发和扩散(图4)。
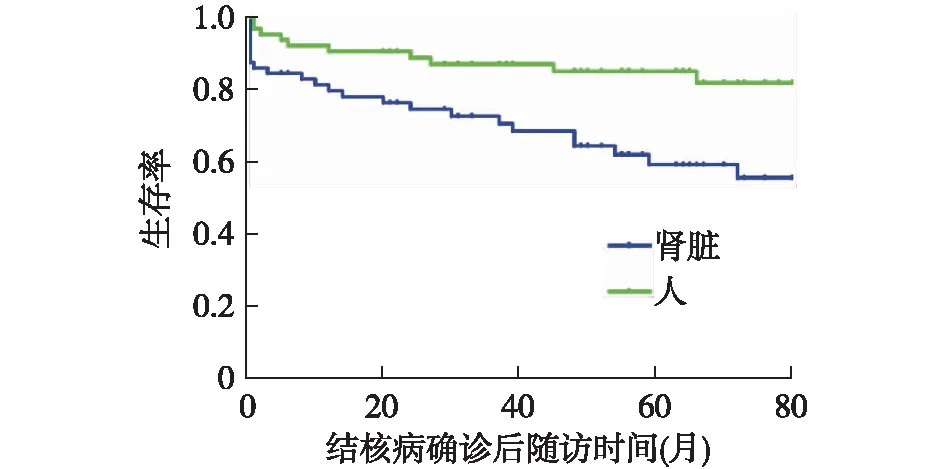
图4 慢性肾脏病继发结核病患者肾脏及人生存曲线
讨 论
结核病目前仍是全球导致死亡的十大原因之一,根据WHO《2019年全球结核病报告》估算,全球结核潜伏感染人群约17亿,占全人类的1/4。2018年全球新发结核病患者约1000万,我国是全球30个结核病高负担国家之一,患者数量仅次于印度,位居全球第二,每年新发结核病患者约90万,位列全球第三。《遏制结核病行动计划(2019年~2022年)》要求加强重点人群的主动筛查。CKD患者为非艾滋病免疫功能抑制人群,常伴随树突细胞、T细胞、B细胞消耗以及单核细胞、中性粒细胞吞噬能力减弱所引起的免疫缺陷[9]。部分CKD患者治疗期间所用的以糖皮质激素为代表的免疫抑制剂,可抑制T细胞、巨噬细胞的活化增殖和分化存活,促使T细胞凋亡。长期应用会降低机体杀灭病原微生物的能力,新发感染以及潜伏感染激活风险增加。
1974年,Pradhan等[10]首先报道了5例血液透析(HD)患者继发活动性TB。本中心1974年至1987年有9例HD患者确诊TB,占同期HD患者的7.26%[11],1990年~1994年有20例HD患者确诊TB,占同期HD患者的4.7%[12]。后续研究持续关注透析[13]和肾移植[14]人群,关于CKD非透析患者的文献不多。韩国的一项全国性队列研究发现CKD非透析人群活动性TB发病率为137.5/10万人年,高于匹配非CKD人群的121.9/10万人年[15]。我国台湾省CKD非透析患者TB发病率是非CKD患者的1.47倍[16]。在我国[17]和印度[18]的两项儿童原发肾病综合征的回顾性研究中均找到约9.3%的患儿并发TB。Yuan等[19]认为肾功能与TB之间呈负相关,肾功能越差,结核发病率越高。Igari等[20]在日本人群中发现eGFR<30 ml/(min·1.73 m2)是CKD继发涂阳肺结核患者预后不佳的独立危险因素。所以CKD尤其是需要服用免疫抑制剂的患者,是继发TB的高危人群,需要临床加以重视。
本研究继发TB的CKD患者肾脏病理表现多样,前四位分别为狼疮性肾炎、膜性肾病、足细胞病和IgA肾病。90.14%的患者使用了免疫抑制剂,部分患者联合多种免疫抑制药物,甚至多次调整治疗方案。至TB确诊时CRP显著升高,尿蛋白、低蛋白血症无明显好转。19.72%的患者合并糖尿病,而糖尿病患者为TB的重点防控人群,提示CKD患者在治疗期间需要密切监测血糖变化,及时治疗糖尿病。本组患者TB的临床症状不典型,与第五次全国结核病流行病学抽样调查相比[2],痰涂阳性率接近(14.08%vs14.35%),咳嗽、咳痰(53.62%vs87.97%)、胸痛(9.86%vs20.54%)、盗汗(9.86%vs21.89%)、咯血(1.41%vs21.89%)的比例偏低,而发热的比例偏高(69.01%vs18.51%),发热比例与我国艾滋病继发TB患者接近(69.01%vs71.9%)[21]。
CKD继发肺结核患者的胸部CT表现病变形态多样,病变范围广,影像学特点与免疫水平相关。当患者CD4+T细胞减少、免疫功能显著降低时,MTB易增殖,难以限制结核病灶的扩散,故双肺弥漫粟粒性阴影多见,同时由于抑制MTB生长的巨噬细胞功能减弱,变态反应低下,结核病灶不易形成干酪样坏死,难以形成肺内空洞。上述影像学特点在艾滋病、糖尿病、器官移植、营养不良、恶性肿瘤等继发肺结核患者中亦有报道[22]。荟萃分析发现艾滋病尤其是CD4+T细胞低水平者,肺外结核更常见[23]。本研究CD4+T细胞<300个/μl患者肺外结核比例偏高(35.71%vs25.58%),但由于样本量偏少,未发现统计学差异。
CKD人群是否需要进行TB筛查,目前国内暂无指南,WHO和北美国家的指南推荐肾移植受者、供者以及终末期肾病(ESRD)患者常规使用TST和IRGA检测进行TB筛查,上述指南均未涉及CKD非透析人群[24]。仅有英国胸科学会(BTS)推荐对于CKD患者中的TB高危人群,如既往MTB感染、TB病人密切接触、接受过抗TB治疗、以及非英国出生的亚裔非裔人群接受胸片和IRGA检测,但不建议对所有CKD患者进行常规TB筛查[25]。本研究19例患者CKD确诊时的胸部CT中有10例发现TB可疑病灶。结合我国现阶段仍是结核病高负担和发展中国家的国情,对全体CKD患者进行IRGA筛查经济负担较重,可以考虑对需要服用免疫抑制剂的CKD患者,先常规完善胸部CT,找出存在可疑病灶的人群,再完善IRGA试验来筛查LTBI。
本组CKD患者通过病原学确诊TB的占16.9%,其余均为临床诊断,需要结合患者的症状、体征、影像学表现、免疫学检查甚至试验性抗结核疗效加以鉴别,迅速确诊不易。一旦CKD患者继发活动性TB,治疗颇为棘手。一方面利福平等抗结核药物可降低吗替麦考酚酯、他克莫司和环孢素的血药浓度,《BTS指南》建议接受利福平的肾移植患者应将糖皮质激素剂量加倍[25]。但免疫抑制剂加量会导致其他病原微生物感染风险的增加。另一方面目前对CKD患者服用免疫抑制剂期间同时接受抗结核治疗并无统一意见,该类患者抗结核方案是否需要调整、免疫抑制剂未停用的情况下抗结核疗程能否结束都缺乏相关临床研究。
本研究的局限性在于为单中心、回顾性研究,样本量较小,缺乏对照组,难以明确CKD患者TB发病的独立相关因素,需待后续加以进一步研究。
综上所述,TB多继发于合并使用免疫抑制剂及合并糖尿病、且尿蛋白不缓解的CKD患者。其临床表现不典型,发热、双肺弥漫粟粒性阴影、肺内空洞等表现与免疫水平相关,预后不佳。CKD患者治疗前需警惕LTBI的风险,对于胸部CT存在可疑病灶者,需进行结核筛查,排除结核潜伏感染后再行免疫抑制剂治疗。
