SPHK1与MMP2蛋白在结肠癌组织中的表达及临床意义
2020-11-06赵志龙雷建卫张丽芳
赵志龙,雷建卫,张丽芳
1.宝鸡市中心医院肿瘤外科,陕西 宝鸡 721000;2.宝鸡市中医医院病理科,陕西 宝鸡 721000
结肠癌是消化道常见的恶性肿瘤,其发病率在所有消化道恶性肿瘤中排名第三[1],近年来随着人类生活水平的提高以及饮食结构的改变,结肠癌发病率仍然有一定程度的上升[2-3]。目前针对结肠癌的分子靶向治疗在临床应用中取得了很大的疗效,但仍然有部分患者在初诊时即已经发生了局部淋巴结转移或远处转移,使后续的治疗更加棘手[4]。鞘氨醇激酶1(SPHK1)是鞘磷脂的活性代谢产物1-磷酸鞘氨醇在体内合成过程中的一个限速酶,参与体内的炎症反应、心血管疾病、神经系统疾病的病理生理过程[5-7],最近大量的研究提示SPHK1与多种恶性肿瘤细胞的增殖、凋亡以及迁移过程密切相关[8-9]。基质金属蛋白酶2(MMP2)在肿瘤中发挥的作用目前较为明确,它可以通过促进细胞外基质的降解影响肿瘤细胞的转移[10-11]。SPHK1 和肿瘤侵袭与转移的相关细胞学实验发现其可能通过MMP2 发挥作用,因此本研究拟通过免疫组化检测SPHK1 蛋白与MMP2 蛋白在人结肠癌组织中的表达情况,初步探讨SPHK1 蛋白与结肠癌组织的关系,为进一步的细胞学实验提供一定的思路。
1 资料与方法
1.1 一般资料 收集宝鸡市中心医院2014 年1月至2018 年12 月期间收治的结肠癌患者石蜡标本,共计201 例,所有患者均经病理学确诊结肠癌,术前均无放化疗以及免疫相关治疗史。其中男性109 例,女性92 例;年龄35~78 岁,平均62 岁;右半结肠癌109 例,左半结肠癌92 例。根据AJCC TNM 分期标准(2017 年第8 版)对结肠癌进行分期,其中淋巴结阳性者112 例,淋巴结阴性者89 例;肿瘤T 分期中,T123 例,T232 例,T382 例,T474 例;组织学分化中:高分化66 例,中低分化135 例。同时以距肿瘤组织边缘5 cm 为界限,取癌旁组织201 例,排除其中仍然有肿瘤细胞或非典型细胞后剩余156 例,镜下未见明确肿瘤细胞且无炎症、增生等病变。
1.2 方法 标本术后30 min 内置入甲醛溶液中固定24 h 再进行石蜡包埋并制备病理切片,使用免疫组化SP 法检测并进行染色,严格按照说明书进行二甲苯脱蜡、无水酒精水化、3%H2O2阻断、柠檬酸缓冲液抗原修复、一抗过夜后第二日加二抗、DAB 染色、制片。兔抗人多克隆抗体SPHK1 (bs-2652R)与MMP2 (bs-0412R)分别购自北京博奥森生物有限公司,抗体稀释浓度分别为1∶200和1∶300。采用磷酸盐缓冲液(PBS)作为阴性对照。SP 试剂盒与DAB 显色剂均购自中山金桥生物公司。
1.3 结果判定 染色强度的判定标准依据参考文献[12-13],由两位高年资病理医师读片分析,以镜下在细胞质或细胞核内发现黄色颗粒定义为蛋白表达阳性,随机观察5个高倍视野,按阳性细胞数分为四个级别评分,0%~24%、25%~49%、50%~74%、>75%分别评分为1 分、2 分、3 分、4 分。以染色强度评分为三个等级:细胞未着色为0分,棕黄色1分,褐色为2分。结果最终得分的判定标准为着色强度分数乘以阳性细胞百分比的分数,最终得分:0 分为阴性,1~3 分为低表达,4~8分为高表达。
1.4 统计学方法 应用SPSS18.0 统计学软件进行数据,计数资料组间比较采用χ2检验,SPHK1 与MMP2 蛋白表达的相关性采用Spearman 等级相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 SPHK1 蛋白和MMP2 蛋白在结肠癌组织中的表达情况 所有标本进行免疫组化染色后发现SPHK1 与MMP2 蛋白主要定位于细胞质中(图1)。SPHK1 蛋白和MMP2 蛋白在结肠癌组织中的表达率分别为54.7%、64.7%,明显高于癌旁组织中的39.7%、24.4%,差异均具有统计学意义(P<0.05),见表1。
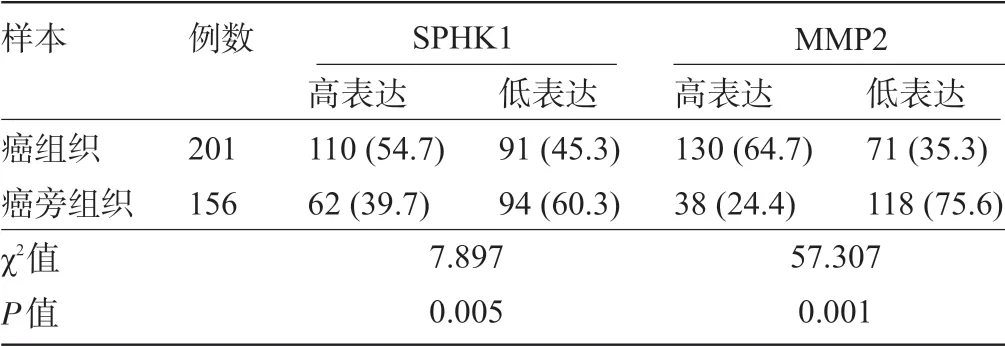
表1 SPHK1 与MMP2 在人结肠癌组织及癌旁组织中的表达水平比较[例(%)]
2.2 SPHK1 和MMP2 蛋白的表达与临床特征的关系 SPHK1 蛋白在人结肠癌组织中的表达主要与患者的淋巴结是否转移、组织学分化程度、T 分期以及血管是否侵犯有关(P<0.05)。MMP2 蛋白在结肠癌组织中的表达与患者淋巴结是否转移,T 分期、M分期以及血管侵犯有关(P<0.05),见表2。
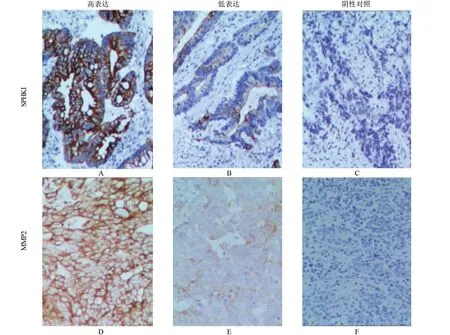
图1 SPHK1与MMP2在人结肠癌组织与癌旁组织中的表达

表2 SPHK1和MMP2的表达与临床病理参数的关系(例)
2.3 结肠癌组织中SPHK1 与MMP2 表达的关系 经Spearman 秩相关性分析显示,SPHK1 蛋白与MMP2蛋白在表达量之间呈正相关(r=0.352,P<0.05),见表3。
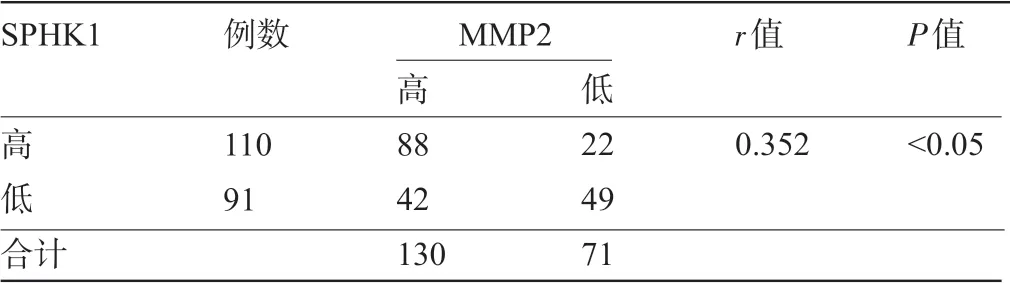
表3 SPHK1与MMP2蛋白在人结肠癌组织中表达的相关性(例)
3 讨论
研究发现脂类代谢在肿瘤的发生、发展以及侵袭与转移中发挥着重要的作用[14]。丝氨酸(Cer)、鞘氨醇(Sph)以及鞘氨醇1-磷酸(S1P)在体内脂质代谢过程中保持动态平衡,当平衡倾向于Cer和Sph时,细胞开始进入程序性死亡过程,当平衡倾向于S1P 时细胞会继续生存并持续增殖[15]。研究发现SPHK1蛋白可将Sph磷酸化为S1P,从而促进细胞的增殖与迁移[16]。
SPHK 家族中共有7 个成员,SPHK1 为鞘磷脂的活性代谢产物1-磷酸鞘氨醇(S1P)生物合成过程中的限速酶,参与到体内磷脂的代谢过程,其主要分布在人体的脾脏、脑组织、胸腺细胞中[17-18]。然而最近几年肿瘤界学者对其深入研究后发现SPHK1 蛋白在人类多种恶性肿瘤细胞或组织中均有不同程度的表达,扮演着癌基因的角色。研究发现SPHK1 可促进肿瘤血管的生成、提高肿瘤的增殖活性、抑制肿瘤细胞的凋亡以及促进肿瘤细胞的侵袭与转移[19]。我国学者郑晓东[20]在研究乳腺癌过程中发现SPHK1 蛋白在乳腺癌组织中的表达明显高于正常组织,且其高表达与乳腺癌细胞的上皮-间质转换有关;使用siRNA 沉默SPHK1基因后对其侵袭与迁移能力进行测定,发现细胞的侵袭与迁徙能力明显下降,提示SPHK1可能参与到乳腺癌细胞的转移过程中。在胃癌中他们同样发现SPHK1蛋白高表达,而癌旁组织中很少或者几乎不表达,SPHK1 蛋白在胃癌组织中的高表达与肿瘤的T分期、N分期以及是否远处转移有关,这与我们的研究结果较为类似。关于SPHK1 在结肠癌组织与细胞中的表达亦有少量研究,SPHK1在结肠癌组织中同样过度表达,并与淋巴结转移、肝脏转移以及较晚的TNM分期有关[21]。
转移是恶性肿瘤最重要的特征,一般要经过以下过程:原发肿瘤细胞穿过基底膜与血管,进入血液,随血流到达全身各个器官,再通过血管进入其他组织器官进而增殖。因此癌细胞发生转移的第一个条件就是细胞外基质的降解,从而为恶性肿瘤的转移提供先决条件。目前大量的研究已经证实基质金属蛋白水解酶家族(MMPs)中的MMP2 在上述过程中扮演着极其重要的角色[22]。
BAO等[23]在肝癌细胞中发现,无论通过何种办法只要阻断SPHK1蛋白的生成,就可以使肝癌细胞侵袭以及迁移能力下降,另外在其他肿瘤细胞株中的研究也发现了SPHK1 蛋白可以参与到肿瘤细胞的侵袭与转移过程[24-25]。通过文献回顾后发现了一条SPHK1-S1P-ERK-VEGF相互作用的通路[26],SPHK1将细胞膜上的Sph 磷酸化生成S1P,S1P 被转运到细胞外,然后与其特异性受体相互偶联,激活细胞内的G蛋白偶联受体信号通路,ERK蛋白在该信号转导通路中负责将信号传导至细胞核内,在此过程中有NF-κB、MMP以及VEGF等分子的转录与活化参与,从而引起细胞的增殖、侵袭以及转移[27-28]。
LIU等[29]团队在结直肠癌组织与细胞中的研究发现,SPHK1 蛋白可以激活ERK1/2 通路从而增加MMP2/9蛋白的表达,促进结肠癌细胞的侵袭与迁徙,提示ERK1/2 信号通路的异常激活,可能促使结肠癌细胞向更加恶性的阶段进展。本研究结果显示人结肠癌组织中SPHK1的阳性表达明显高于癌旁组织,且SPHK1蛋白的表达与结肠癌患者的T分期、N分期、组织学分化程度以及是否血管侵犯有关,而与性别、年龄和肿瘤位置等因素无关。
LONG 等[30]研究了85 例结肠癌组织中SPHK1 蛋白的表达情况后发现,使用siRNA沉默SPHK1的表达后,结肠癌细胞的增殖活性明显受到抑制,与此同时E-钙黏素蛋白的表达是增加的,此时EMT发生逆转,导致其侵袭和迁移能力下降。敲除SPHK1 基因的结肠癌细胞侵袭与迁移能力明显下降,细胞内MMP2蛋白的表达量也发生不同程度的下降[29]。因此推测SPHK1 对结肠癌细胞的侵袭与迁徙能力的影响可能与MMP2 蛋白的合成与表达有关。本研究通过对结肠癌组织标本中的SPHK1 蛋白的表达与MMP2 蛋白表达进行相关分析后发现两者呈正相关。因此可以猜测SPHK1 对结肠癌细胞的侵袭与转移能力的影响可能是通过MMP2发生作用。
综上所述,SPHK1蛋白与MMP2蛋白在人结肠癌组织中的表达量是增高的,而且两者的表达具有一定的协同关系,这也暗示着SPHK1在人结肠癌组织中可能是通过MMP2起作用的,而有其他肿瘤细胞学研究提示MMP2可能是SPHK1蛋白的下游分子,但在结肠癌组织中的精确机制尚未明了。因而,随后的研究可能更多的会集中在SPHK1 上下游分子的寻找方面以及相关作用机制方面的研究。
