11C-MET PET显像不同重建算法对术前胶质瘤级别判断效能的影响
2020-11-05周维燕肖见飞朱毓华朱锋管一晖
牧 辰 周维燕 华 涛 李 明 肖见飞 朱毓华 朱锋 管一晖
神经肿瘤疗效评价(response assessment in neuro-oncology, RANO)工作组建议在常规磁共振显像基础上,氨基酸显像剂正电子发射断层显像(positron emission tomography, PET)用于胶质瘤诊断治疗的各个环节[1]。11C标记的蛋氨酸11C-MET作为经典的氨基酸PET显像探针,可以无创性地实现胶质瘤分级、鉴别诊断、肿瘤范围界定、确定脑活检部位、放疗计划拟定、预后以及疗效评价等[2-3]。
在氨基酸脑显像中,胶质瘤组织的放射性摄取要显著高于正常脑组织,从而使得病灶的显示和图像分析更为方便和直观[4]。11C-MET显像是目前广为应用的氨基酸显像剂,对高低级别胶质瘤具有很好的鉴别作用,但基于较大中国人群样本的相关研究结果较为有限,国内赵晓斌等[5]纳入63例脑干胶质瘤发现11C-MET PET/CT的参数与胶质瘤高低级别有关,其诊断高级别胶质瘤的准确度高达80.5%,特异度为91.7%。目前国内PET仪器多样化,PET显像中心建设增长较快,脑PET图像的重建方法亦不尽相同,本次回顾性研究拟以单中心中国人群病例数据为基础,选择常见的PET脑图像重建方法(滤波反投影以及有序子集最大期望值迭代法)进一步验证并探讨不同算法对11C-MET PET是否会对术前辅助胶质瘤级别判断的诊断效能产生影响。
方 法
1.患者
回顾性分析2012年2月至2017年11月我中心所有未经治疗颅内占位行11C-MET显像的病例,将经病理证实为胶质瘤的病例纳入研究,符合纳入标准者共计113例。PET显像与获得神经病理学诊断时间间隔对于II级或III级胶质瘤不超过100天,而对IV级胶质母细胞瘤则不超过30天。此项回顾性PET数据分析研究经医院伦理委员会批准,且与《赫尔辛基宣言》无冲突。
2.11C-MET PET显像方法
11C-MET经模块半自动化合成。11C-MET所需放射性原料为11C-CO2(德国Siemens公司生产的RDS Ⅲ回旋加速器),前体为高半胱氨酸,采用美国GE-Tracerlab-Fxc11C标记合成模块合成;11C-MET放化纯度>95%,无菌热源检测合格。所有病人在显像之前至少空腹4小时。注射11C-MET 10~15分钟后使用德国Siemens Biography64HD PET/CT进行头部静态显像。CT采集参数:电压120kV,电流160mA,层厚3.0~5.0mm,扫描时间为18~30秒;同一视野内采用三维模式进行PET采集,采集时间为20分钟。PET图像应用CT数据进行衰减校正,将所采集的脑PET原始数据分别进行滤波反投影法(filtered back projection, FBP)及有序子集最大期望值迭代法(ordered subsets expectation maximization, OSEM)方法重建后,获得脑横断面、冠状面及矢状面PET、CT及PET/CT融合图像。其中,FBP使用Gaussian滤波函数重建,半宽高3.5mm;OSEM使用Gaussian滤波函数重建,半宽高2.0mm,3次迭代,21个子集。
3.图像分析方法
所有PET/CT图像均在西门子后护理工作站Syngo.via由2名核医学科医师经讨论一致后分析完成。在Syngo.via对肿瘤进行手动三维立体感兴趣体积勾画,获得肿瘤SUVmax及SUVpeak半定量参数;同时选定对侧正常脑皮质作为参考组织,勾画体积为1cm3感兴趣区体积,获得正常脑本底SUVmean。本回顾性分析研究所纳入病例均为MET摄取阳性病例,即病灶的摄取值高于正常脑本底摄取。定义病灶SUV/正常对侧脑皮质SUVmean为MET摄取的肿瘤靶本比(tumor-to-background ratio, TBR),即获得TBRmax以及TBRpeak。
4.神经病理学结果
所有入组病例均经手术或脑立体定向活检获取组织学标本,经常规H-E染色和免疫组化分析获取常规病理学诊断。本组病例的病理学胶质瘤级别分类以2007版WHO胶质瘤分类标准为参照。本项检查已通过复旦大学附属华山医院伦理委员会审批[批件号:(2008)临审第(82)号]。本研究为回顾性研究,研究内容及方法均符合《赫尔辛基宣言》。
5.统计学分析方法
所有连续性变量以平均值±标准偏差或中位数和范围的形式表示;而分类变量则以百分比形式表示。对于同一变量两种重建方法下获得的半定量数值,两组之间采用配对样本t检验法进行比较。对于正态分布的变量三组之间比较采用单因素方差分析法(ANOVA)。分类变量之间比较则采用卡方检验。对基于11C-MET图像分析获得的SUVmax、SUVpeak、TBRmax、TBRpeak对胶质瘤分级预测效能则通过受试者工作特征曲线进行评估,并进一步确定最佳截点。所有结果以当P<0.05时认为具有统计学意义。所有统计学分析经软件Graph Prism 8及MedCalc 15.2完成。
结 果
1.纳入胶质瘤病例临床信息
最终符合准入标准者共计113例,男性68例,女性45例,中位数年龄为56岁,其中IV级胶质瘤19例(男14例,女5例,平均年龄为47.37±14.18岁,中位年龄49岁,年龄范围23~71岁),III级胶质瘤32例(男18例,女14例,平均年龄为49.31±13.52岁,中位年龄53岁,年龄范围10~67岁),II级胶质瘤62例(男36例,女26例,平均年龄40.50±13.77岁,中位年龄41岁,年龄范围12~69岁)。
2.基于FBP与OSEM重建的11C-MET数据分析结果
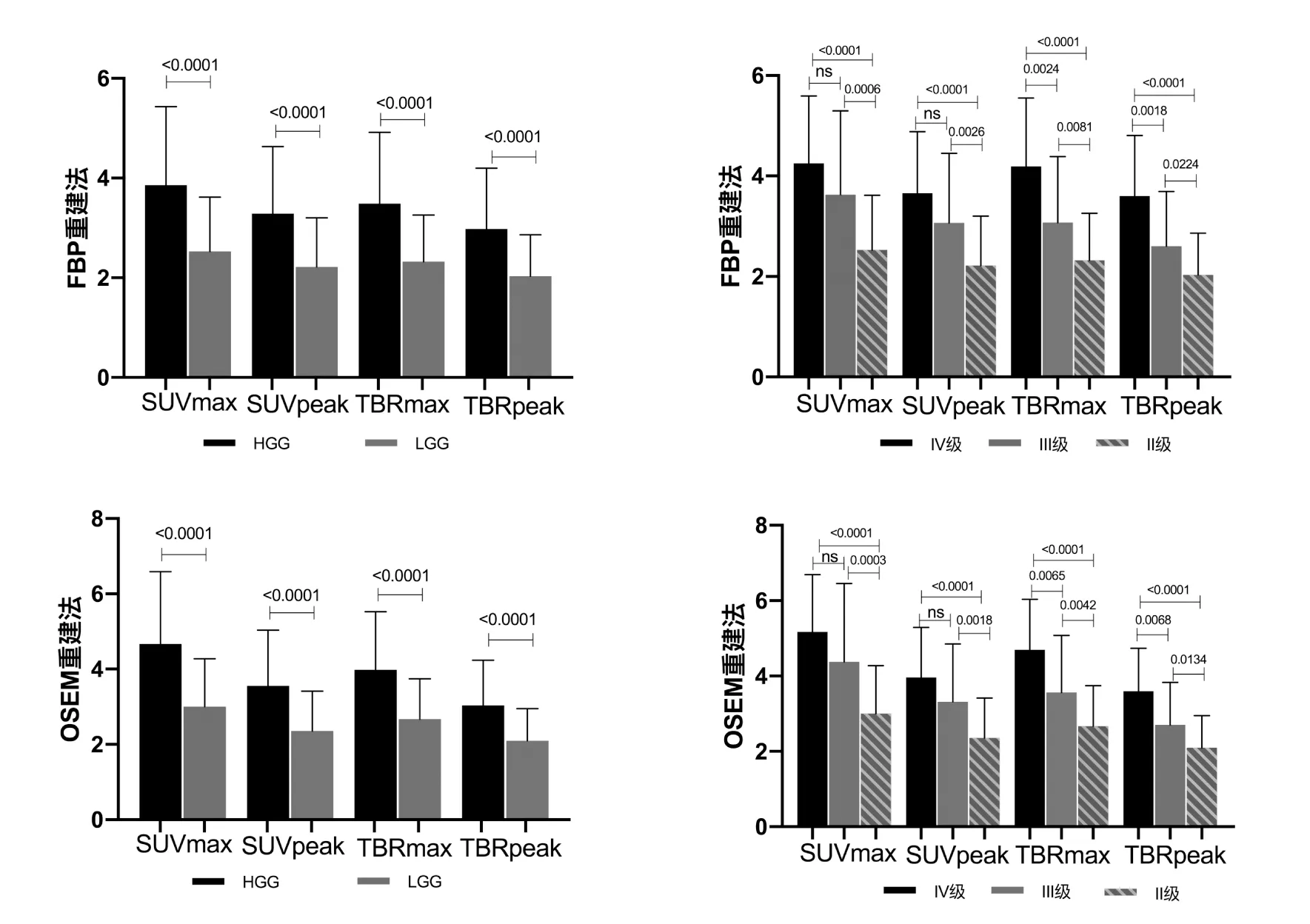
图1 胶质瘤11C-MET摄取半定量指标SUVmax、SUVpeak、TBRmax以及TBRpeak组间比较结果。(注:ns为无统计学差异)
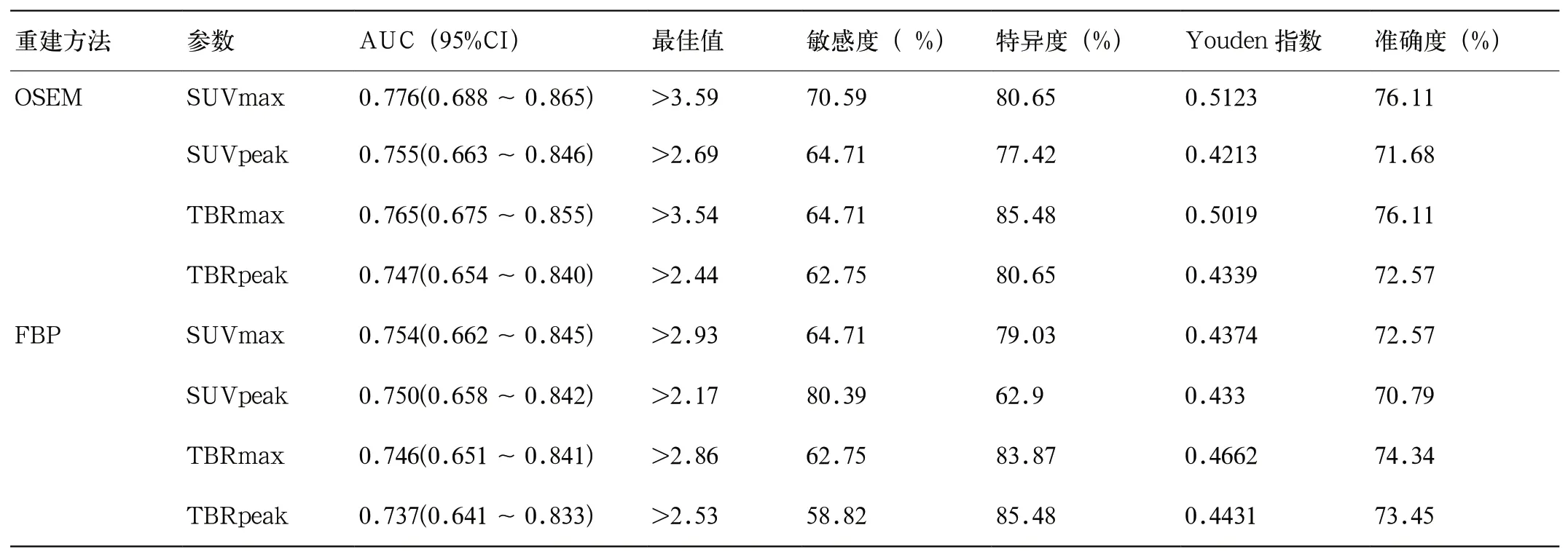
表1 基于FBP与OSEM重建的11C-MET半定量参数对高、低级别胶质瘤鉴别效能评价
FBP重建法Ⅱ、Ⅲ、Ⅳ级胶质瘤的SUVmax分别为2.525±1.092、3.626±1.671和4.251±1.343,SUVpeak分 别 为2.216±0.986、3.069±1.382和3.656±1.225,TBRmax分别为2.323±0.933、3.071±1.316和4.192±1.358,TBRpeak分 别 为2.033±0.827、2.604±1.090、3.600±1.207。
OSEM重 建 法Ⅱ、Ⅲ、Ⅳ级 胶 质 瘤 的SUVmax分 别 为3.002±1.275、4.377±2.079和5.172±1.521,SUVpeak分别为2.358±1.057、3.316±1.531和3.965±1.326,TBRmax分 别 为2.670±1.070、3.561±1.514和4.695±1.339,TBRpeak分 别 为2.087±0.8555、2.706±1.126、3.594±1.145。
肉眼观察OSEM重建法图像噪声更少,配对t检验结果提示除IV级亚组TBRpeak参数外(P=0.9448),对同一参数,OSEM重建方法获得的半定量参数显著高于以FBP重建法获得的半定量参数(均P<0.02),且两者存在良好相关性(均r>0.9,P<0.0001);进一步实验性采用非配对t检验则除II级亚组SUVmax参数外(P=0.0273),OSEM重建法和FBP重建法参数之间则没有明显统计学差异。
3.受试者工作曲线法对高、低级别胶质瘤预测效能评价
将Ⅲ级及Ⅳ级胶质瘤合并为高级别胶质瘤组(high grade glioma, HGG),Ⅱ级胶质瘤单独归为低级别胶质瘤组(low grade glioma,LGG)。FBP重建法HGG组的SUVmax、SUVpeak、TBRmax、TBRpeak分别为3.859±1.573、3.288±1.344、3.489±1.427和2.975±1.224,OSEM重 建 法HGG组 的SUVmax、SUVpeak、TBRmax、TBRpeak分别为4.673±1.914、3.588±1.479、3.983±1.540和3.037±1.203,无论以FBP或OSEM方法重建,SUVmax、SUVpeak、TBRmax以及TBRpeak在HGG组与LGG组均具有显著性差异(P<0.0001);SUVmax、SUVpeak、TBRmax、TBRpeak均在Ⅱ级和Ⅲ级以及Ⅱ级和Ⅳ级胶质瘤两两组间比较提示存在组间统计学差异,TBRmax和TBRpeak在此基础上还能进一步区分Ⅲ级和Ⅳ级胶质瘤(图1)。
受试者工作曲线法(receiver operating curve,ROC)提示基于OSEM重建的单参数SUVmax及TBRmax对预测高、低级别胶质瘤效果最为满意。当设定SUVmax阈值在≥3.59或TBRmax≥3.54时,其区分高、低级别的准确度均约76.11%,敏感度及特异度分别为70.59%,80.65%以及64.71%,85.48%,后者曲线下面积(area under the curve,AUC)略低于前者(0.776vs0.765),但两者没有统计学差异(表1)。
讨 论
基于OSEM重建的11C-MET半定量数值高于FBP重 建 法,既 往 研 究 在FDG[6]、123IFP-CIT[7]、11C-Acetate[8]、15O-CO[9]等相关PET分子探针显像研究中也得到了相似的结果。造成两种方法间差异的原因主要是在FBP与OSEM的传输成像和衰减校正中使用了不同的平滑滤波器,为了在FBP重建期间获得噪声较少的图像,通常使用非定量过滤器,这可能导致SUV被低估,而在OSEM重建过程中可以使用更准确的高斯滤波器,不会影响图像质量[10],所以OSEM相比传统的FBP大大提高了图像的质量,主要优点是减少条状噪声,增加图像的均匀性。对OSEM重建法来讲,并不是迭代次数越高越好,随着迭代次数增加(迭代次数1~10),图像均一性会因此受到影响而降低,并且迭代次数增加有可能将会过高估算免疫内照射治疗有效剂量[11]。在11C-Acetate心脏药物代谢动力学的动态研究中,FBP和OSEM两种重建方法对获得的SUVmean时间活度曲线及房室模型建立中k1、k2参数并无影响,而且基于两种重建方法的相关参数相关性良好[8]。
胶质瘤病理分级对患者预后判断具有重要意义。本研究中将11C-MET应用于术前胶质瘤显像,神经外科及功能影像科医师更关注肿瘤高摄取部位,这无论对进一步活检部位选取或调强放疗靶区勾画均具有重要指导意义,故本研究纳入SUVmax、SUVpeak参数,而非在动态曲线研究中更关注的则为SUVmean。本研究中在对基于FBP以及OSEM重建方法的参数比较时,采用配对t检验则具有高度统计学差异,而如采用非配对t检验则多个亚组分析则不存在统计学差异,则进一步说明虽然重建方法的确会对11C-MET常规半定量数值产生影响,但OSEM重建法则是使得11C-MET常规半定量数值呈整体性增高,但应该不会对高、低级别胶质瘤鉴别效能产生明显影响。ROC分析进一步提示基于两种重建方法的11C-MET半定量参数对高、低级别胶质瘤均具有较为满意的鉴别效能,虽然基于OSEM重建的同一参数AUC数值及Youden指数要略高于FBP重建,但整体上仍较为接近,8项半定量参数的敏感度范围为58.82%~80.39%,特异度范围为62.9%~85.48%。
本研究发现基于两种重建方法的TBRmax、TBRpeak高低级别胶质瘤鉴别的基础上,还可以进一步区分Ⅲ级和Ⅳ级胶质瘤;而Dongwoo Kim等[12]的研究发现TBRmax无法进一步区分Ⅲ级和Ⅳ级胶质瘤。究其原因,可能是由于本研究中Ⅱ、Ⅲ、Ⅳ级各亚组胶质瘤病例数所占比例不同所致,本研究中为62:32:19,而前者各级别胶质瘤纳入比例为50:39:55,本研究中所纳入的胶质瘤病灶大部分MRI无明显强化,波谱学表现不典型,凭借传统MRI影像学检查并非第一印象即可诊断为胶质瘤,需与其他颅内占位性病变相鉴别;而绝大多数Ⅳ级胶质瘤呈现典型明显强化,波谱学分析胆碱峰明显升高,一般情况下无需进行进一步氨基酸11C-MET PET检查,所以本研究纳入的主要是Ⅱ级和Ⅲ级胶质瘤病例。
PET重建方法对11C-MET半定量值产生影响,除此以外,异柠檬酸脱氢酶(isocitrate dehydrogenase enzyme type1, IDH1)基因突变状态亦会影响11C-MET摄取,IDH1突变胶质瘤患者MET摄取值显著低于IDH1野生型患者[13]。另外,含少突胶质成分胶质瘤的11C-MET摄取值则高于同级别伴随IDH1突变的星形胶质瘤,少突成分在一定程度上将影响氨基酸代谢显像对胶质瘤级别的判断[14]。
本研究也存在一定局限性。本研究纳入病例的MET-PET检查时间为2012年2月至2017年11月,因此入组病例的病理诊断仍然按照2007版WHO胶质瘤分类标准进行。新版胶质瘤分类标准进一步整合了IDH基因突变和1p/19q共缺失的不同状态对胶质瘤分类[15],今后11C-MET PET这种分子影像学检查手段对基于分子病理学标记物状态的胶质瘤分类及预后预测效能更加令人期待。
综上所述,本研究证实了OSEM重建方法获得的11C-MET半定量值高于FBP法,二者存在高度相关性,均对胶质瘤术前高、低级别判断具有较为良好的诊断效能,11C-MET PET显像作为一种氨基酸分子显像工具,有进行多中心临床推广的巨大潜力。
