ω-3不饱和脂肪酸功能性纳米载体的设计及逆转肝癌多药耐药作用研究
2020-11-05王春雷魏晓炎邵国良
王春雷 魏晓炎 邵国良
近年来,恶性肿瘤发病率和死亡率不断上升,已经成为全球人类的一个主要死亡原因。肝癌位居恶性肿瘤死亡原因第3位,虽然手术切除治疗能够缓解癌症的发展,但患者术后5年生存率仍较低[1]。而化疗因受肿瘤普遍存在的多药耐药(multidrug resistance,MDR)和药物严重不良反应等原因限制,仍缺乏理想的效果。MDR是指恶性肿瘤细胞对一种抗肿瘤药物产生耐药的同时,对其他从未接触过的、结构和作用机制完全不同的抗肿瘤药物也产生抗药性[2]。目前仍欠缺能有效克服肿瘤MDR的策略,如何逆转MDR已经成为抗肿瘤研究领域亟待解决的问题之一。
二十二碳六烯酸(docosahexaenoic acid,DHA)是一种必需的ω-3不饱和脂肪酸,是细胞膜的关键成分,在脊椎动物大脑功能中起着重要作用[3]。以DHA为代表的ω-3不饱和脂肪酸对恶性肿瘤的发生和转归有明显影响,研究表明ω-3不饱和脂肪酸在逆转肿瘤MDR方面具有突出的潜在应用价值。Gelsomino等[4]发现ω-3脂肪酸能通过下调胆固醇的合成和改变抗去污剂膜成分从而对结肠癌耐药细胞具有化学敏感性。但ω-3不饱和脂肪酸对肝癌MDR的影响尚鲜见报道,影响机制也不明确,如何利用ω-3不饱和脂肪酸逆转肝癌MDR有待进一步研究。因此本研究设计DHA为代表的ω-3不饱和脂肪酸功能性纳米载体,探究其协同阿霉素(doxorubicin,DOX)给药对肝癌MDR的影响及其作用机制。
1 材料和方法
1.1 材料、试剂与仪器 人肝癌细胞HepG2和人肝癌耐药细胞HepG2/ADM均购自上海雅吉生物科技有限公司;DHA和DOX均购自美国Sigma公司;叶酸聚乙二醇磷脂(DSPE-PEG2000-Folate)购自西安瑞禧生物科技有限公司;RIPA裂解液购自上海碧云天生物技术公司;大豆磷脂、BCA蛋白定量试剂盒、化学发光检测试剂、预染蛋白marker均购自美国Solarbio公司;MDR相关蛋白(MRP)抗体购自美国Affinity Biosciences公司;肺耐药相关蛋白(LRP)、乳腺癌抗药性蛋白(BCRP)、凋亡相关蛋白(Bcl-2)抗体均购自上海Abcam公司;达尔伯克改良伊格尔培养液(DMEM)、胰蛋白酶溶液(0.25%)均购自美国Hyclone公司;FBS购自浙江天杭生物科技。Micro17R型低温高速离心、BB150型细胞培养箱机均购自美国Thermo公司;Zeta PALS型粒度分析仪购自美国BIC公司;EPS300型电泳仪、VE180C型电泳槽和VE1816型转膜仪购自上海天能公司;610020-9Q型化学发光仪购自上海勤翔公司;AE2000型倒置显微镜购自中国Motic公司;Axio Observer A1型倒置荧光显微镜购自德国ZEISS公司。
1.2 实验方法
1.2.1 细胞培养 将HepG2、HepG2/ADM细胞培养于含10%FBS的DMEM培养液中,在37℃、5%CO2培养箱中培养。每2~3 d传代1次,实验时取对数生长期细胞。
1.2.2 载药纳米载体的构建及表征 采用高压乳化的方法制备载药纳米载体,选取DHA、DOX为油相,大豆磷脂和DSPE-PEG2000-Folate为表面活性剂,甘油为助表面活性剂。将处方量的DHA、DOX和表面活性剂混合,加热融解,2 000 r/min高速剪切,将油相滴入含助表面活性剂的水相中,剪切混匀,高压乳匀机,800 bar的压力,乳化8遍,即得,充氮密封保存。取所制的载药纳米载体溶于去离子水中,设置溶剂为水,用粒度分析仪测定平均粒径为120 nm。
1.2.3 实验分组 将两种细胞分为HepG2/ADM组、HepG2+DOX组、HepG2+DOX纳米粒组、HepG2/ADM+DOX组、HepG2/ADM+DOX纳米粒组。HepG2+DOX组、HepG2/ADM+DOX组细胞培养时加入5 μg/ml DOX溶液,HepG2+DOX纳米粒组和HepG2/ADM+DOX纳米粒组细胞培养时加入5 μg/ml DOX纳米载体(下述)。
1.2.4 细胞活性检测 采用CCK-8法。选取对数生长期HepG2细胞以 1×105/ml,和 HepG2/ADM细胞以5×104/ml分别接种于 96孔培养板,100 μl/孔。在 37 ℃、5%CO2条件下培养24 h后,分别加入相应药物,对照孔加相应体积的培养液,每组设5个平行孔,培养48 h后,每孔加10 μl CCK-8溶液,再培养4 h,用酶联免疫仪在波长450 nm处读取吸光度(A)值,取平均值。按公式计算细胞存活率:细胞存活率(%)=[(实验组(OD)-空白组(OD)]/(对照组(OD)-空白组(OD)]×100%。
1.2.5 载药纳米粒细胞摄取能力检测 将HepG2和HepG2/ADM细胞以1×105/孔接种于共聚焦专用的四室小皿中,培养4~8 h后,分别加入5 μg/ml DOX溶液或5 μg/ml DOX 纳米载体,37 ℃共孵育 2、8、24 h。弃去培养液,用PBS冲洗3次,每孔用0.5 ml的4%多聚甲醛固定10 min,PBS漂洗3次,在倒置荧光显微镜观察细胞内载药纳米粒的分布情况。
1.2.6 载药纳米粒的细胞内DOX浓度测定 将HepG2和HepG2/ADM细胞接种于6个12孔板,每个时间点对应1个12孔板,每组设置3个平行孔;分别给予5 μg/ml DOX 溶液或 5 μg/ml DOX 纳米载体,孵育 1、2、4、8、12、24 h后弃去细胞培养液,加入100 μl RIPA细胞裂解液,再加入900 μl PBS,反复冻融,离心后取上清液,采用分光光度法测定荧光值,计算DOX浓度。
1.2.7 MRP、LRP、BCRP、Bcl-2蛋白表达水平检测 采用Western blot法。取对数生长期的HepG2和HepG2/ADM细胞制成1×108/ml单细胞悬液,接种于培养瓶内,5组细胞贴壁后分别加入相应药物作用48 h后收集细胞,用PBS洗涤2次,加RIPA裂解液提取细胞总蛋白质,用BCA法测蛋白浓度。分别取适量蛋白质样品进行SDS-PAGE电泳,转移到PVDF膜,5%脱脂奶粉摇床振荡1.5~2 h,将膜放入含一抗稀释液的孵育盒中,4℃摇床振荡孵育过夜;TBST洗10 min×3次,加入用5%脱脂奶粉封闭液稀释的二抗,室温摇床振荡反应1~2 h,TBST洗膜5 min×3次。在PVDF膜上滴加A、B两种ECL发光试剂的混合液,充分接触反应3 min。扫描条带,采用chemi caPture软件对结果进行拍摄。每组分别进行3次独立的平行实验。
1.2.8 统计学处理 采用SPSS 16.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 5组细胞存活率比较 与HepG2/ADM组比较,HepG2+DOX组、HepG2+DOX纳米粒组、HepG2/ADM+DOX组、HepG2/ADM+DOX纳米粒组存活率均明显为低,差异均有统计学意义(均P<0.01);与HepG2/ADM+DOX组比较,HepG2/ADM+DOX纳米粒组存活率为低,差异有统计学意义(P<0.05)。见表1。

表1 5组细胞存活率比较(%)
2.2 HepG2和HepG2/ADM细胞的药物摄取能力 随着药物作用时间的延长,细胞荧光强度增加,药物摄取能力增强。HepG2/ADM+DOX纳米粒组药物摄取能力最强,HepG2+DOX纳米粒组次之,HepG2+DOX组最弱,见图 1(插页)。
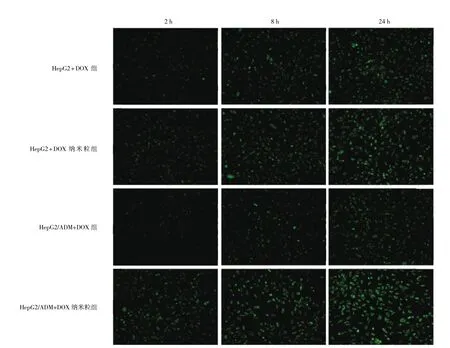
图1 HepG2和HepG2/ADM细胞的药物摄取能力(DOX为阿霉素;×200)
2.3 载药纳米粒的细胞内DOX浓度比较 随着药物作用时间的延长,HepG2与HepG2/ADM细胞内DOX浓度均持续增长。HepG2+DOX纳米粒组与HepG2+DOX组、HepG2/ADM+DOX纳米粒组与HepG2/ADM+DOX组相比,细胞内DOX浓度高且增长速率较快,但差异均无统计学意义(均P>0.05),见图2。
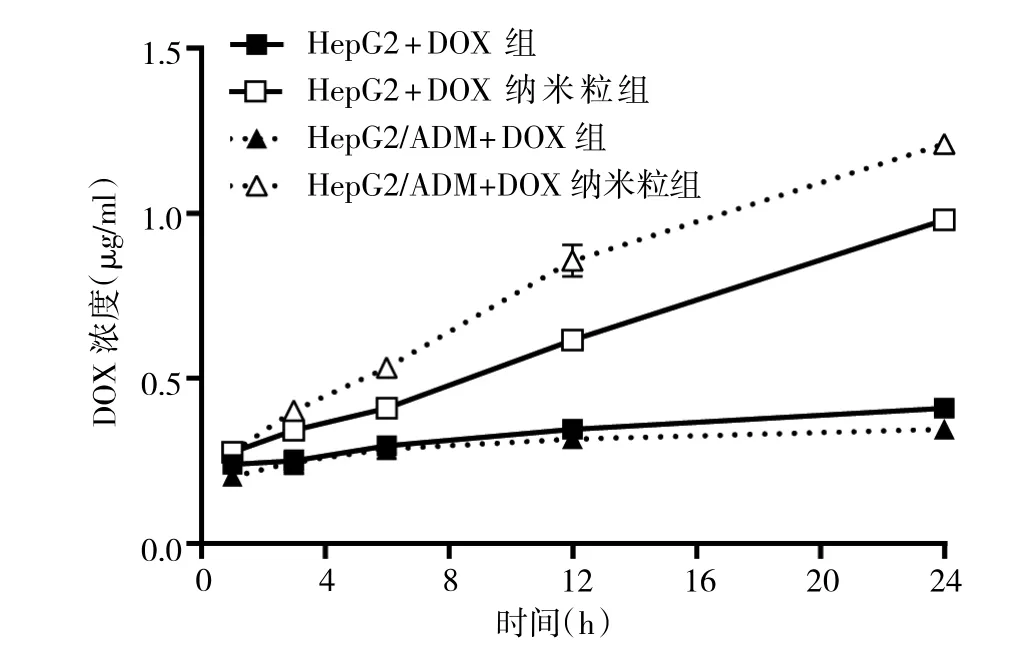
图2 细胞内DOX浓度变化曲线(DOX为阿霉素)
2.4 5 组细胞 MRP、LRP、BCRP、Bcl-2 蛋白表达水平比较 与HepG2/ADM组相比,HepG2+DOX组、HepG2+DOX纳米粒组和HepG2/ADM+DOX纳米粒组细胞中MRP、LRP、BCRP与Bcl-2蛋白表达水平均明显为低(均 P<0.05),见图 3、表 2。
3 讨论

图3 5组MRP、LRP、BCRP与Bcl-2蛋白电泳图(MRP为多药耐药相关蛋白;LRP为肺耐药相关蛋白;BCRP为乳腺癌抗药性蛋白;Bcl-2为凋亡相关蛋白;A:HepG2/ADM 组;B:HepG2+DOX 组;C:HepG2+DOX 纳米粒组;D:HepG2/ADM+DOX 组;E:HepG2/ADM+DOX纳米粒组;DOC为阿霉素)
DHA是人类大脑和视网膜组织中细胞膜的组成成分,也是胎儿出生后早期大脑和视力发展的重要组成部分[5],近年来人们发现以DHA为代表的ω-3不饱和脂肪酸对恶性肿瘤的发生和转归具有突出的影响。Mahmoudi等[6]发现DHA可降低多能性网络基因的高表达水平,并重新激活DNA错配修复缺失/鼠类肉瘤病毒癌基因突变的结直肠癌干细胞样细胞中的半胱氨酸蛋白酶-3和凋亡,表明了DHA在CRC治疗中的应用潜力,其在协同药物增强逆转肿瘤耐药功效方面具有一定作用。
肿瘤细胞的MDR是临床用药和新药开发的主要障碍。寻找具有强抗MDR性的新化合物是克服肿瘤耐药的有效途径[7]。MDR的主要机制之一是膜三磷酸腺苷结合盒(ABC)转运蛋白的过表达,例如P-糖蛋白(Pgp/ABCB1)、MDR 相关蛋白(MRP/ABCC)和乳腺癌抵抗蛋白(BCRP/ABCG2)[4,8-10]。其他与 MDR 有关的因素还有肺耐药相关蛋白的高表达[11]、谷胱甘肽S转移酶和谷胱甘肽的升高[12]、拓扑异构酶Ⅱ相关的DNA损伤修复增加、抑制药物诱导的p53凋亡以及与血管内皮生长因子(VEGF)相关的癌细胞生长的调控[13]。基于上述研究,本研究通过检测MRP、LRP、BCRP、Bcl-2蛋白的表达水平来反映功能性纳米载体药物对肝癌细胞MDR的逆转效果。Western blot结果表明,HepG2/ADM+DOX纳米粒组细胞中ADM相关蛋白表达量总体呈现下降趋势,且MRP与LRP蛋白的表达水平均显著下降,这提示DOX纳米粒可以下调细胞ADM相关蛋白表达水平,以高效克服肿瘤MDR,进而使DOX可以充分挥发其抗肿瘤作用,增加MDR细胞的程序性死亡,提高抗肿瘤药物的体内疗效。
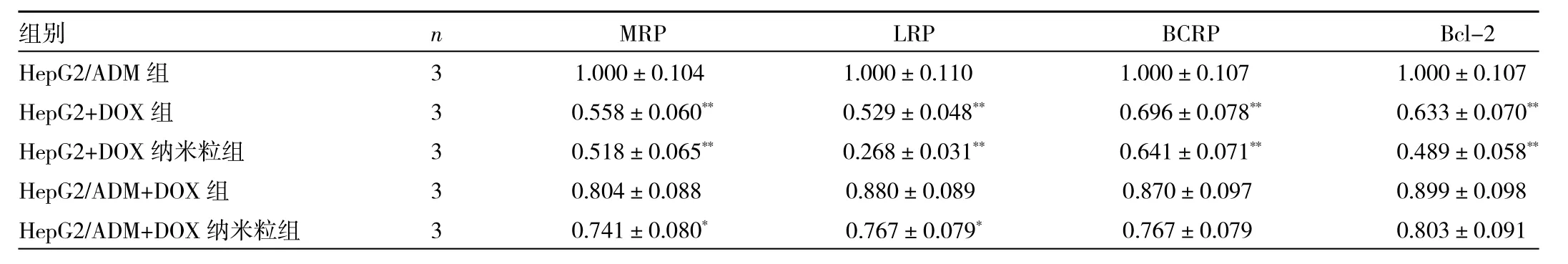
表2 5组细胞MRP、LRP、BCRP、Bcl-2蛋白表达水平比较
MDR机制的复杂性决定了在逆转MDR中应有协同用药的理念。如Dong等[14]开发了核壳纳米粒来同时包封紫杉醇和吉西他滨用于乳腺癌治疗,与单独的紫杉醇或相同浓度的单独吉西他滨治疗相比,两药的共同递送系统呈现显著的抗癌效果,同时体内全身性毒性降低。Devalapally等[15]设计了一种共载外源性神经酰胺和紫杉醇的聚环氧乙烷-聚ε-己内酯聚合物胶束,用于治疗耐紫杉醇的卵巢癌细胞株(SKOV-3TR),发现相比于单独使用紫杉醇,联合用药疗效增加100倍。本研究采用DOX和MDR逆转剂共输送以增强逆转肝癌MDR,结果发现,联合用药使MDR细胞对DOX的敏感性增加至非耐药细胞的敏感性水平,药物对细胞的增殖抑制作用也更加显著。虽然化疗药和MDR逆转剂的共输送能够在一定程度上增强逆转MDR的作用,一般逆转剂在应用时存在极大不良反应,损害患者生活质量,限制了其临床应用[16]。与一般逆转剂不同,本研究设计的DHA纳米载体是高安全性的功能性辅料,对开发高效低毒的功能性纳米给药系统具有重要意义。此外,纳米技术可以通过改善化疗药物给药途径、拮抗和抵消肿瘤细胞主动外排药物的作用从而提高了肿瘤细胞内的药物浓度,是DOX纳米粒载体另一大优势。
综上所述,基于ω-3不饱和脂肪酸的功能性纳米载体的DOX可以在一定程度上逆转肝癌MDR,其内在机制可能是通过下调与ADM发生、发展相关的MRP与LRP蛋白的表达。该结果为进一步利用基于ω-3不饱和脂肪酸的功能性纳米载体来逆转肝癌MDR提供了理论依据,为开发了有效给药系统提供新的思路。
