E-Cadherin/β-Catenin 与PTEN-PI3K/Akt在卵巢浆液性肿瘤中的表达及其意义
2020-11-05陈胜民王国平林志仁袁峰
陈胜民 王国平 林志仁 袁峰
卵巢浆液性肿瘤(ovarian serous tumor,OST)是一类异质性肿瘤,不同级别卵巢肿瘤生物学行为有显著差异,预后明显不同,同时由于缺乏早期诊断手段,复发率和病死率高[1]。卵巢浆液性交界性肿瘤(ovarian serous borderline tumor,OSBT)又称卵巢低度恶性潜能(low malignant potential,LMP)上皮性肿瘤,约占卵巢上皮性肿瘤的15%~20%,OSBT的生物学行为介于良性与恶性肿瘤之间。相较于卵巢浆液性癌(ovarian serous carcinoma,OSC),OSBT 多发生于育龄女性,多见于 25~55岁,一般期别较早,病程进展慢,预后好,约占卵巢交界性肿瘤的65%,其他病理类型较少见[2]。研究证实,当β-连环蛋白(Beta-catenin,β-Catenin)的酪氨酸磷酸化时,上皮型-钙粘蛋白(epithelial calcium-dependent cell adhesion proteins,E-Cadherin)/β-Catenin 复合体解聚,ECadherin表达下调,导致细胞间粘附力降低,促使肿瘤原发灶侵袭转移[3]。第10号染色体缺失的磷酸酶和张力蛋白同源物基因(phosphatase and tension homologdeleted on chromosome ten,PTEN)缺失和或磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)激活可使其下游分子,丝氨酸蛋白激酶B473(protein kinase B,PKB/AktSer473)磷酸化导致Akt活化,激活或抑制其下游靶蛋白,导致癌变进展,而PTEN的过表达则可抑制细胞增殖迁移[4]。目前虽然有文献报道了上述部分蛋白在OSC中的表达情况,但未见上述全部蛋白表达在OST中的表达差异以及相互之间关系的报道。为此本研究应用免疫组化法,检测 OST 中 E-Cadherin、PTEN、PI3Kp110α、p-AktSer473、β-Catenin以及Ki-67蛋白的表达并分析其相互关系,探讨OST的发生发展机制,为OST的临床诊治以及预后判断提供依据。
1 材料和方法
1.1 材料
1.1.1 组织标本 收集本院病理科2002年1月至2017年11月石蜡包埋组织标本共100例,其中正常卵巢组织(normal ovarian tissue,NOT)10 例、卵巢浆液性囊腺瘤(ovarian serous cystadenoma,OSA)12 例、OSBT18例、OSC60例,各种标本组织切片均已由病理学专家进行诊断和分类。
1.1.2 主要试剂 鼠抗人E-Cadherin、β-Catenin、PTEN以及Ki-67单抗(抗体批号:TA800670、ZM-0442、ZM-0116、TA500265)和S-P试剂盒均购于北京中杉金桥生物技术有限公司;兔抗人PI3Kp110α和p-AktSer473单抗(抗体批号:4249T、4060T)购于美国CST公司。
1.2 方法
1.2.1 免疫组化检测 采用免疫组化SP三步法检测ECadherin、β-Catenin、PTEN、PI3Kp110α、p-AktSer473以及Ki-67表达,用已知阳性组织作阳性对照,PBS代替一抗作阴性对照,具体实验步骤均按试剂说明书进行操作。
1.2.2 结果判断 E-Cadherin阳性表达部位是细胞膜和(或)细胞质,β-Catenin阳性表达部位是细胞膜或细胞核,PTEN、PI3Kp110α和p-AktSer473阳性表达与细胞质和(或)细胞核,Ki-67阳性表达部位是细胞核。镜下随机观察10个视野,避开切片周边,每个视野计数100个肿瘤细胞,共计1 000个细胞,阳性细胞数占总细胞数的百分比为阳性细胞比例,取其平均值。对肿瘤细胞的 E-Cadherin、β-Catenin、PTEN、PI3Kp110α、p-AktSer473表达进行评价时,阳性细胞占比计分如下:阳性细胞占比<5%计 0分,6%~25%计 1分,26%~50%计 2分,51%~75%计3分,76%~100%计4分;另外根据细胞染色强度计分,细胞定位部位无显色计0分,浅棕黄色计1分,棕黄色计2分,棕褐色计3分。根据阳性细胞占比和着色强度来综合判断,最终结果由两项记分相乘所得,0~1 分为-,2~4 分为+,5~8 分为++,9~12 分为3+++。其中-为阴性,+~+++为阳性[5]。Ki-67 的表达采用阳性细胞率。
1.3 统计学处理 采用SPSS 17.0统计软件。计数资料组间比较采用χ2检验和Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 各组 E-Cadherin、PTEN、PI3Kp110α、p-AktSer473、β-Catenin以及Ki-67表达比较 各组间总体比较,OSC组E-Cadherin、PTEN阴性细胞率均高于OSBT、OSA和NOT组,差异均有统计学意义(均P<0.05);PI3Kp110α、p-AktSer473、β-Catenin以及Ki-67阳性细胞率高于OSBT、OSA和NOT组,差异均有统计学意义(均P<0.01)。见表 1,图 1-4(插页)。

图1 PI3Kp110α在OSC中的表达(SP染色,×200)

图2 p-AktSer473在OSC中的表达(SP染色,×200)

图3 β-Catenin在OSC中的表达(SP染色,×200)
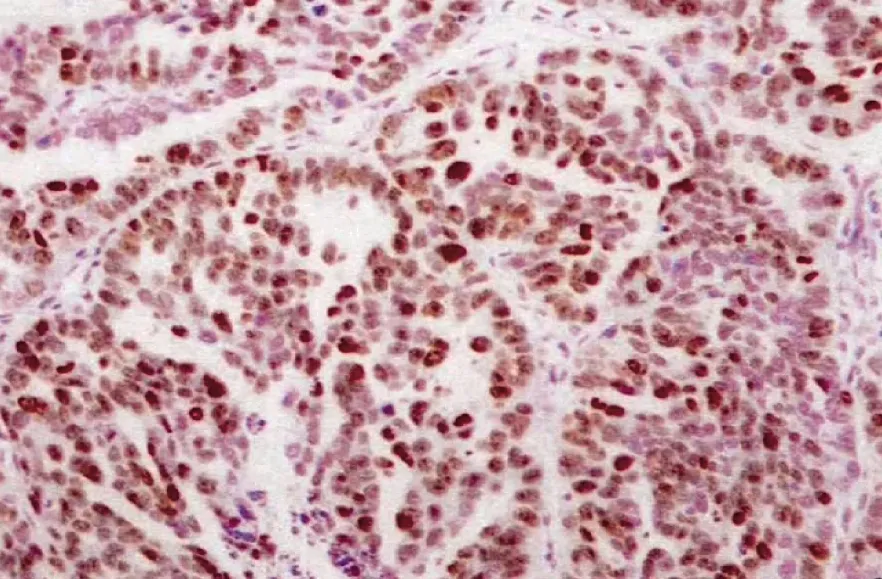
图4 Ki-67在OSC中的表达(SP染色,×200)
2.2 不同临床特征OSC中E-Cadherin、PTEN、PI3Kp110α、β-Catenin以及Ki-67表达比较 浸润与非浸润的OSC标本比较,E-Cadherin阴性细胞率的差异有统计学意义(P<0.05),PTEN阴性细胞率的差异有统计学意义(P<0.01);有无淋巴结转移的OSC标本比较,E-Cadherin、PTEN阴性细胞率的差异也有统计学意义(P<0.05);有无浸润与浸润、有淋巴结转移与无淋巴结转移的OSC间分别比较,PI3Kp110α、p-AktSer473、β-Catenin 以及Ki-67阳性细胞率的差异均有统计学意义(P<0.01)。见表2。
3 讨论
3.1 E-Cadherin/β-Catenin在OST发生发展中的作用 正常情况下,E-Cadherin和β-Catenin构成复合体,锚定于肌动蛋白细胞骨架上,使相邻细胞形成稳定连接[3,6]。在异常因素触发下,β-Catenin的酪氨酸发生磷酸化,E-Cadherin/β-Catenin 复合体解聚,E-Cadherin 表达下调,导致细胞间的粘附力降低,细胞发生分散,从而出现向外周侵袭性生长的现象,最终肿瘤脱离原发灶发生转移[3,7]。本研究显示,E-Cadherin蛋白表达缺失在不同类型的OST之间存在差异,E-Cadherin蛋白表达缺失率在OSC中最高,其次是OSBT、OSA,最低的是NOT,表明E-Cadherin表达缺失可能与OST发生发展有关。本研究还显示,β-Catenin阳性表达率在不同类型的OST之间也存在差异,β-Catenin蛋白阳性表达率在OSC中最高,其次是OSBT、OSA,最低的是NOT,表明β-Catenin蛋白过表达也可能与OST发生发展相关。本研究表明OST的发生发展,伴随着恶性程度增高的过程,与OST中E-Cadherin功能缺失,伴随β-Catenin过表达逐级增高,可能具有同步一致性。
3.2 PTEN-PI3K/Akt信号通路参与OST的发生发展 研究发现,PTEN通过其脂质磷酸酶活性作用于PI3K的下游靶分子3,4,5-三磷酸磷脂酰肌醇(Phosphatidylinositol 3,4,5-trisphosphate,PIP3),阻断 PI3K/AKT信号传导,从而实现其抑癌作用,将此称为PTENPI3K/Akt信号转导通路[8-10]。目前认为,与卵巢癌密切相关的是ⅠA型PI3K,其是由p85调节亚基和p110催化亚基组成的异二聚体。PKB/Akt是一种丝氨酸/苏氨酸蛋白激酶,是PI3K信号传导通路中的下游靶激酶。正常情况下,PTEN负调节PI3K,但在细胞外因子异常刺激下Ras和p110α直接结合导致PI3K活化。PTEN缺失或PI3K激活均可使其下游分子Akt的Ser473发生磷酸化导致Akt活化,从而激活或抑制其下游靶蛋白,使OST发生进展,而PTEN的过表达则可抑制细胞增殖迁移[11-14]。本研究显示,PTEN蛋白表达缺失率在不同类型的OST之间存在差异,PTEN蛋白表达缺失率在OSC中最高,其次是OSBT、OSA,最低的是NOT,表明PTEN蛋白表达缺失参与OST的发生进展。本研究还显示,PI3Kp110α、p-AktSer473以及Ki-67蛋白阳性表达率在OSC中最高,其次是OSBT、OSA,最低的是NOT,提示PI3K/Akt过表达与OST的发生发展相关。因此推测PTEN功能的缺失与PI3Kp110α、p-AktSer473蛋白的激活在OST的发生发展可能存在协同作用。本研究表明,在OST的发生发展中存在PTEN功能缺失,伴随PI3Kp110α、p-AktSer473以及Ki-67过表达,提示 PTEN和PI3K/Akt共同参与OST的发生、发展。

表1 各组 E-Cadherin、PTEN、PI3Kp110α、β-Catenin以及 Ki-67表达比较[例(%)]
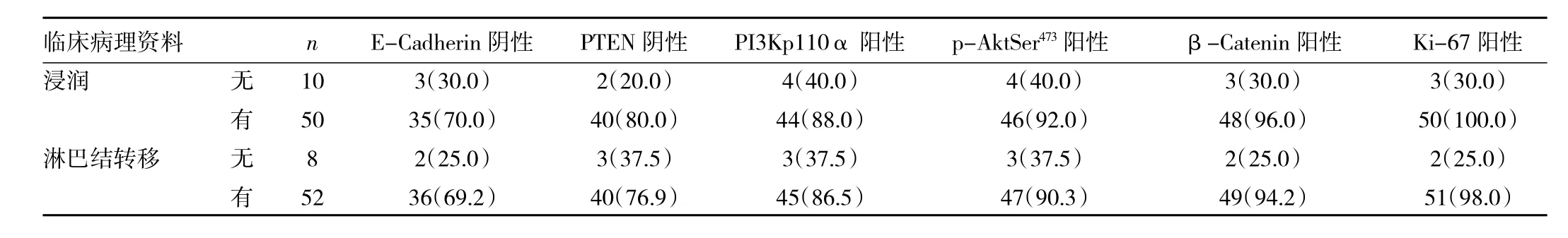
表2 不同临床特征OSC中各种蛋白表达比较[例(%)]
3.3 E-Cadherin/β-Catenin 与 PTEN-PI3K/Akt共同参与OST的发生发展 有研究显示在OSC中,E-cadherin可减少β-Catenin在细胞核中的积累,诱导PTEN表达,抑制PI3K/AKT信号转导,从而抑制细胞生长[14-15]。在OST癌变过程中,E-cadherin缺失,细胞核中β-Catenin发生积累,导致β-Catenin反式激活,从而抑制PTEN水平,激活PI3K/AKT信号通路,通过抑制糖原合成酶激酶 3β(glycogen synthase kinase-3,GSK3β)进一步稳定β-Catenin信号,促进OST的发生发展[14-17],见图5。本研究显示,E-Cadherin、PTEN蛋白表达缺失在不同类型的OST之间存在差异,在OSC中最高,其次是OSBT、OSA,最低的是 NO。PI3Kp110α、p-AktSer473以及β-Catenin蛋白阳性表达率在OSC中最高,其次是OSBT、OSA,最低的是NOT。本研究发现,在OST的发生发展中,E-Cadherin、PTEN蛋白表达缺失,而PI3Kp110α、p-AktSer473以及β-Catenin过表达,同时发现Akt活化时Ki-67蛋白表达,即增殖活性呈显著相关,提示Akt活化后可能通过Wnt信号通路阻断GSK3β活性,导致过度增殖癌变进展。
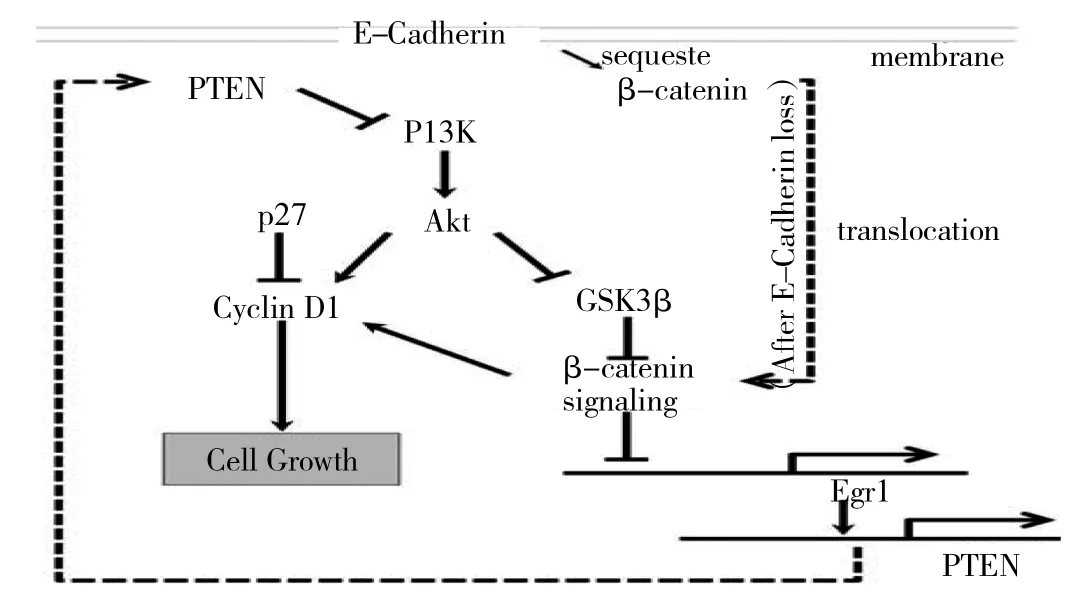
图5 E-Cadherin/β-Catenin通过PTEN-PI3K/Akt调控 OST癌变进展
目前为止,关于OST病因及发生机制尚不清楚,为降低OST的发病率,提高生存期以及生活质量,其发病机制的研究是目前的重中之重。不同阶段卵巢肿瘤生物学行为有显著差异,预后明显不同,由于缺乏早期诊断手段,复发率和病死率高,预后差。本研究发现E-Cadherin/β-Catenin与PTEN-PI3K/Akt信号通路共同参与OST的发生发展,本研究从蛋白质表达角度比较了不同类型的OST之间各蛋白表达差异,探讨各自的功能和相互关系,不仅有助于揭示OST的病因以及发病机制,而且为不同阶段OST的早期诊断,开发新的抗癌药物和寻求新的基因治疗以及预后判断提供了新的思路。
