男性乳腺肿瘤患者临床病理特征及超声影像特点分析
2020-11-05符德元
汤 蕾, 符德元
(1. 扬州大学医学院, 江苏 扬州, 225001;2. 江苏省苏北人民医院 甲状腺乳腺外科, 江苏 扬州, 225001)
男性乳腺肿瘤在临床上极为罕见,男性乳腺癌(MBC)约占男性恶性肿瘤的0.1%, 大多数男性乳腺肿瘤患者因乳房肿块就诊[1-2]。近年来,男性乳腺肿瘤的发病率逐年升高,但由于其比较罕见,男性患者对此普遍认知不足,因此男性乳腺肿瘤大多发现较晚,尤其是男性乳腺癌患者,确诊时往往年龄较大,分期较晚,肿瘤分级更高,预后更差,严重影响了患者生命健康和生活质量[3]。为了提高男性乳腺肿瘤的早期诊断率,充分发挥超声检查在男性乳腺肿瘤诊断中的价值,本研究收集了江苏省苏北人民医院甲状腺乳腺外科收治的28例男性乳腺肿瘤患者的临床资料,分析其临床病理特征以及超声影像特点,以期为男性乳腺良恶性肿瘤的早期诊治及鉴别诊断提供参考意见。
1 资料与方法
1.1 一般资料
收集2012年6月—2019年9月江苏省苏北人民医院甲状腺乳腺外科收治的28例男性乳腺肿瘤患者的临床资料进行回顾性研究。入组标准: 经手术和病理检查证实为男性乳腺肿瘤者。排除标准: 缺乏完整的临床数据及随访资料者。最终纳入28例男性乳腺肿瘤患者,根据病理学类型将其分为MBC组(19例)及非MBC组(9例)。MBC组包括浸润性导管癌13例,浸润性筛状癌1例,导管内癌2例,实性乳头状癌2例,黏液腺癌1例;非MBC组患者包括导管内乳头状瘤3例,血管脂肪瘤2例,血管瘤1例,神经纤维瘤1例,颗粒细胞瘤1例,钙化性纤维性肿瘤1例。
所有患者资料来源于江苏省苏北人民医院病历系统查阅的门诊病历及住院病历,收集的临床资料包括男性乳腺肿瘤患者的发病年龄、临床表现(包括是否出现乳头溢液、是否侵犯皮肤等)、位置、原发部位(多发肿块则按较大肿块的原发部位)、肿瘤大小、病理学类型、是否出现淋巴结转移、是否出现远处转移、病程长短、是否合并男性乳房发育、超声影像特点、随访时间以及患者的生存状态。MBC患者收集的临床资料包括免疫组织化学结果以及后续治疗过程(是否接受辅助化疗与辅助内分泌治疗)。
1.2 方法
1.2.1 超声检查方法: 乳腺超声检查采用Aloka Prosound α7、GE LOGIQ 8、GE LOGIQ S8、GE LOGIQ E9 Agile彩色多普勒超声诊断系统。受检者取仰卧位,充分暴露双侧乳房及腋窝,检查者使用高频探头进行多切面扫查,发现乳腺原发病灶后进一步评估病灶的位置、大小、形态学特征、病灶内部及周边血流情况等。
1.2.2 病理学检查方法: 手术切除的所有标本均经10%中性福尔马林液固定24 h, 脱水、石蜡包埋,连续切片。其中1张切片行HE染色后在光镜下观察,其余切片使用SP试剂盒进行免疫组化(IHC)检测。免疫组化的观察指标为雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2 (HER2), HER2()需行免疫荧光杂交(FISH)检测进一步明确HER2状态。
1.2.3 随访: 所有患者均通过电话随访与江苏省苏北人民医院病历系统随访,随访内容包括是否出现转移与复发、是否接受辅助内分泌治疗以及患者的生存状态。随访的主要终点事件定义为患者死亡,2020年5月20日为随访截止时间,随访时间为自患者确诊为男性乳腺肿瘤至末次随访时间。
1.3 统计学分析
采用SPSS 26.0软件进行统计学分析,计数资料比较采用卡方检验或Fisher精确检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 男性乳腺肿瘤的临床病理学特征
28例男性肿瘤患者中, 12例患者病程大于1年(占42.9%), 原发部位位于左侧乳腺15例,位于右侧乳腺13例;位于中央部19例(占67.9%)。28例患者均接受手术治疗,肿块最大直径为0.8~4.9 cm, 4例患者未完成后续治疗(占14.3%)。男性乳腺肿瘤患者的临床病理学特征及具体治疗方式见表1。
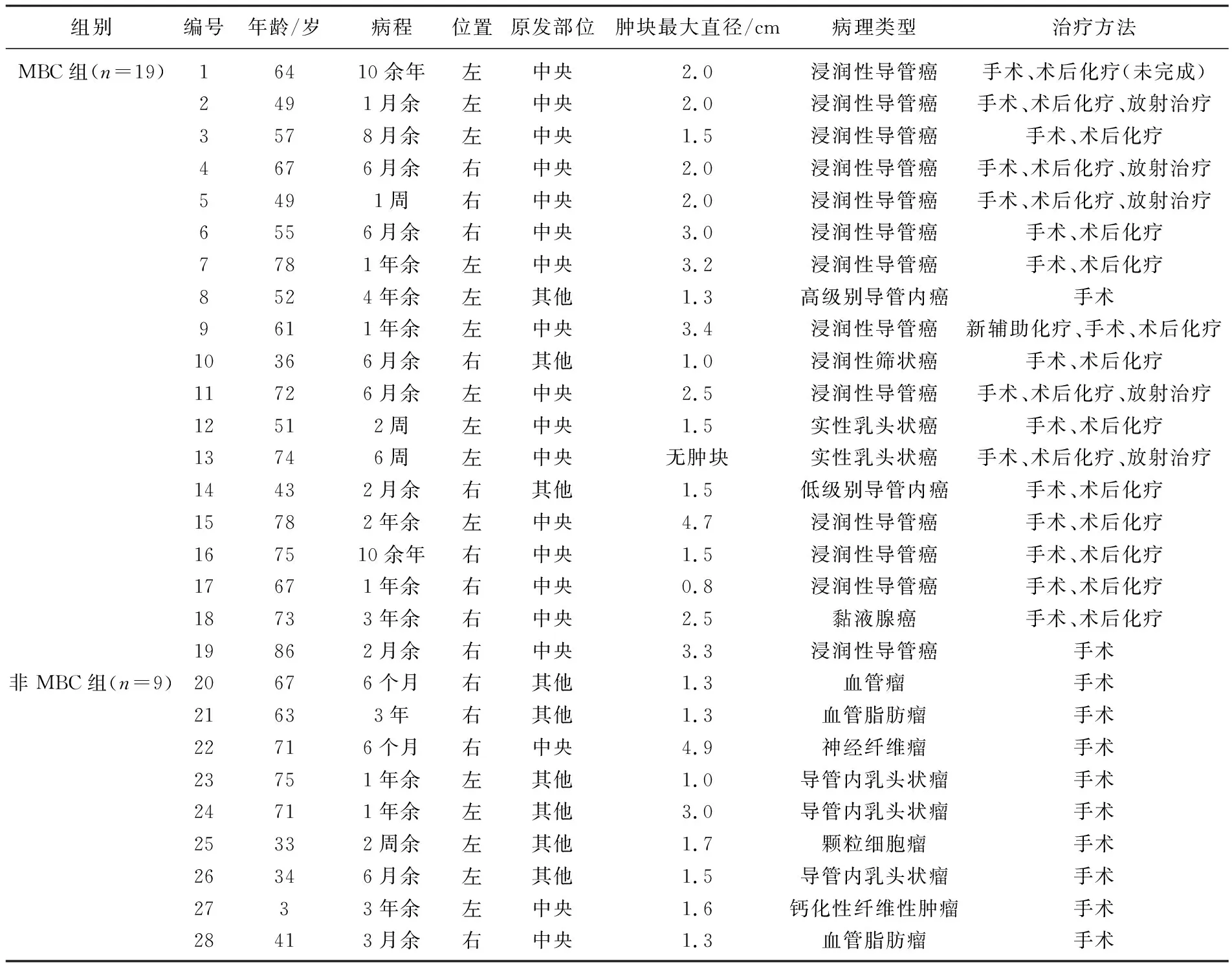
表1 男性乳腺肿瘤患者的临床病理学特征
2.2 MBC组与非MBC组的发病特征比较
28例患者中, 7例患者就诊时即伴有侵犯皮肤征象(乳头凹陷、皮肤红肿、皮肤溃疡),且均为MBC组患者, 8例伴有乳头溢液(MBC组5例,非MBC组3例), 3例合并男性乳房发育(MBC组1例,非MBC组2例)。
MBC组患者的发病年龄为36~86岁,中位发病年龄为64岁,随访时间为6~139个月。19例患者均为单侧乳腺癌,其中10例位于左侧乳腺, 9例位于右侧乳腺; 15例患者为单发肿块, 4例患者为多发肿块,病灶大多位于中央部位(占84.2%); 病程大于10年的病例有2例(占10.5%)。19例MBC患者病理类型大多为浸润性导管癌(占68.4%), 免疫组织化学结果显示, 94.7%的MBC患者激素受体阳性(雌激素受体阳性或孕激素受体阳性)。1例MBC患者既往有导管内乳头状瘤病史,该患者的免疫组织化学结果为BRCA1(约50%弱+)。17例患者接受术后化疗, 1例患者接受术前新辅助化疗,5例患者接受术后放射治疗。MBC组患者随访过程中, 1例出现肝转移,1例出现骨转移,2例出现肺转移; 2例出现第二原发癌(1例出现胃癌, 1例出现结肠癌); 3例出现主要终点事件,其中2例患者死于乳腺癌, 1例患者死于乳腺癌以外的其他原因。
9例非MBC组患者的发病年龄为3~75岁,中位发病年龄为63岁,随访时间为8~47个月。9例患者均为单侧发病,患者病程均小于10年,肿瘤位于左侧乳腺5例,位于右侧4例; 8例患者为单发肿块,1例患者为多发肿块,其中6例(66.7%)病灶位于除中央部位的其他部位。非MBC组患者中,导管内乳头状瘤3例,血管脂肪瘤2例,血管瘤1例,神经纤维瘤1例,颗粒细胞瘤1例,钙化性纤维性肿瘤1例,均行手术完整切除肿瘤。乳腺颗粒细胞瘤患者未加做区域淋巴结清扫,除乳腺颗粒细胞瘤外均为良性肿瘤,并且乳腺颗粒细胞瘤绝大多数是良性的[4],因此随访过程中非MBC组患者均未出现远处转移以及主要终点事件。
本研究结果发现, MBC组与非MBC组原发部位比较,差异有统计学意义(P<0.05), 而2组发病年龄、是否出现乳头溢液、肿瘤最大直径、肿瘤位置、病程长短、是否合并男性乳房发育这些发病特征比较,差异无统计学意义(P>0.05)。见表2。
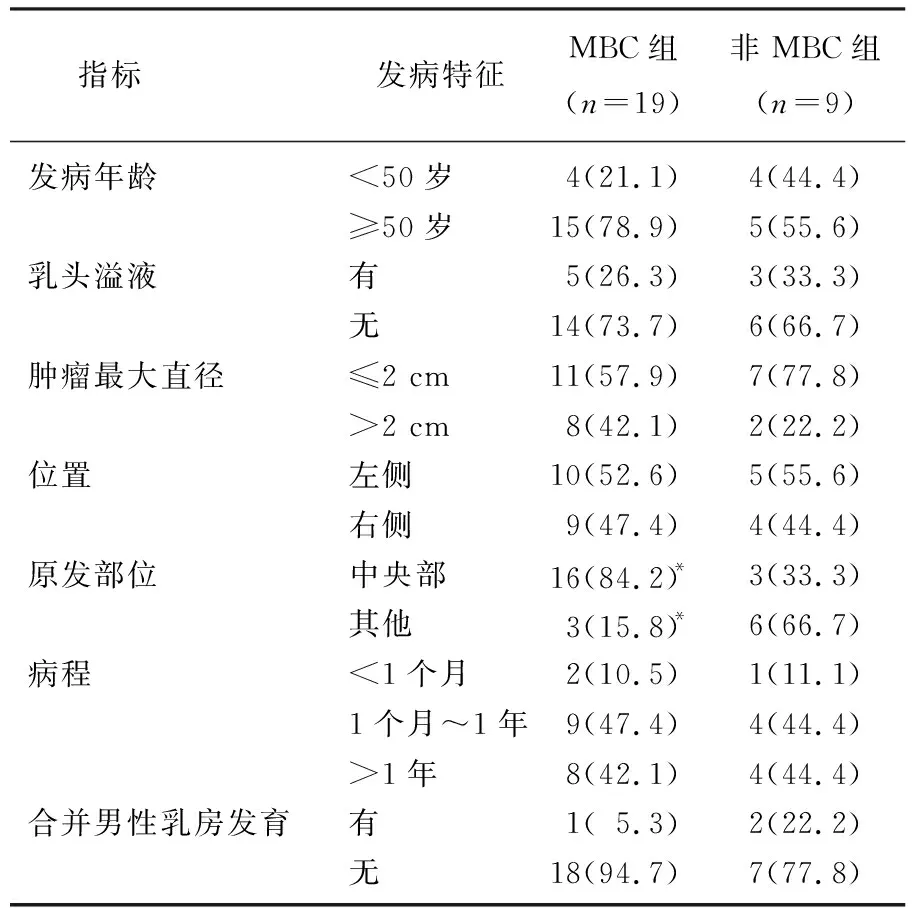
表2 2组男性乳腺肿瘤的发病特征比较[n(%)]
2.3 男性乳腺肿瘤超声表现
对男性乳腺肿瘤的超声声像图进行回顾性分析并与病理检查结果对照发现,MBC组患者中15例(78.9%)患者超声声像图表现为低回声肿块。彩色多普勒血流显像(CDFI)显示,病灶内部及周边可见血流信号的患者有6例,占31.6%, 部分为短棒状血流信号。3例(15.8%)患者病灶内部可见微小钙化灶。1例患者出现腺体增厚; 2例患者表现为形状不规则的肿块,其中1例边缘呈角状; 5例患者表现为边界清楚的肿块; 8例患者患侧乳房腋下探及肿大的淋巴结图像。
MBC组患者常见的超声表现为钙化、血流信号,非MBC组的9例患者超声声像图均未出现以上表现,非MBC组患者的病灶可表现为低回声、高回声、等回声、无回声及混合性回声肿块,其中5例患者肿块边缘界限清楚。MBC组与非MBC组的病变超声表现比较见表3。
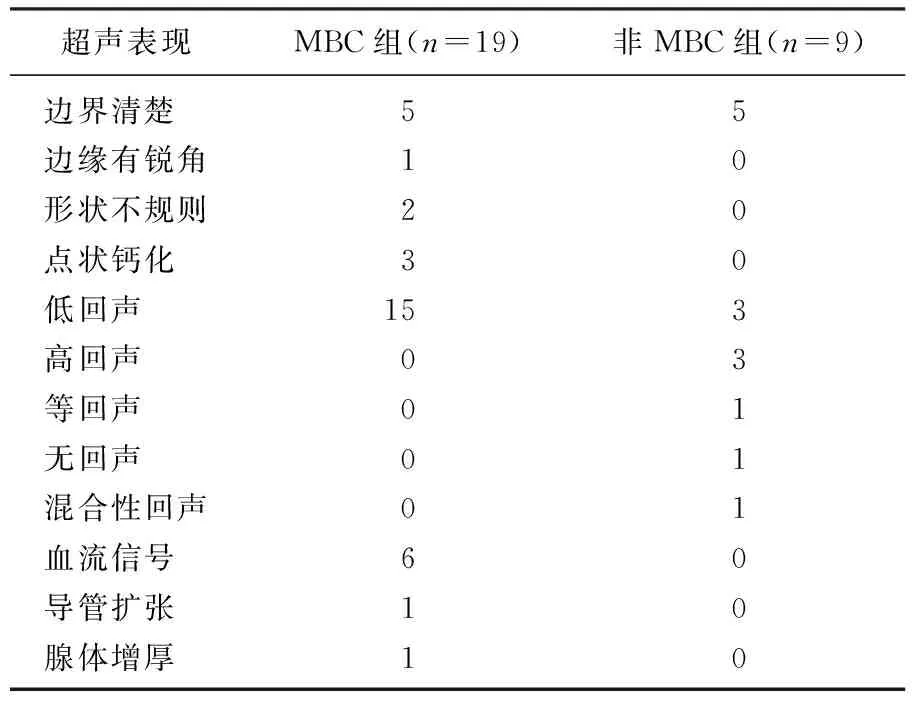
表3 男性乳腺肿瘤的超声表现
MBC组患者超声淋巴结检查存在假阴性与假阳性。超声表现为腋窝淋巴结阴性的患者中有3例经病理学确诊存在腋窝淋巴结转移,而8例患侧乳房腋下探及肿大的淋巴结图像中有3例经病理学确诊为腋窝淋巴结未出现转移。
3 讨 论
男性乳腺的解剖结构与女性不同,男性乳腺组织主要是由脂肪组织、导管及导管周围纤维组织构成[2], 因此男性乳腺肿瘤的异质性不如女性乳腺肿瘤,也不像女性乳腺肿瘤受到许多混杂因素(例如生育因素、月经)的干扰,对其临床病理特征及超声影像特点进行深入探索可能有助于乳腺肿瘤的早期诊治与鉴别诊断。
本研究包含28例男性乳腺肿瘤患者,其中15例在出现乳头溢液或者侵犯皮肤后才就诊,占53.6%; 10例患者乳房肿块大于2 cm时才就诊,占35.7%; 1例患者直至出现肺转移后才就诊。另外,本研究纳入的19例MBC患者中, 1例由于经济原因未完成化疗,1例拒绝化疗, 2例患者拒绝内分泌治疗。这些数据从侧面体现了大部分男性患者不仅缺乏对乳腺肿瘤危害性的认识,而且治疗依从性差。研究[5]发现, MBC患者的治疗依从性差主要有以下几点原因: 首先,男性比女性面临更大的精神压力、社会压力与经济压力; 其次,MBC的内分泌治疗药物他莫昔芬导致的副作用在MBC患者中很常见,多达1/4的患者选择提前终止内分泌治疗[1, 6]。
乳腺超声检查具有无辐射等优势,可用于男性乳腺肿瘤的良恶性鉴别,也可用于术前评估MBC患者的淋巴结转移情况,对于指导手术方式的选择具有重要意义。然而目前其在男性乳腺肿瘤诊断中的价值并没有得到完全发挥[7-8]。本研究对28例男性乳腺肿瘤的超声影像特点进行回顾性分析发现,低回声肿块、钙化、血流信号这些超声表现可能提示男性乳腺恶性肿瘤。另外,本研究中乳腺超声应用于术前评估MBC患者的淋巴结转移还存在着假阳性与假阴性,这表明乳腺超声检查需与体格检查相结合,以提高评估淋巴结转移的准确性。
本研究有1例因发现乳腺无痛性肿块就诊的乳腺颗粒细胞瘤患者,发生于左乳内上象限,超声表现为边界清楚的低回声结节。颗粒细胞瘤免疫组化结果: 神经元特异性烯醇化酶NSE(+)、S-100蛋白(+)、细胞角蛋白CKpan(-)、巨噬细胞特异性抗原CD68(+)、抑制素Inhibin(-)、上皮膜抗原EMA(-)、增殖抗原Ki-67(5%+)、抑癌基因P53(+),也符合颗粒细胞瘤的常见免疫组织化学结果[9-11]。
本研究中激素受体阳性的MBC患者占94.7%, 这与之前研究[1]结果基本一致。MBC组原发部位大多位于中央部,表现为乳晕下无痛性肿块[12], MBC组与非MBC组的原发部位比较,差异有统计学意义(P<0.05), 这可能与男性乳腺解剖结构以及2组病理类型不同有关。MBC组主要为浸润性导管癌,而非MBC组除导管内乳头状瘤外,还包括血管瘤、血管脂肪瘤一些发生于血管及脂肪组织的肿瘤。除此之外,原发性MBC的发生与其他癌症密切相关,使发生第2种癌症的风险增加34%[13]。大约2%的MBC患者发生第二原发性乳腺癌,超过20%的患者发生第二原发癌(非乳腺),常见的是结肠癌和泌尿生殖道癌[14-15]。本研究中19例MBC患者随访过程中有2例患者出现第二原发癌(1例胃癌、1例结肠癌)。
本研究也存在一些不足之处: ① 仅纳入28例乳腺肿瘤患者,样本量较少,还需要进行大样本、多中心研究证实本研究结论。② 超声检查可能因为检查者技术水平不一致导致误差。
综上所述,大部分男性患者存在乳腺肿瘤的认知误区,导致就医较晚,就诊时往往已出现明显症状或者其他脏器转移。因此,临床上需加大力度进行男性乳腺疾病的宣教,对有乳腺癌家族史的患者可进行BRCA基因筛查。同时,部分MBC患者治疗依从性差,也是导致预后较差的原因之一,这一点凸显了制订治疗方案时与男性乳腺肿瘤患者共同决策的重要性。另外, MBC大多位于乳腺中央部位,低回声肿块、钙化、血流信号为常见超声表现,这有助于男性乳腺良恶性肿瘤的鉴别和诊断。
