IC-IPAD同时测定运动饮料中20种氨基酸和6种糖
2020-11-04陈贯昊
陈贯昊
(平顶山工业职业技术学院,河南 平顶山 467001)
氨基酸和糖是运动饮料中两类重要的营养成分[1],氨基酸是构成人体蛋白质最基本的物质,糖类是能量的直接供给物质,这两种物质都具有多种生理功能[2-4],是人体内不可缺少的成分。饮用含有丰富氨基酸和糖类物质的运动饮料后能够起到保持和提高运动能力、加速运动后疲劳消除的作用。然而并不是所有人群都适应各种氨基酸以及对饮料中糖分的需求,因此有必要建立一种快速检测饮品中多种氨基酸和糖类的方法,以保障人们科学、合理地摄入此类营养物质。
目前氨基酸和糖的分析方法有毛细管电泳法、气相色谱法、高效液相色谱法、离子色谱法等[5-13]。毛细管电泳法、气相色谱法、高效液相色谱法等由于方法的局限性,样品均需要衍生,操作步骤复杂且稳定性差[14-15];离子色谱法检测不需衍生,具有灵敏度高、选择性好等优点[16-17]。本实验利用离子色谱-积分脉冲安培检测法(ion chromatographyintegrated pulse amperometric detection,IC-IPAD)在特定电极上、特定电压下发生氧化反应的分析物具有专一性,其他化合物不能被检测到的原理[18],同时测定运动饮料中20种氨基酸和6种糖,极大地提高了检测效率,能够满足我国市场上对此类检测的要求。
1 材料与方法
1.1 材料与试剂
20种氨基酸标准品(精氨酸、赖氨酸、谷氨酰胺、天冬酰胺、丙氨酸、苏氨酸、甘氨酸、缬氨酸、丝氨酸、脯氨酸、异亮氨酸、亮氨酸、蛋氨酸、组氨酸、苯丙氨酸、谷氨酸、天冬氨酸、半胱氨酸、酪氨酸、色氨酸,纯度均>98%):中国计量科学研究院;海藻糖、葡萄糖、蔗糖、D-乳糖、麦芽糖、三氯蔗糖标准品(纯度均>99.0%):上海安谱科学仪器有限公司。乙酸钠(纯度>99.9%),氢氧化钠溶液(质量分数50%):Thermo Scientific 公司;超纯水:由Milli-Q Advantage制得;运动饮料(5种):市售。
1.2 仪器与设备
ICS5000型离子色谱仪(配AS-AP安培检测器):美国赛默飞公司;Milli-Q纯水仪:美国Millipore公司。
1.3 实验方法
1.3.1 离子色谱条件
色谱柱:AminoPac PA10(250 mm×2.0 mm,3 μm);保护柱:AminoPac PA10(50 mm×2.0 mm);检测模式:积分脉冲安培检测;工作电极:金电极;参比电极:pH电极;电位波形:Glod,pH-Ag-AgCl RE,AAA;流动相:A为NaOH溶液(225 mmol/L),B为去离子水,C为醋酸钠溶液(1.00 mol/L);流速:0.30 mL/min;柱温:35 ℃;进样量:25 μL。梯度淋洗条件见表1。

表1 离子色谱梯度洗脱条件Table 1 Gradient elution conditions of ion chromatography
1.3.2 色谱柱温度的选择
色谱柱温度是影响离子交换速率和分离选择性的重要因素[19-21],但是关于色谱柱温度对离子色谱分离氨基酸和糖的影响当前研究较少。根据待测氨基酸和糖的物化性质和分离特性,本实验选取了26 ℃、28 ℃、30 ℃、32 ℃、35 ℃、38 ℃等6个温度进行比较分析。
1.3.3 pH值的选择
受自身分子结构、等电点、极性和解离常数等因素影响,氨基酸和糖含量一般会随pH值的变化而变化[22-23],所以需要对此因素进行研究。分别移取相同体积的10份标准储备液,调节为不同pH值,定容至相同体积,此时每份溶液中26种组分的理论浓度相同,pH值在2.0~13.0之间,依次上机测定。
1.3.4 标准曲线的绘制
分别准确称取0.050 0 g的20种氨基酸和6种糖分标准品,用超纯水溶解并定容于50 mL的容量瓶中,制得标准储备溶液。再用超纯水配制质量浓度为0.5 mg/L、1.0 mg/L、2.0 mg/L、5.0 mg/L、10.0 mg/L、20.0 mg/L、50.0 mg/L系列标准溶液,经仪器进行分析,绘制标准曲线。
1.3.5 样品前处理的优化
称取10.00 g样品加入50 mL离心管中,加入1 mol/L HCl溶液调节pH至1.7±0.1,再用1 mol/L NaOH溶液调节样品溶液pH至4.5±0.1,定容至刻度。IC-RP10小柱净化条件:依次用10 mL甲醇和10 mL水活化净化柱,然后上样并弃去前3 mL,收集流出液并通过0.22 μm水相滤膜,待上机检测。
2 结果与分析
2.1 梯度淋洗条件的选择
为提高对目标物的检测灵敏度和分离度,实验采用多级梯度淋洗模式对26种组分进行洗脱。经过反复实验和对比,淋洗步骤被分为5段:0~12.0 min、12.0~17.0 min、17.0~24.0 min、24.0~40.0 min、40.1~50.0 min。以45 mmol/L氢氧化钠溶液作为初始淋洗液浓度,在0~12.0 min区间可以实现前13种弱保留组分的有效分离。在12.0~17.0 min区间范围内,氢氧化钠浓度逐步增至90 mmol/L,此时可实现组分14~17的有效分离;在17.0~24.0 min区间范围内,逐步加入强极性淋洗液醋酸钠溶液,为中强保留组分的快速洗脱做准备。在24.0~40.0 min区间范围内,选用氢氧化钠溶液∶去离子水∶醋酸钠溶液=24∶36∶40(V/V)进行洗脱,可使组分18~25完全分离。在40.1~50.0 min区间范围内,为加快洗脱强保留组分色氨酸,同时确保其灵敏度,选择氢氧化钠∶醋酸钠=50∶50(V/V)为洗脱液。
2.2 色谱柱温度的选择
26种组分混合标准溶液的离子色谱图见图1(35 ℃)。由图1可知,在不同的色谱温度下分离,精氨酸(组分1)、海藻糖(组分2)、赖氨酸(组分3)、谷氨酰胺(组分4)、天冬酰胺(组分5)和麦芽糖(组分18)、组氨酸(组分19)、苯丙氨酸(组分20)、谷氨酸(组分21)、天冬氨酸(组分22)、半胱氨酸(组分23)、三氯蔗糖(组分24)、酪氨酸(组分25)的保留时间和灵敏度没有明显变化,因为这些物质是极性带电或含有极性较强侧链基团组分,与色谱柱的作用力主要是库仑力(电荷力)和侧链基团作用力,受温度影响相对较小。而从葡萄糖(组分6)至蛋氨酸(组分17),主要是非极性、极性不带电氨基酸和糖类,受温度影响较大。从分离度来看,在26 ℃、28 ℃、30 ℃、32 ℃、35 ℃、38 ℃时,出峰组分数量分别为23、25、25、25、26、25个。从图1中看出,26 ℃时,有3对组分出现共洗脱,分别是葡萄糖和丙氨酸(组分6和7)、丝氨酸和脯氨酸(组分12和13)、D-乳糖和异亮氨酸(组分14和15);28 ℃时,葡萄糖和丙氨酸(组分6和7)共洗脱,不能满足定性和定量分析要求;30 ℃和32 ℃时,蔗糖、丝氨酸和脯氨酸(组分11、12和13)重叠;38 ℃,缬氨酸和蔗糖(组分10和11)以及亮氨酸和蛋氨酸(组分16和17)共洗脱;而35 ℃时,26种组分有效分离,总体分离度最好。

图1 不同色谱柱温度下26种组分混合标准溶液测定的离子色谱图Fig.1 Ion chromatogram of 26 components mixed standard solution at different column temperatures
2.3 pH值对目标组分的影响
本实验选择2.0~13.0之间不同pH值对26种组分测定的影响。由图2可知,苏氨酸、甘氨酸、蛋氨酸、半胱氨酸、色氨酸、海藻糖、蔗糖这7种组分几乎不受pH值的影响,在酸性和碱性条件下,测定值均比较稳定;而谷氨酸、丝氨酸、苯丙氨酸、脯氨酸、天冬酰胺、天冬氨酸、葡萄糖、D-乳糖、麦芽糖这9种组分测定值受pH值影响较大。
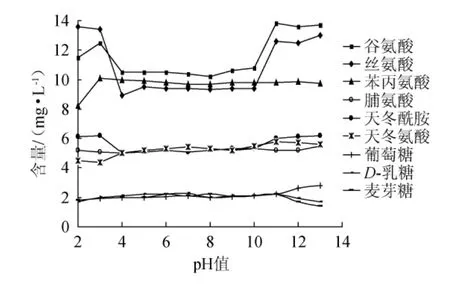
图2 不同pH值对目标组分的影响Fig.2 Effect of different pH on target components
由图2可知,谷氨酸和丝氨酸受pH值影响较大,且受pH影响的规律一致,在强酸和强碱性条件下测定值均出现了大幅增大,说明在酸碱性条件下两种组分溶液中离子含量较中性时出现明显增大;苯丙氨酸、脯氨酸、天冬酰胺、天冬氨酸这4种组分测定值受pH值影响相对较小,当pH值<4.0或者pH值>10.0时,这4种组分测定值才会出现波动变化,主要是因为这4种组分是两性电解质,酸性条件下,氨基(-NH2)吸收H+带正电,碱性条件下,羧基(-COOH)失去H+带负电,因此,在强酸和强碱溶液中氨基酸离子含量随其电离程度大小而变化。除天冬氨酸等电点为2.77、谷氨酸3.22、赖氨酸为9.74、精氨酸为10.76外,其他16种氨基酸的等电点在5.05~7.60之间,在等电点附近溶液中氨基酸离子的含量稳定,因此,在弱酸性条件下多数氨基酸测定值稳定。从图2还可以看出,葡萄糖、D-乳糖、麦芽糖在强酸性条件下,测定值稍有降低,但是在强碱性条件下,葡萄糖测定值逐步增大,而乳糖、麦芽糖测定值逐步降低,这是由于3种糖中均含有游离的醛基,是还原糖,而乳糖和麦芽糖属于二糖,在一定条件下可发生水解等反应转化成一定量的葡萄糖,导致葡萄糖测定值有所增大。综合考虑,选择pH值为5.2~6.7,即弱酸性条件下进行分析测定,这26种组分均在稳定的pH值范围内。
2.4 样品前处理的优化
运动饮料类一般含有蛋白质、明胶和果胶等物质,不仅会对目标组分的色谱峰产生干扰,而且还容易对离子色谱柱及检测器造成损坏。因此,需在样品的前处理过程中增加除蛋白的步骤以减少干扰,保护色谱柱。考虑到AminoPac PA10离子色谱柱对有机试剂的不耐受性以及金属离子对其的不良影响,本实验选择调节pH沉淀蛋白的方式并结合净化柱的方式对样品进行前处理[24]。常用的离子色谱净化柱有On Guard Na柱、On Guard A柱以及On Guard RP柱:On Guard Na柱主要用于去除样品溶液中的金属离子;On Guard A柱主要用于去除样品溶液中的阴离子污染物并中和强酸;而On Guard RP柱主要用于去除样品溶液中的疏水性物质及表面活性剂。考虑到样品溶液中可能存在部分脂溶性物质,所以选择On Guard RP柱以除去样品中的脂溶性物质,避免污染色谱柱。
2.5 方法的线性范围与灵敏度
以表1梯度洗脱的步骤,按1.3.3实验步骤配制26种氨基酸和糖的混合标准溶液,绘制标准曲线,依据色谱峰的信噪比大于3倍确定检出限,信噪比大于10倍确定定量限。26种种组分的保留时间、线性回归方程、相关系数、检出限与定量限见表2。由表2可知,26种目标物组分在0.5~50 mg/L质量浓度范围内均具有良好的线性关系,相关系数(R2)均>0.99,检出限为0.01~0.03mg/L,定量限为0.003~0.200mg/L。

表2 26种组分的保留时间、线性回归方程、相关系数、检出限与定量限Table 2 Retention time,linear regression equation,correlation coefficient,detection limit and quantitative limit of 26 components
2.6 方法的精密度、重复性与回收率
在加标回收实验中,根据目标物的定量限,分别添加3个低、中、高三个水平(1 mg/L、10 mg/L、50 mg/L)混合标准溶液,每个结果测定5次,来验证测定运动饮料基质(样品选择为表4中的样品1)时方法的回收率和精密度,根据基质浓度、添加浓度和测定浓度计算回收率,3个浓度水平的平均回收率和相对标准偏差(rlative sandard deviation,RSD),结果见表3。
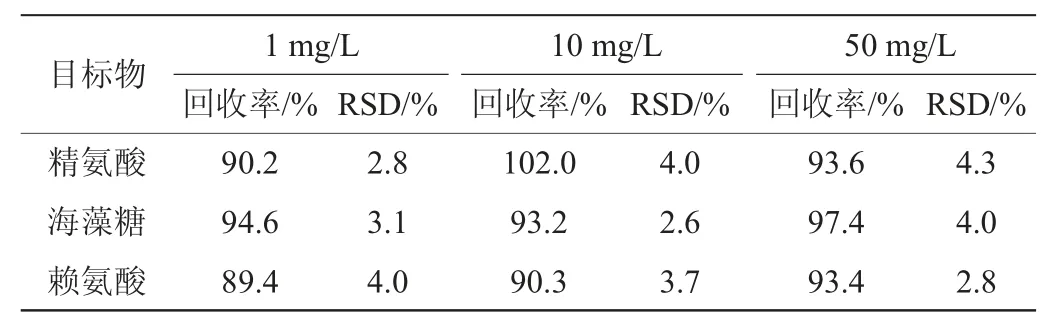
表3 方法的回收率实验结果Table 3 Results of recovery rate tests of the method

续表
由表3可知,26种组分在3种浓度的添加水平下回收率在86.2%~105.0%之间,测定数据的RSD在1.9%~5.3%范围内,说明本实验的测定方法准确性高、精密度好。
2.7 样品的测定
本实验还对市场上购买的5种常见运动饮料中的20种氨基酸和6种糖含量进行测定,每个结果平均测定5次,具体结果见表4。

表4 样品中20种氨基酸和6种糖的测定结果(n=5)Table 4 Determination results of 20 amino acids and six sugars in samples (n=5)

续表
由表4可知,从市场上随机抽取的样品中氨基酸和糖的种类及含量差异较大。5款饮品中都含有谷氨酸,而精氨酸、赖氨酸、丙氨酸、苏氨酸、缬氨酸、丝氨酸、脯氨酸、异亮氨酸、亮氨酸、蛋氨酸、组氨酸、苯丙氨酸、天冬氨酸、色氨酸这14种氨基酸只有个别样品中有,而谷氨酰胺、天冬酰胺、甘氨酸、半胱氨酸、酪氨酸在这5种样品中没有添加,整体氨基酸检测到的种类与产品外包装标签中标出的一致;而5款饮品中都含有葡萄糖,而蔗糖、D-乳糖、三氯蔗糖只有个别样品中有,海藻糖、麦芽糖没有检出。针对分析测定的结果,可以根据自身的需要,选用不同类型的功能性饮料,来补充全面的或者单一的氨基酸和糖,这样会达到更有效的补充目的。
3 结论
本实验通过对梯度淋洗条件、色谱柱温度、溶液pH值以及前处理条件等多种影响因素进行研究,建立了一种梯度淋洗-离子色谱-积分脉冲安培检测法同时测定运动饮料中26种组分含量的方法。26种目标物组分在0.5~50 mg/L质量浓度范围内均具有良好的线性关系,检出限为0.001~0.060 mg/L,定量限为0.003~0.200 mg/L,加标回收率达到86.2%~105.0%,RSD为1.9%~5.3%,可用于运动饮料中氨基酸和糖的同时检测,这为运动饮料样品中多组分的同时测定提供了一种高效、便捷、准确的技术手段。
