枸杞酒多糖的提取、成分测定及其对酒精性肝病的影响研究
2020-11-04赵嘉庆史春丽王立英
赵嘉庆,史春丽,王立英,何 斌,赵 巍,王 浩
(1.宁夏医科大学 基础医学院,宁夏 银川 750004;2.宁夏回族自治区医学科学研究所,宁夏 银川 750004;3.宁夏森淼枸杞科技开发有限公司,宁夏 银川 750000)
酒精性肝病(alcoholic liver disease,ALD)是由持续过量饮酒引起的一种慢性、广谱的肝脏损伤,在全世界酗酒人群中排在发病率和死亡率的主要原因之列[1]。ALD包括肝损伤的组织学范围,从单纯性脂肪变性到以炎症为特征的肝炎,并有可能进展为纤维化和肝硬化。肝脏慢性炎症在慢性饮酒者中的发病率约为10%~35%,在ALD的可逆病理过程中起重要作用,可导致超过1/3的发病率和死亡率[2-4]。当肝脏受到损伤时,丙氨酸氨基转移酶(alanine aminotransferase,ALT)与天冬氨酸氨基转移酶(aspartate aminotransferase,AST)大量释放到外周血中,其含量异常增高,肝脏组织中出现细胞坏死和及相关炎性细胞因子的产生,从而提示肝脏病变[5],为减少酒精性肝病对人体造成的损伤,大量的研究者进行酒精肝的缓解与保护方面的研究,相关文献报道显示,琴叶榕[6]、草果,菱角壳水提混合物[7]、醋酸菊粉[8]等粗提物对酒精肝均具有一定的保护作用。
枸杞多糖具有抗细胞凋亡、抗氧化、抗炎和促进生育功能[9-10]外,对酒精肝的作用还不清楚,少有研究关于来源于枸杞酒类的多糖对酒精肝的作用。该研究主要以枸杞酒为研究对象,经过多重工艺进行加工提纯,制成香醇可口的养生保健品,其主要为枸杞多糖(Lycium barbarumpolysaccharides,LBP)。本研究通过建立经典的酒精肝病小鼠模型,并探究宁夏特色枸杞酒产品中枸杞多糖的主要成分,并验证对酒精肝的保护作用,这有助于枸杞酒的开发和利用。
1 材料与方法
1.1 材料与试剂
1.1.1 样本信息
枸杞酒(酒精度12%vol)及枸杞酒中提取的枸杞多糖:宁夏银川森淼科技有限公司。
1.1.2 实验动物与饲料
选用6~8周龄的60只雌性C57BL/6小鼠,体质量为28~30 g,购买于北京维通利华实验动物技术有限公司。适应性喂养1周后按体质量随机分为4组,每组15只,分别为对照组、模型组、对照+LBP组、模型+LBP组。饲养于温度在20~26 ℃,相对湿度在45%~75%的SPF动物房内。
饲料:模型组饲喂能量组成为蛋白质18%、碳水化合物19%、脂肪35%、乙醇28%的改良酒精玉米油液体日粮,对照组饲喂等热量麦芽糖糊精的改良玉米油液体日粮作为对照,均购买于中国南通营养动物饲料高科技有限公司。
1.1.3 试剂
硝酸、盐酸、体积分数为95%乙醇(分析纯)、多元素混合标准储备液、氨基酸标准储备液;丙酮溶液70%、雷氏盐3%;血清内毒素检测试剂盒(鲎试剂):厦门生物多科技有限公司;IL-1β、IL-6、TNF-α、IL-10细胞因子检测试剂盒:厦门生物多科技有限公司;胎牛血清、磷酸盐缓冲液:北京索莱宝科技有限公司。
1.2 仪器与设备
TS-NS-300中试水提醇沉设备:上海顺仪实验设备有限公司;AU400全自动生化分析仪:710-ES电感耦合等离子体发射光谱仪:美国瓦里安公司;TU-1900紫外可见分光光度计:北京普析通用仪器有限公司;日本奥林巴斯公司;C6流式细胞分析仪:美国BD公司;Z326K台式冷冻离心机:德国Hermle公司;GYXH-70制冰机:厦门国仪科学仪器有限公司。
1.3 方法
1.3.1 枸杞酒多糖提取及制备
以酿制的酒精度为12%vol枸杞酒为原料,每次1000mL,进行旋蒸浓缩,全部浓缩完成后合并浓缩液,用体积分数为95%乙醇调至乙醇终体积分数80%后,沉淀过夜,倾出上清液后,冷冻干燥即得。
1.3.2 枸杞酒中枸杞多糖含量的测定
准确称取105 ℃干燥质量恒定的分析纯无水葡萄糖0.1 g,加水溶解并定容至1 000 mL。准确吸取溶液0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、2.0 mL,分别置于具塞试管中,各加水使体积为2.0 mL,再各加6%苯酚溶液1.0 mL,摇匀,迅速加入浓硫酸5.0 mL,摇匀后放置5 min,置沸水浴中加热15 min,取出冷却至室温;另取水2 mL加6%苯酚溶液和浓硫酸,同上操作,作为空白对照,于490 nm波长处测定吸光度,绘制葡萄糖标准曲线。分别吸取0.01 mL枸杞酒样品,再分别加入超纯水1.99 mL,混匀。
1.3.3 枸杞酒多糖中矿质元素含量检测
称取制备好的枸杞酒多糖0.1 g置于50 mL消解管中,加入10 mL硝酸,利用石墨消解炉加热至180 ℃消解,当溶液消解至无色透明状后,继续赶酸,剩余1~2 mL停止消解,转移至10 mL样品管中,使用超纯水定容,上机检测[11]。
1.3.4 枸杞酒多糖中氨基酸含量测定
称取制备好的枸杞酒多糖0.1 g,置于厌氧管中,加入10 mL浓度为6 mol/L的盐酸溶液,置于110 ℃烘箱中,水解反应24 h,水解结束后,放至室温,过滤,吸取0.5 mL滤液置于试管浓缩仪中,浓缩蒸发至干,加入2 mL样本稀释液,震荡混匀,用0.22 μm水性滤膜过滤后,上机检测。
1.3.5 实验动物处理方法
根据现有文献报道[12]的方法,进行酒精肝模型的制备。一种简单的酒精性肝脂肪变性小鼠模型是通过长期酒精喂养加一次大量酒精摄入后诱导而成[13]。模型+LBP与对照+LBP两组每只鼠每日分别进行枸杞酒多糖150 mg/kg长达6周的灌胃,模型与对照组小鼠灌服等量的生理盐水后,所有小鼠口服对照液体饲料一周,然后给予含有乙醇的改良液体饲料(模型组)或等热量麦芽糖糊精作为对照(对照组),为期10 d,第11天,单次灌胃31.5%乙醇(5 g/kg)或等热量麦芽糖糊精溶液。对照组和对照+LBP组分别为模型组和模型+LBP组的配对喂养对照。根据制造商的说明,每天都有新鲜的粉末制成流质日粮,监测并计算饮酒小鼠的摄食量和平均每天每只小鼠的摄食量。计算出的体积被用来调整给予配对喂养的小鼠的对照液体饮食量,以便酒精喂养的小鼠和配对喂养的小鼠摄入等量的食物。第12天,安乐处死小鼠,观察相关指标。
1.3.6 生化指标检测
取小鼠外周血于1.5 mL离心管中,2 000 r/min,4 ℃离心10 min,分离出血清。宁夏医科大学科技中心医学分析检测中心检测血清中丙氨酸氨基转移酶(ALT)与天冬氨酸氨基转移酶(AST)的含量。
1.3.7 血清内毒素含量检测
血清内毒素的含量采用厦门科技有限公司血清内毒素检测试剂盒检测,操作步骤详见说明书。
1.3.8 脾脏与血清酶联免疫吸附实验
取0.5 g肝组织匀清于1.5 mL冰冷50 mol/L Tris缓冲液(pH 7.2,Tris含1%Triton-X100和0.1%蛋白酶抑制剂)中,冰上振荡90 min。取匀清,3 000 g离心15 min。收集上清液测定肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)浓度。采用酶联免疫吸附实验检测血清和肝组织上清液中各细胞因子水平,按操作说明书进行。
1.3.9 统计学分析
使用Graphpad Prism 6.0软件进行统计学分析,各组实验数据用表示,两组间比较用两样本t检验,P<0.05为差异有统计学意义。
2 结果与分析
2.1 枸杞酒多糖的提取
葡萄糖的标准曲线回归方程为:y=36.47x+0.025 3,相关系数为R=0.998 6。以枸杞酒为原材料,提取枸杞多糖其多糖质量浓度为1.2 g/L。
2.2 枸杞酒多糖成分的测定
2.2.1 枸杞酒多糖中矿质元素含量测定
对枸杞酒多糖中矿物质元素含量的检测,含量测定结果见表1。由表1可知,枸杞酒多糖中矿物质元素种类和含量较为丰富,其中常量元素Ca、P、Mg、K、Na的含量较高,分别为0.09%,0.68%,0.27%,3.92%,0.51%。这些常量元素是维持人机体代谢的重要物质,缺少任何一种都会使人体代谢出现失调[14]。枸杞多糖中含量前三的微量元素有Fe、Zn、Cu,其含量分别为0.007 8%,0.005 3%,0.002 5%。微量元素能与氨基酸、蛋白质或其它有机结合形成各种酶、激素、核酸、维生素等具有生物活性和催化生物反应的作用。这些矿物质元素含量明显高于赵丽莉等[15]通过微波密闭消解法测定宁夏枸杞中矿物元素中的元素含量,说明枸杞酒多糖中含有较高的矿物质元素,这可能对人体的代谢具有一定的促进作用。
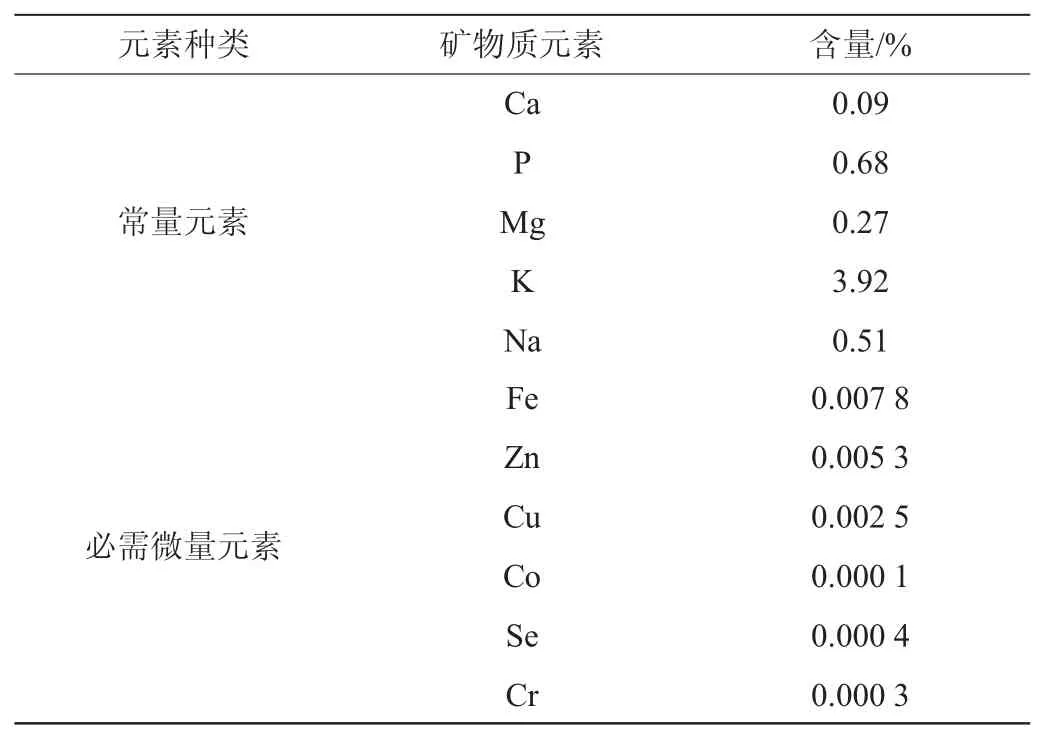
表1 枸杞叶多糖中矿质元素含量检测结果Table 1 Determination results of mineral elements in polysaccharides of Lycium barbarum wine
2.2.2 枸杞酒多糖中氨基酸含量测定
氨基酸对人体的代谢组成发挥着重要作用。氨基酸是组成蛋白质的基本单位,能够维持人体的正常代谢,是体内的酶、激素、抗体的重要组成成分,具有延年益寿,增加免疫力的功效。而枸杞多糖能够增加机体免疫力,这与其中含有多种氨基酸是分不开的。对枸杞酒多糖中氨基酸含量进行检测,结果见表2。由表2可知,枸杞酒多糖中共检测到17种氨基酸,其中以天冬氨酸(ASP)、谷氨酸(GLU)、脯氨酸(PRO)的含量较多,分别为7.25%、4.96%、3.56%,其次为丝氨酸(SER)、丙氨酸(ALA)、精氨酸(ARG),含量分别为1.87%、1.74%、1.24%。苏氨酸(THR)、组氨酸(HIS)、赖氨酸(LYS)、缬氨酸(VAL)、亮氨酸(LEU)含量分别为0.86%,0.34%,0.33%,0.30%,0.30%。
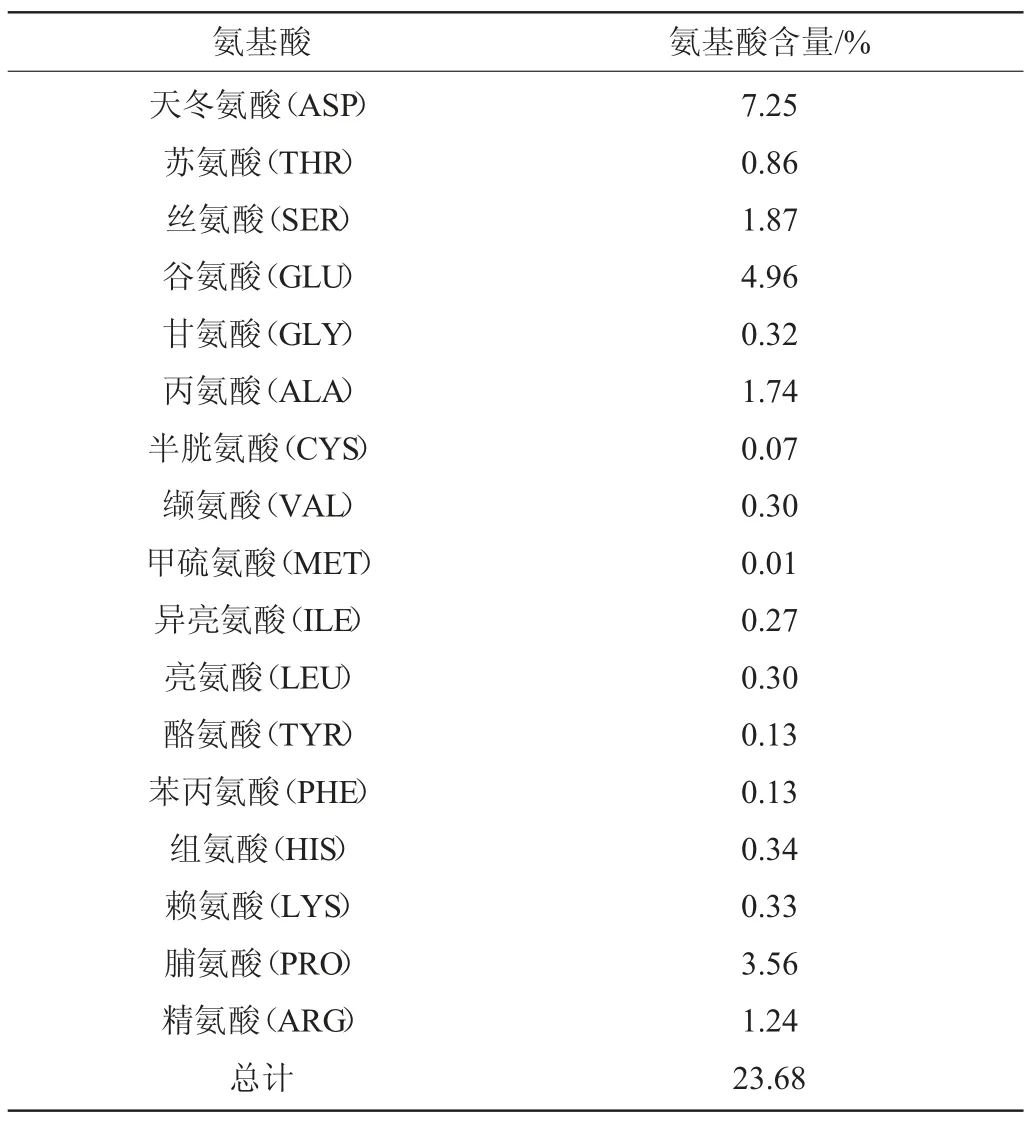
表2 枸杞酒多糖中氨基酸含量测定结果Table 2 Determination results of amino acids in polysaccharides of Lycium barbarum wine
2.3 枸杞酒多糖对酒精性肝病的影响
2.3.1 小鼠血清中ALT、AST及LPS水平
慢性饮酒后血清丙氯酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平异常增高,提示肝脏受到损伤[16-18]。不同处理组对小鼠血清中ALT以及AST水平的影响结果见图1。由图1可知,模型组血清ALT和AST水平显著升高(P<0.001),可判定酒精肝造模成功。模型+LBP组小鼠血清ALT、AST明显降低(P<0.001),具有统计学差异。提示LBP得干预可减轻慢性酒精喂养所致的肝损伤。就相关文献报道,LBP也可通过降低其他炎症性疾病的ALT和AST水平来减轻肝脏损伤的能力[19-20]。
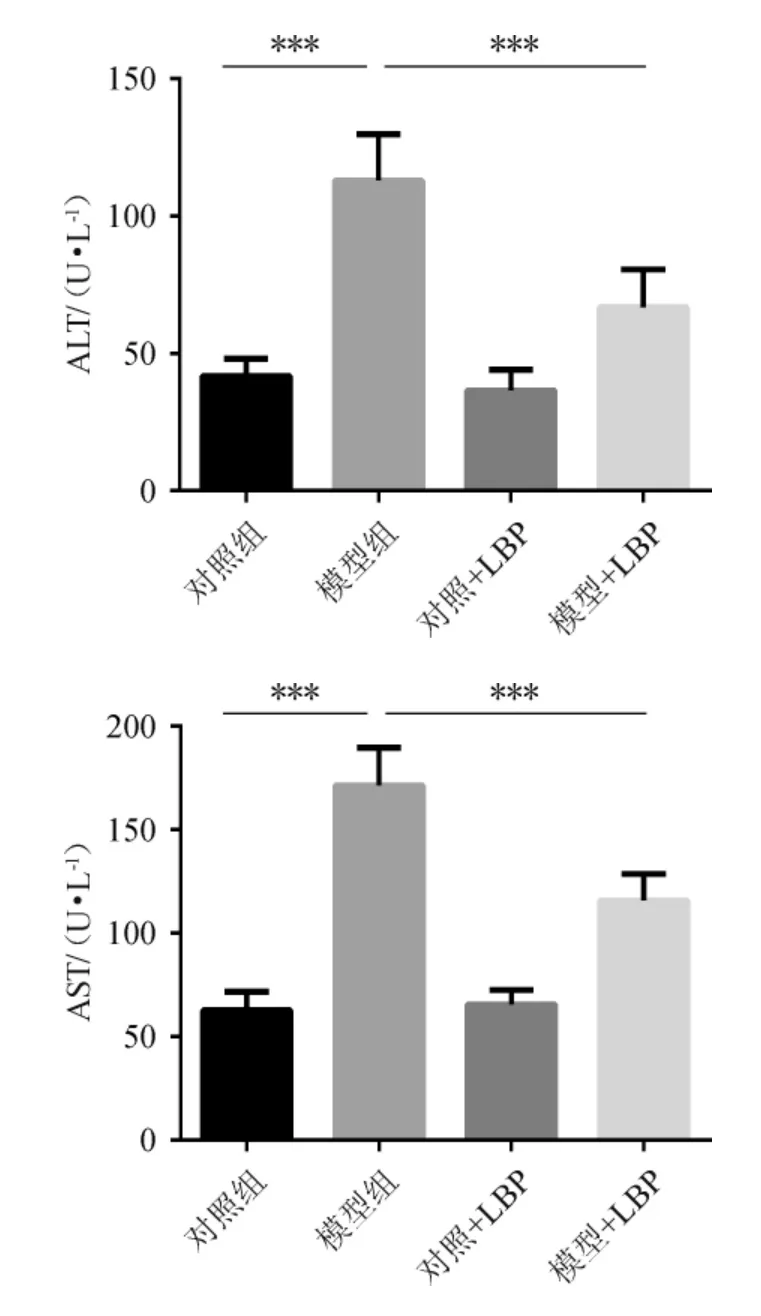
图1 不同处理组对小鼠血清中血清谷丙氨酸氨基转移酶与天冬氨酸氨基转移酶水平的影响Fig.1 Effects of different treatment groups on the level of alanine amino transferase and aspartate amino transferase in mice plasma
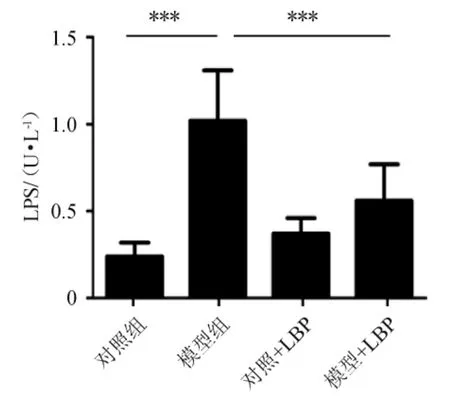
图2 不同处理组对小鼠血清中脂多糖水平的影响Fig.2 Effects of different treatment groups on the level of lipopolysaccharide in mice plasma
脂多糖(lipopolysaccharide,LPS)是ALD肝脏炎症的触发因子,通过门静脉移位到肝脏,与抗原提呈细胞(antigen presenting cell,APC)的TLR-4结合,诱导炎症免疫反应,最终导致慢性肝炎[21]。不同处理组对小鼠血清中LPS水平的影响结果见图2,结果显示,与模型组相比,模型+LBP组血清内毒素水平显著降低(P<0.000 1),但仍高于对照组和对照+LBP组,说明膳食LBP具有降低血液循环内毒素血症的作用,降低ALD大鼠肠道通透性,减少LPS从肠道向肝脏的移位,减少ALD的系统循环,从而减轻肝脏的炎症反应。这种减弱可能与肠道天然免疫系统有关,其潜在机制需要进一步研究[22]。
2.3.2 小鼠血清及肝脏中细胞因子水平。

图3 不同处理组对小鼠血清和肝脏细胞因子水平的影响Fig.3 Effects of different treatment groups on the levels of cytokines in plasma and liver of mice
库普弗细胞和中性粒细胞是ALD引起炎症的主要细胞,其诱导氧化应激,并产生炎性细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(IL-6),导致肝细胞凋亡和坏死,从而导致肝损伤[23-24]。不同处理组对小鼠血清和肝脏细胞因子水平的影响结果见图3。由图3可知,慢性酒精摄入后,空白组血清和肝脏IL-1β、IL-6和TNF-α较上述细胞因子显著升高(P<0.05),然而经过LBP干预后的模型鼠降低乙醇引起的血清和肝脏IL-1β异常升高(P<0.05),具有统计学差异。同样,模型+LBP组血清和肝脏IL-6和TNF-α水平也明显低于这两种细胞因子(P<0.000 1)。模型组与模型+LBP组血清和肝脏IL-10水平无显著性差异(P>0.05)。表明经LBP治疗后,循环和肝脏炎症明显减轻,提示LBP对ALD的保护作用可能与其抗炎作用有关。
3 结论
从枸杞酒中提取出多糖,并对其成分进行了测定,发现了大量的氨基酸及矿物质元素,从而进一步证实了枸杞多糖是枸杞酒发挥养生保健作用的重要因素,并且长期饮食枸杞多糖的酒精肝小鼠,血清中ALT、AST及LPS含量较酒精肝模型组明显降低,炎症因子也显著下降。可见LBP的干预可缓解酒精性肝损伤,提示在日常饮酒的过程中,含有枸杞多糖的枸杞酒可以在一定程度上减轻酒精对人体造成的伤害,这对宁夏枸杞酒的开发利用提供了一定的理论基础与应用价值。但是来源于枸杞酒中的枸杞多糖具体的酸碱度及活性成分分析及对酒精肝发挥作用的具体机制还需进一步研究。
