急性冠状动脉综合征患者血脂管理临床路径专家共识
2020-11-04
急性冠状动脉综合征(ACS)是指冠状动脉内不稳定的粥样硬化斑块破裂或糜烂继发新鲜血栓形成所导致的心脏急性缺血综合征,包括ST 段抬高型心肌梗死(STEMI)、非ST 段抬高型心肌梗死(NSTEMI)和不稳定性心绞痛[1]。ACS 患者除急性期抗凝、抗血小板、血运重建治疗外,危险因素的管理同样至关重要,其中血脂管理尤为重要。在现有治疗模式下,ACS 患者血脂管理面临严峻挑战。ACS 患者本身属于极高危人群[2],冠状动脉事件再发率、死亡率高。ACS 患者长期随访研究(EPICORE-Asia 研究)显示,ACS 患者出院后1 年总冠状动脉事件发生率为12.5%,2 年内死亡率为5.2%[3-4]。北京市2007~2012 年急性心肌梗死(AMI)住院患者30 d 病死率调查结果显示,77 943 例AMI 住院患者30 d 内归因于冠心病的年龄标化病死率为9.7%[5],提示我国ACS 负担日渐加重,已成为重大的公共卫生问题。
血脂异常是动脉粥样硬化最重要的危险因素之一[6]。然而,我国ACS 患者的血脂管理状况并不理想,达标率不足50%[7-8],再发心血管事件风险大幅增加,而合并冠状动脉多支血管病变、发生多次冠状动脉事件、糖尿病、多血管床病变的ACS患者基线风险更高,更应加强血脂管理。近年来不断积累的基础与临床研究证据进一步把低密度脂蛋白胆固醇(LDL-C)确定为动脉粥样硬化性心血管疾病(ASCVD)的首要干预目标。与此同时,其他血脂参数如脂蛋白a [Lp(a)]也日益受到关注。多项研究表明,Lp(a)水平是预测冠心病患者再发心血管事件风险的有效指标,且与冠状动脉病变严重程度相关[9-10]。
近年来,降脂领域中ACS 患者的相关循证证据不断丰富,新的治疗手段及干预策略进一步降低了ACS 患者再发心血管事件的风险。目前,我国院外血脂管理难度大,而院内的强化血脂管理有助于提高患者依从性。因此,在结合我国临床现状及从业专家临床经验的基础上,中国医师协会心血管内科医师分会专家集体制定了本共识,以期规范我国ACS 患者血脂管理,降低再发心血管事件风险。
1 调脂干预靶目标
ACS 患者血脂异常尤其是LDL-C 水平升高是导致心血管事件发生、发展的关键因素。对于ACS患者血脂管理,现有指南一致强调,LDL-C 仍然为主要调脂干预靶点。随着临床证据的不断丰富,ACS 患者LDL-C 水平目标值已经在1.8 mmol/L(70 mg/dl)基础上进一步降低至<1.4 mmol/L(55 mg/dl)或进一步增加降脂幅度[11-12](表1),而对于两年内复发血管事件(不一定与首发事件相同)且服用最大耐受剂量他汀类药物(他汀)的患者,可考虑调脂治疗目标为LDL-C 水平<1.0 mmol/L(<40 mg/dl)。IMPROVE-IT 研究显示,ACS 患者给予依折麦布联合辛伐他汀或辛伐他汀单药治疗,LDL-C 水平分别降至1.4 mmol/L(55 mg/dl)与1.8 mmol/L(70 mg/dl),依折麦布与辛伐他汀联合治疗组主要终点事件相对发生风险下降6.4%[13]。ODYSSEY Outcomes 研究显示,ACS 患者经阿利西尤单抗治疗后LDL-C 水平可降至1.38 mmol/L(53 mg/dl),与安慰剂组相比,阿利西尤单抗组治疗第12 个月时LDL-C 水平降幅为61.0%,48 个月时LDL-C 降幅为54.7%,主要终点事件发生风险降低15%,全因死亡风险下降15%;针对LDL-C 被降至极低水平[≤0.39 mmol/L(15 mg/dl)]者进行的亚组分析显示,心血管事件发生风险进一步降低29%,且新发糖尿病、神经认知功能障碍及出血性脑卒中等不良反应不增加[11]。FOURIER 研究纳入的ASCVD 患者(大多为稳定性冠心病患者)经依洛尤单抗治疗48 周后,LDL-C 水平降幅为59%,Lp(a)水平降幅为26.9%,主要心血管事件发生风险降低15%[12]。
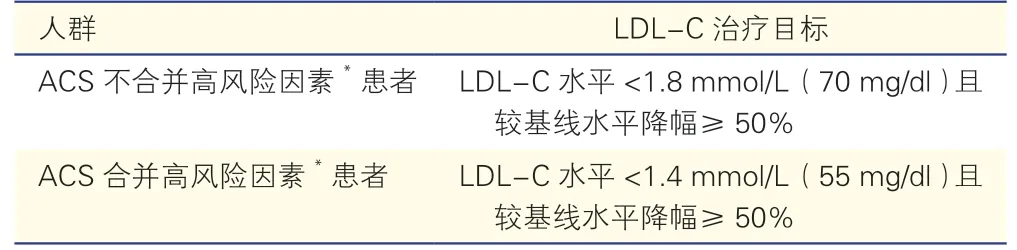
表1 ACS 患者心血管危险分层及LDL-C 治疗目标
近年来Lp(a)备受关注。病理生理学、流行病学及基因学研究为Lp(a)与心血管疾病间的因果关系提供了强有力的证据[14-15]。ODYSSEY Outcomes研究亚组数据显示,Lp(a)水平降低与主要不良心血管事件发生风险降低显著相关(P=0.0081)[16]。Lp(a)水平在正常人群中呈明显偏态分布,个别人可高达100 mg/dl(250 nmol/L)以上,但80%的正常人在20 mg/dl(50 nmol/L)以下[17]。Lp(a)水平人群分布及心血管风险预测阈值存在种族差异,当前使用的50 mg/dl(125 nmol/L)阈值是来自白种人的研究数据[18]。目前尚未建立我国人群的Lp(a)水平参考范围和心血管风险预测阈值。我国学者开展的一项多中心、前瞻性队列研究显示,对4 078例接受经皮冠状动脉介入治疗(PCI)的稳定性冠心病患者[Lp(a)水平<15、15~30、≥30 mg/dl(<37.5、37.5~75.0、≥75.0 nmol/L)者分别占总人群的49.2%、20.2%、30.6%]平均随访4.9 年期间,Lp(a)水平每升高1 个标准差,心血管事件及脑卒中发生风险分别增加30%和29%;Lp(a)水平≥30 mg/dl (75.0 nmol/L)患者中无事件生存率明显低于Lp(a)水平<15 mg/dl(37.5 nmol/L)者;进一步分析表明,相较于Lp(a)水平<15 mg/dl(37.5 nmol/L)者,Lp(a)水平≥30 mg/dl(75.0 nmol/L)者心血管事件发生风险增加1.1 倍[19]。
推 荐
(1)建议ACS 患者二级预防,推荐LDL-C水平<1.8 mmol/L(70 mg/dl),且较基线水平降幅≥50%;ACS 合并高风险因素患者调脂治疗目标值为LDL-C<1.4 mmol/L(55 mg/dl),且较基线水平降幅≥50%。
(2)建议筛查ACS 患者的Lp(a)水平,Lp(a)水平升高 [≥30 mg/dl(75.0 nmol/L)]者应进行血脂管理[17]。
2 常用降脂药物
临床常用的降脂药物主要包括他汀、胆固醇吸收抑制剂及前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂。
2.1 他汀类药物
他汀可竞争性抑制3-羟基3-甲基戊二酰辅酶A 还原酶活性,减少胆固醇合成,继而上调肝细胞表面低密度脂蛋白(LDL)受体,加速血清LDL 分解代谢。欧美指南推荐所有ACS 患者尽早启动或持续使用大剂量他汀治疗[20],但他汀代谢存在种族差异,相较于欧美人群,中国人群对他汀敏感性高、耐受性差。DYSIS-China 研究表明,高强度他汀治疗并不是LDL-C 水平达标的有利因素,可能与他汀“6%规则”有关,即他汀剂量翻倍只能带来额外6%的LDL-C 水平降幅[21]。HPS2-THRIVE 研究表明,在使用中强度同等剂量他汀治疗的情况下,中国患者肝酶升高(>正常值上限3 倍)和肌病发生风险均超过欧洲患者10 倍[22]。因此,我国血脂异常指南推荐ACS 患者起始宜应用中等强度他汀,根据个体调脂疗效和耐受情况,适当调整剂量,若LDL-C水平不能达标,可考虑联用其他调脂药物[17],如依折麦布、PCSK9 抑制剂。
关于他汀对Lp(a)水平的影响,各研究结果尚不一致[23-24]。一项荟萃分析表明,AFCAPS 研究、CARDS 研究、4D 研究、LIPID 研究均显示,他汀可降低Lp(a)水平(降幅分别为1%、13%、6%、7%),但JUPITER 研究、MIRACL 研究及4S 研究却显示,他汀反而增加Lp(a)水平(增幅分别为2%、9%、15%)[25]。一项对我国1 369 例经他汀治疗的冠心病患者数据进行的分析显示,他汀长期(中位677 d)治疗较短期(中位39 d)或中期(中位219 d)治疗可显著降低冠心病患者的Lp(a)水平,但治疗效果受到传统危险因素如原发性高血压、糖尿病、LDL-C水平等影响[26]。一项回顾性分析纳入行PCI 的ACS患者154 例,结果显示,瑞舒伐他汀和阿托伐他汀均可明显降低血清Lp(a)水平[27]。但近期发表的一项荟萃分析证实,他汀较安慰剂显著升高Lp(a)水平,需关注Lp(a)水平升高相关的心血管风险[28]。
2.2 依折麦布
依折麦布为胆固醇吸收抑制剂,通过抑制肠道对胆固醇的吸收,减少运输至肝脏的胆固醇。依折麦布与他汀联用可产生良好的协同作用。我国一项前瞻性、随机研究表明,非ST 段抬高型ACS 患者PCI 后24 h 内进行降脂治疗,依折麦布联合瑞舒伐他汀治疗组第12 周LDL-C 水平达标(<1.8 mmol/L)率显著高于中、高剂量瑞舒伐他汀组,且药物相关不良事件发生率不增加[29]。IMPROVE-IT 研究显示,依折麦布联合辛伐他汀可使ACS 患者心血管事件的绝对发生风险进一步降低2.0%[13]。但对于Lp(a)水平的影响,依折麦布作用似乎并不明显。一项纳入10 项随机、安慰剂对照临床试验的荟萃分析显示,依折麦布单药或联用他汀均未对Lp(a)水平无明显影响[30]。
2.3 PCSK9 抑制剂
PCSK9 抑制剂通过特异性结合PCSK9,阻断PCSK9 与LDL 受体结合,从而清除LDL-C,降低血液中LDL-C 水平[31-32];其净临床效果包括:可将血清LDL-C 水平至少降低45%~60%,甘油三酯水平降低10%~15%,Lp(a) 水平降低25%~30%,高密度脂蛋白胆固醇(HDL-C)水平升高5%~10%[32]。一项随机对照研究证实,PCSK9 抑制剂联合他汀治疗时,治疗前后LDL-C 及Lp(a)水平的差值均较阿托伐他汀单独治疗明显增加,即PCSK9 抑制剂可有效降低极高危ASCVD 患者的血脂水平[33]。全球BERSON 研究中国亚组分析表明,2 型糖尿病合并高脂血症患者在阿托伐他汀20 mg/d 治疗基础上,PCSK9 抑制剂(依洛尤单抗)140 mg 每两周给药一次,治疗12 周时LDL-C 水平降低85%,Lp(a)水平降低50%[34]。该研究证实,他汀联合PCSK9 抑制剂可显著提高中国糖尿病合并高脂血症的ASCVD 患者的LDL-C 达标率。全球范围内获批上市的PCSK9抑制剂有阿利西尤单抗、依洛尤单抗,其抗心血管事件预防适应证获批分别基于ODYSSEY Outcomes、FOURIER 两项心血管结局研究。相较于FOURIER研究,ODYSSEY Outcomes 研究纳入的患者心血管风险更高(后者纳入的患者为ACS 患者,前者纳入ASCVD 患者且多数为稳定性冠心病患者)。在ACS 患者中,阿利西尤单抗的循证医学证据更强。ODYEESY Outcomes 研究提示,他汀联合PCSK9 抑制剂持续使用至少4 个月,LDL-C 水平持续稳定降低至少50%,使用1 年以上时,心血管不良事件发生风险呈下降趋势。评估阿利西尤单抗及依洛尤单抗疗效及安全性的一项荟萃分析显示,相较于安慰剂对照组(基于随机效应模型估计),阿利西尤单抗治疗组(而非依洛尤单抗治疗组)与全因死亡率下降相关(0.81/100 人年 vs.1.01/100 人年,P=0.008),即便该分析剔除ODYSSEY Outcomes 研究,仍可见阿利西尤单抗治疗与全因死亡率下降相关的趋势(0.37/100 人年 vs.0.68/100 人年,P=0.06)[35]。
2.4 其他降脂药物
非他汀类降脂药物包括:降低LDL-C 的其他药物,如胆酸螯合剂;降低甘油三酯的药物,如贝特类、烟酸类药物;其他降脂药,如ω-3 脂肪酸等。此外,对于合并有家族性高胆固醇血症等特殊情况的ACS 患者,常需多种药物联合治疗才能使LDL-C 达标。
3 ACS 患者血脂管理临床路径
ACS 合并高风险因素患者急需进行强化血脂管理,故本共识仅就该类患者制定了血脂管理路径(图1);对于未合并高风险因素的患者,其血脂管理路径可参考本路径,并依据降脂靶目标值进行修改。

图1 ACS 合并高风险因素患者的血脂管理临床路径
推 荐
(1)ACS 合并高风险因素患者的血脂管理流程
①对于ACS 合并高风险因素患者,降脂目标是LDL-C 水平<1.4 mmol/L(55 mg/dl),且较基线水平降幅≥50%。②ACS 合并高风险因素患者:入院时LDL-C 水平<1.4 mmol/L(55 mg/dl),若入院前规律服用他汀(4 周及以上),建议加强饮食等生活方式干预,同时根据实际情况调整用药;若未规律服用他汀,建议给予他汀治疗。LDL-C 水平在1.4 mmol/L(55 mg/dl)~2.6 mmol/L(100 mg/dl)范围者,若入院前规律服用他汀,建议联用其他降脂药物(如依折麦布或PCSK9 抑制剂);若未规律服用他汀,则给予他汀单药治疗。LDL-C 水平>2.6 mmol/L(100 mg/dl)者,建议他汀单药或者他汀联合非他汀类降脂药物[依折麦布和(或)PCSK9 抑制剂]。患者教育见附录1。
(2)ACS 未合并高风险因素患者的血脂管理流程
①对于ACS 未合并高风险因素患者,降脂目标是LDL-C 水平<1.8 mmol/L(70 mg/dl),且较基线水平降幅≥50%。②ACS 未合并高风险因素患者:入院时LDL-C 水平<1.8 mmol/L(70 mg/dl),若入院前规律服用他汀(4 周及以上),建议加强饮食等生活方式干预,同时根据实际情况调整用药;若未规律服用他汀,建议给予他汀治疗。LDL-C 水平在1.8 mmol/L(70 mg/dl)~3.4 mmol/L(130 mg/dl)范围者,若入院前规律服用他汀,建议联用其他降脂药物(如依折麦布或PCSK9 抑制剂);若未规律服用他汀,则给予他汀单药治疗。LDL-C 水平>3.4 mmol/L(130 mg/dl)者,建议他汀单药或者他汀联合非他汀类降脂药物[依折麦布和(或)PCSK9 抑制剂]。
(3)他汀不耐受患者的血脂管理
①他汀不耐受需符合以下标准:不能耐受至少两种他汀,其中一种为每日使用最低起始剂量的他汀,另一种为任何剂量的他汀;他汀治疗后出现不适或实验室检测异常结果;他汀相关不良反应是可逆的,减少剂量或停用症状得到缓解或改善,再次用药又可出现[37-38]。②对于他汀不耐受患者,推荐直接启用非他汀类降脂药物。
(4)常用降脂药物的选择
①一般推荐中等强度他汀为我国ACS 患者血脂管理的常用给药强度,他汀剂量翻倍只能带来LDL-C 水平额外6%的降幅,且较高加索人群会发生更多的不良反应;他汀治疗强度以及LDL-C 水平降幅见附表1、2。②对于联合用药患者,应当密切关注其用药安全性问题,随访时常规监测肝酶、肌酶升高的情况。③对于PCSK9 抑制剂,推荐阿利西尤单抗或依洛尤单抗。④对于合并甘油三酯升高患者,推荐使用贝特类、烟酸类药物或者ω-3 脂肪酸药物来降低甘油三酯水平。⑤对于Lp(a)水平升高[≥30 mg/dl(75.0 nmol/L)]且LDL-C 水平≥1.8 mmol/L(70 mg/dl)的患者,已规律使用他汀仍未达标,可优先联用PCSK9 抑制剂治疗。
(5)用药调整和治疗时长
①当调整降脂药物种类或剂量时,都应在治疗4~6 周内复查血脂水平,并依据达标情况再次调整治疗方案;如LDL-C 水平<0.4 mmol/L(<15 mg/dl),应依据实际情况调整用药,并且密切关注血脂变化情况。考虑到患者LDL-C 水平需长期达标,为避免降脂效果反弹,应根据各种药物对LDL-C 水平的降低幅度来考虑停药顺序。②降脂以及预防心血管事件再发需长期持续用药。现有证据表明,患者发生ACS 事件后,长期将LDL-C 水平控制在靶目标以下,可以带来显著的心血管获益。③ACS 患者出院后,建议每隔4~6 周随访1 次;此后,若无特殊情况且血脂达标,可改为每6~12 个月随访1 次。随访检查项目主要包括血脂、肝功能、肌酸激酶等。
执笔者:张峰(复旦大学附属中山医院),金琴花(中国人民解放军总医院)
专家组成员(按姓氏笔画排序):卜军(上海交通大学医学院附属仁济医院),马根山(东南大学附属中大医院),王建安(浙江大学医学院附属第二医院),孔祥清(江苏省人民医院),付乃宽(天津市胸科医院),丛洪良(天津市胸科医院),向定成(中国人民解放军南部战区总医院),刘健(北京大学人民医院),杜志民(中山大学附属第一医院),李怡(中山大学附属第一医院),李晓东(中国医科大学附属盛京医院),杨杰孚(北京医院),杨清(天津医科大学总医院),杨新春(首都医科大学附属北京朝阳医院),何奔(上海交通大学附属胸科医院),宋现涛(首都医科大学附属北京安贞医院),张大庆(中国医科大学附属盛京医院),张峰(复旦大学附属中山医院),陈纪言(广东省人民医院),陈桢玥(上海交通大学医学院附属瑞金医院),陈韵岱(中国人民解放军总医院),林文华(泰达国际心血管病医院),金琴花(中国人民解放军总医院),周玉杰(首都医科大学附属北京安贞医院),郑金刚(中日友好医院),侯玉清(南方医科大学南方医院),姚启恒(中国香港大学深圳医院),钱菊英(复旦大学附属中山医院),徐亚伟(上海市第十人民医院),徐标(南京大学医学院附属鼓楼医院),高炜(北京大学第三医院),黄榕翀(首都医科大学附属北京友谊医院),彭道泉(中南大学湘雅二医院),葛均波(复旦大学附属中山医院),蒋峻(浙江大学医学院附属第二医院),韩冰(徐州市第四人民医院),傅国胜(浙江大学医学院附属邵逸夫医院),霍勇(北京大学第一医院)
利益冲突:本共识修订期间,赛诺菲(中国)投资有限公司支持了修订工作会议,但不参与或影响本共识学术内容及证据评估,共识保持独立性
附录1 患者教育
对ACS 患者长期血脂管理认知不足是导致其血脂达标率低、治疗依从性差的主要原因,对患者和(或)陪护人员进行健康教育并且协助患者改变不良的生活行为、做好二级预防尤为必要。患者教育以及基于循证医学的心脏康复应贯穿整个治疗过程,可定期或根据需要进行个体化安排,有针对性地解决问题。
院内康复期:入院时是进行患者教育的最佳时期,使患者对所患疾病有充分认识,减轻其恐慌心理,并强调控制危险因素的重要性。其次,对中、高危患者进行标识,评估冠心病危险因素,制定相应的干预计划。组织开展院内患者教育会,让患者和(或)陪护人员了解患者所患疾病的严重程度及预后情况,尤其是快速地、较大幅度地降低LDL-C 水平的临床意义,以提高其自我管理意识及积极性。治疗前介绍各降脂药物,在患者经济条件允许的情况下,可建议初始选用他汀联合PCSK9 抑制剂治疗,尤其是需行PCI 及合并家族性高胆固醇血症、糖尿病、冠状动脉多支病变或既往有心血管病史的高危ACS 患者。
出院时:进行积极心理教育,告知患者需积极控制危险因素。可结合数字化平台对患者进行随访登记,制定随访计划,并告知复诊时间。使用降脂药物的患者,告知降脂药物长期使用的必要性及坚持治疗的重要性;告知降脂药物的用法、剂量、不良反应及用药注意事项等。对使用PCSK9 抑制剂的患者,可帮助指导注射方法,告知患者注射相关注意事项,提醒患者规律注射时间。
院外康复期:告知随访目的在于及时知晓疾病控制情况,强调生活方式改变血脂干预的基础。为预防再发心血管事件而合理制定降脂策略。每隔4~6 周随访1 次;此后,若无特殊情况且血脂达标,可改为每6~12 个月随访1 次;1 年后,每年随访1次。随访项目主要包括血脂、肝功能、肌酸激酶等。依据患者血脂达标情况,对调整治疗方案进行必要的解释,尤其对于经中等强度他汀治疗LDL-C 水平仍未达标者,在其经济条件允许时可建议联用PCSK9 抑制剂。调整降脂药种类或剂量时,都应在治疗4~6 周内复查,并再次依据达标情况调整治疗方案。加强患者及家属心理教育,以提高长期用药依从性。

附表1 不同降脂策略的LDL-C 水平降幅[6,20]

附表2 不同强度的他汀类药物治疗[6]
