铁基蒙脱土异相光助芬顿催化降解活性黑5的性能研究❋
2020-11-04张科旭马启敏李世迁
张科旭, 李 瑾,2❋❋, 钟 莲, 马启敏,2, 李世迁
(1. 中国海洋大学环境科学与工程学院, 山东 青岛 266100; 2. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100; 3. 中国海洋大学化学化工学院, 山东 青岛 266100; 4. 福建师范大学福清分校海洋与生化工程学院, 福建 福清 350300)
偶氮染料由于其化学结构稳定、生产过程简单、成本低,在纺织、印染、皮革、造纸等行业得到了广泛应用。据估计,全球染料年产量超过7×105t[1-2],其中,偶氮染料的使用量已达染料总量的70%左右[3]。在偶氮染料的生产和使用过程中均会产生大量组分复杂、色度高、有机物含量高、生物毒性大的废水,其处理难度非常高。
目前,常用的偶氮染料废水的处理技术有物理法、生物法和化学法[4-5]。物理法只能进行染料的相转移,不能真正去除;生物法占地面积大、效率低、操作灵活性低,处理高浓度偶氮染料废水效果欠佳。化学法中的芬顿氧化法由于具有工艺简单、成本相对低、效率高等优势,是处理偶氮染料废水的有效方法之一。但传统芬顿技术存在适用pH范围窄(仅在pH为 2.5~3.5效果良好),H2O2利用率低,Fe(II)难以重复利用,pH>4时即会产生大量的含铁污泥,造成二次污染等问题。异相光助芬顿技术是近年来发展起来的一项高级氧化技术,含铁化合物被固定在载体上,芬顿氧化反应主要发生在固-液界面上,催化剂中的含铁化合物不会或极少会流失,克服了均相芬顿反应过程中产生大量含铁污泥的缺点,还具有催化剂易回收、H2O2消耗少、操作简单的优点[6-7]。更重要的是,将光引入到芬顿体系中,可以很大程度上提高其氧化效率[8-10],有望成为一种经济、高效的偶氮染料废水处理技术。
蒙脱土廉价易得,具有独特的二维层状结构和良好的离子交换能力,是理想的催化剂载体。铁离子与蒙脱土片层间的Ca(II)、Mg(II)和Na(I)交换后制备的铁基蒙脱土有望具有比表面积大、稳定性好、光助芬顿催化活性高的优势。本文通过离子交换法制备了铁基蒙脱土(Fe-MMT),采用红外光谱和X-射线衍射对不同铁离子含量的Fe-MMT结构进行了表征。在氙灯模拟的太阳光下照射,分别考察了以Fe-MMT为催化剂构建的光助芬顿体系对活性黑5染料的脱色性能和苯环降解性能的影响。探讨了异相光助芬顿体系中活性黑5染料脱色反应和苯环降解反应的动力学过程,为其在染料废水中的应用提供理论依据。
1 材料与方法
1.1 试剂与仪器
试剂:钠基蒙脱土(MMT,浙江三鼎科技有限公司,过200目筛,离子交换容量(CEC)为1.0 mmol/g);活性黑5染料(RB5,青岛双桃精细化工有限公司);其他试剂均为分析纯。
仪器:UV-2100P 紫外可见分光光度计,Tensor 27傅立叶变换红外光谱仪,D8 Advance X射线衍射仪,YM-GHX-V光催化反应仪。
1.2 实验方法
1.2.1 铁基蒙脱土的制备 铁基蒙脱土的制备参考文献[11-12]进行:取5 g MMT加入到200 mL的去离子水中,30 ℃水浴搅拌2 h,使其充分溶胀。分别称取对应于0.5、1.0、1.5和2.0倍CEC的FeCl3·6H2O溶于100 mL去离子水中。将上述FeCl3溶液缓慢滴加到MMT悬浮液中,搅拌6 h,老化过夜。产物离心分离,充分洗涤至离心液中不含Cl-(AgNO3溶液检验),60 ℃干燥、研磨、过200目筛,分别标记为Fe-MMT1,Fe-MMT2,Fe-MMT3和Fe-MMT4。
1.2.2 表征 红外光谱采用KBr压片,用Tensor 27傅立叶变换红外光谱仪记录,扫描范围4 000~500 cm-1。
X射线衍射(XRD)分析用D8 Advance X射线衍射仪记录,CuKα为射线源,管电流500 mA,管电压40 kV,扫描范围(2θ)为5°~70°,扫描步长为0.02°。
1.2.3 光催化反应实验 在石英试管中,称取一定量的Fe-MMT催化剂分散于50 mL一定浓度和pH的RB5溶液中,于光催化反应仪中避光搅拌15 min。加入一定量的H2O2,开启光源,以1 000 W氙灯为光源模拟太阳光,保持磁力搅拌,每隔一定时间取样,离心分离,取上清液,分别在255和598 nm波长[13]处测量其吸光度值。
RB5的脱色率依其在598 nm处的吸光度值计算:
Decolorization (%) = (1-At1/A01)×100。
(1)
RB5的苯环降解率依其在255处的吸光度值计算:
Degradation (%) = (1-At2/A02)×100。
(2)
式中:A01和A02分别为催化降解反应前RB5在598和255 nm处的吸光度值;At1和At2分别为反应t时刻RB5在598和255 nm处的吸光度值。
1.2.4 反应动力学 用Langmuir-Hinshelwood(L-H)动力学方程来描述RB5的催化反应动力学:
准一级动力学方程:ln (C0/C) =k1t,
(3)
准二级动力学方程:1/C-1/C0=k2t。
(4)
式中:k1和k2分别为准一级和准二级反应速率常数,min-1;t为反应时间,min;C0和C分别为RB5的初始浓度和反应t时刻的浓度,mg/L。
2 结果与讨论
2.1 催化剂表面官能团和晶型结构表征
图1为蒙脱土(MMT)和铁基蒙脱土(Fe-MMT)的FT-IR光谱图。MMT在3 632.8和3 449.0 cm-1处的吸收峰分别归属为Al-OH和层间结晶水的伸缩振动及吸附水的弯曲振动[14], 1 635.0 cm-1处的吸收峰归属为-OH的变形振动[15],1 039.5 和462.8 cm-1处的吸收峰分别归属为蒙脱土平面层结构的Si-O-Si的伸缩振动和夹层结构的Si-O变形振动[16]。与MMT相比, Fe-MMT1中Al-OH的伸缩振动和层间结晶水的弯曲振动峰分别位移至3 626.4和1 641.3 cm-1,平面层结构的Si-O-Si的伸缩振动和夹层结构的Si-O变形振动也分别位移至1 038.5 和458.8 cm-1,表明Fe(III)被成功交换进入蒙脱土的片层中[11]。不同Fe(III)含量的Fe-MMT的红外光谱图无明显差异。

图1 蒙脱土(MMT)和铁基蒙脱土催化剂(Fe-MMT)的FT-IR图Fig. 1 FT-IR spectra of MMT and Fe-MMT
图2为MMT,Fe-MMT1和Fe-MMT2的XRD图谱。如图所示,MMT的特征衍射峰出现在2θ=7.00°处,根据Bragg方程计算其层间距为1.26 nm。Fe-MMT1的特征衍射峰出现在5.87°,对应层间距为1.51 nm。蒙脱土层间距的大小由溶液中阳离子的水合半径、阳离子吸引晶层的能力和阳离子浓度共同决定[17]。由于Fe(III)水合半径(约为4.57 Å)比Na(I)水合半径(约为3.68 Å)大[18],在晶层间占据了较大空间而导致Fe-MMT1的层间距比MMT大,也证明了Fe(III)的成功引入[19]。随着Fe(III)含量的增加,Fe-MMT2的特征衍射峰出现在6.30°,对应层间距为1.41 nm。这可能是因为Fe(III)含量增高时,与晶层的静电作用增大,导致层间距减小[17]。X射线衍射分析结果表明,在MMT片层间成功引入了Fe(III),且保持了蒙脱土的片层结构。
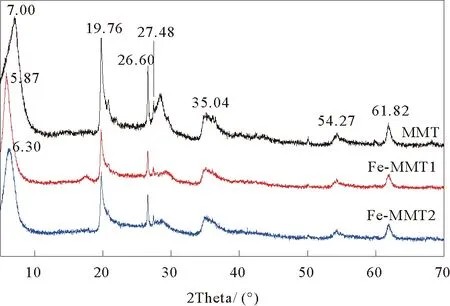
图2 蒙脱土MMT、铁基蒙脱土Fe-MMT1和Fe-MMT2的XRD图Fig. 2 XRD pattern of MMT, Fe-MMT1 and Fe-MMT2
2.2 反应条件对活性黑5降解效果的影响
2.2.1 不同反应体系降解活性黑5的效果 为了探索异相光助芬顿反应体系催化降解活性黑5的效果,在Fe-MMT2投加量为0.02 g,染料初始浓度为100 mg/L,pH为3的实验条件下,构建了包括光照、催化剂、H2O2、催化剂+光照、H2O2+光照、催化剂+H2O2及催化剂+H2O2+光照7类反应体系,考察了不同反应体系中活性黑5的脱色和苯环降解效果,结果如图3所示。
如图3(a)所示,反应进行240 min后,光照体系中RB5的脱色率为0。催化剂体系中RB5的脱色率为2.8%,表明催化剂对RB5的吸附十分有限。在H2O2的反应体系中,RB5的脱色率9.1%,H2O2在黑暗条件下无法产生羟基自由基,不能使RB5有效脱色。催化剂+光照体系中,RB5的脱色率10.2%,表明催化剂的光催化降解RB5能力有限。H2O2+光照体系中,RB5的脱色率为47.3%,表明H2O2受紫外光激发后产生的HO·可使得RB5脱色。在催化剂+H2O2的芬顿体系中,反应进行210 min后RB5的脱色率可达98.6%。催化剂+H2O2+光照体系中,RB5溶液在反应进行的前30 min内快速脱色,脱色过程如图3(c)所示,反应进行90 min 后RB5的脱色率即达98.9%。结果表明,在所构建的7个反应体系中,催化剂+H2O2+光照体系中RB5的脱色率最高,且脱色反应进行得最快。
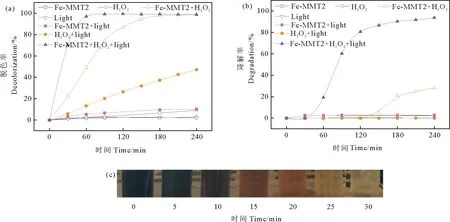
图3 不同反应体系中RB5(a)脱色率、(b)苯环降解率及(c)在Fe-MMT2+H2O2+光照体系中,反应前30min内RB5的溶液的颜色照片Fig. 3 (a)Decolorization, (b) degradation rate of RB5 in different reaction systems and (c)photo of RB5 solution for the first 30 min in Fe-MMT2+ H2O2 + light system
如图3(b)所示,在光照、催化剂、H2O2和催化剂+光照这4类反应体系中,RB5的苯环去除率均小于2.5%。在H2O2+光照体系中,虽然RB5的脱色率可达47.3%(见图3(a)),但仍无法实现苯环的降解。在催化剂+H2O2的芬顿体系中,苯环的降解反应从反应进行150 min后开始,反应240 min后,苯环降解率为28.2%,表明此体系可以实现RB5的快速高效脱色,但苯环降解率有限,无法实现RB5的完全矿化。催化剂+H2O2+光照体系中,苯环的降解在反应进行30 min后开始,反应240 min后,苯环降解率可达93.6%。由此可见,催化剂+H2O2+光照的光助芬顿体系在7类反应体系中对RB5的脱色率和苯环降解率均最高,表明催化剂、H2O2和光照具有协同作用,显著提高了对活性黑5的催化降解效果。
2.2.2 催化剂对活性黑5降解效果的影响 在催化剂投加量为0.02 g,RB5初始浓度为100 mg/L,pH为3,H2O2浓度为2 mmol/L的条件下,考察不同催化剂对RB5脱色率和苯环降解率的影响,结果如图4所示。由图4(a)可知,反应进行120 min后,4种催化剂构建的异相光助芬顿体系对RB5的脱色率均大于99%。在由催化剂Fe-MMT2-4构建的体系中,反应进行到60 min时,RB5的脱色率已达到最大,不再随反应时间的延长而增大,且不同催化剂构建的体系间RB5的脱色率没有明显差别;而由催化剂Fe-MMT1构建的体系中,反应进行到120 min时,RB5的脱色率才达到最大。如图4(b)所示,在催化剂Fe-MMT2-4构建的体系中,反应进行120 min时,RB5的苯环降解率可达80%,随后苯环降解率缓慢增加至约85%。而由催化剂Fe-MMT1构建的体系中,在相同的反应时间内,RB5的苯环降解率较低,而反应进行到210 min时,仍能达到85%。结果表明,催化剂中Fe(III)的含量由0.5倍CEC提高至1.0倍CEC时,明显提高了其对RB5的脱色率和苯环降解率,而继续提高至2.0倍CEC时,不能再明显改善其催化性能。
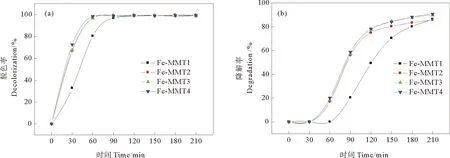
图4 不同催化剂对光助芬顿催化降解RB5(a)脱色率和(b)苯环降解率的影响Fig. 4 Effects of catalysts on (a) decolorization and (b) degradation rate of RB5 in heterogeneous photo-Fenton system

如图5(b)所示,pH为2时,苯环降解率为负值,这可能是由于RB5的结构被羟基自由基破坏,导致萘环的开环及含芳香环中间产物的生成,致使255 nm处吸光度增加[13]。pH为3时,RB5的苯环降解率在120 min时为78.3%,240 min时达91.7%。而在pH为4和5的条件下,均无法实现苯环降解。
2.2.4 H2O2浓度对活性黑5降解效果的影响 H2O2在异相光助芬顿体系中作为氧化剂,在RB5的降解过程中起着至关重要的作用。在Fe-MMT2投加量为0.02 g,RB5初始浓度为100 mg/L,pH为3的条件下,H2O2浓度对RB5降解效果的影响如图6所示。
由图6(a)可知,当H2O2浓度从1 mmol/L增加到4 mmol/L时,RB5的脱色率随之逐渐增加,而从4 mmol/L增加到6 mmol/L时,RB5的脱色率无明显差异,均达97%以上。由图6(b)所示,当H2O2浓度从1 mmol/L增加到5 mmol/L时,RB5的苯环降解率由45.5%增加至91.5%。当H2O2浓度为5 mmol/L时,RB5的苯环降解率达到最大值93.6%。当H2O2浓度继续增大至6 mmol/L时,RB5的苯环降解率反而下降至89.8%。
H2O2浓度在1~5 mmol/L内,随着H2O2浓度的增加,生成了更多的活性自由基,RB5的脱色率和苯环降解率也随之增加。继续增加H2O2的浓度,一方面,部分H2O2与HO·反应,生成HO2·,其氧化电位(1.7 eV)远低于HO·(2.8 eV);另一方面,过量OH2·会二聚形成H2O2,降低了RB5的脱色率和苯环降解率[24]。从经济性和降解效率两方面考虑,选用2 mmol/L作为最佳H2O2浓度。
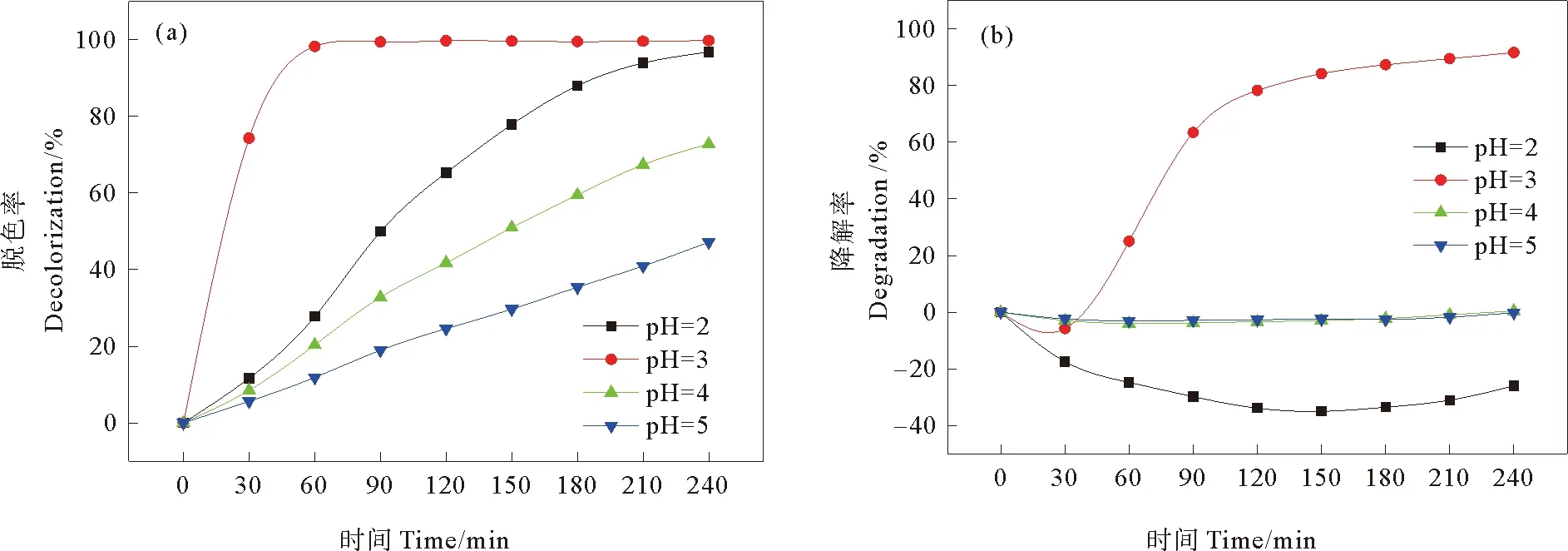
图5 pH对光助芬顿催化降解RB5(a)脱色率和(b)苯环降解率的影响Fig. 5 Effects of pH on (a) decolorization and (b) degradation rate of RB5 in heterogeneous photo-Fenton system
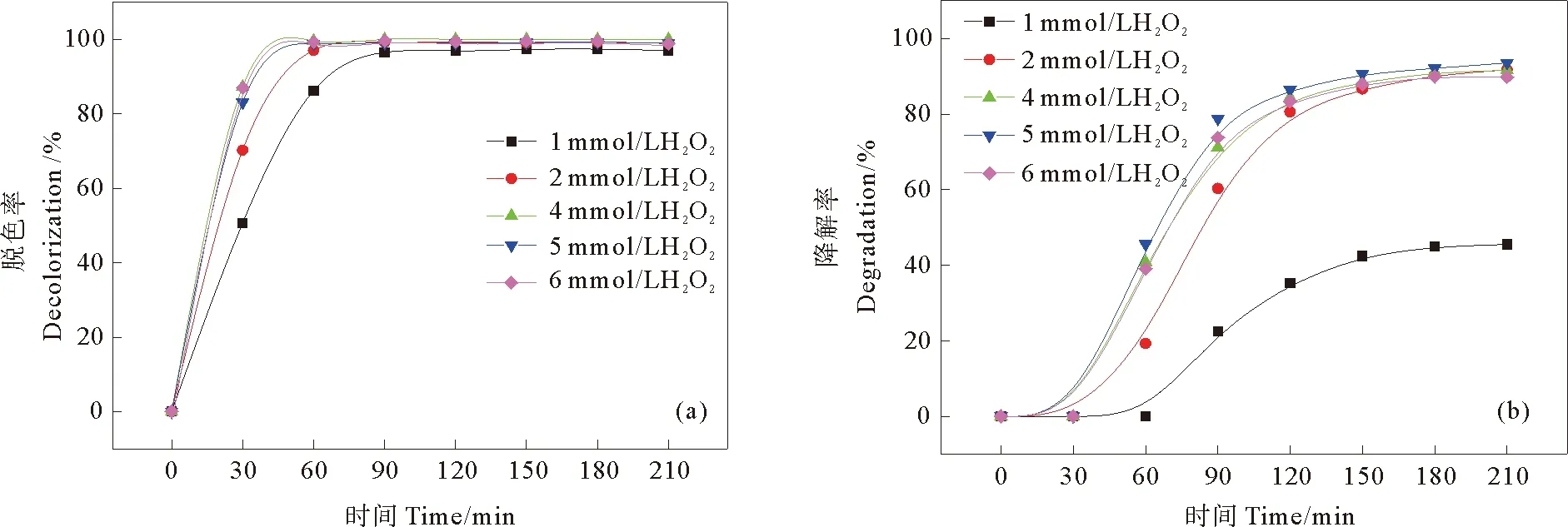
图6 H2O2浓度对光助芬顿催化降解RB5(a)脱色率和(b)苯环降解率的影响Fig. 6 Effects of H2O2 concentration on (a) decolorization and (b) degradation rate of RB5 in heterogeneous photo-Fenton system
2.2.5 催化剂投加量对活性黑5降解效果的影响 在RB5初始浓度为100 mg/L,pH为3,H2O2浓度为2 mmol/L的条件下,Fe-MMT2投加量对RB5降解效果的影响如图7所示。由图7(a)可知,催化剂投加量在0.005~0.04 g范围内时,在反应的前90 min里,RB5的脱色率随催化剂投加量的增加而不断升高,反应进行到120 min时,脱色率均达99%以上。继续增加催化剂的投加量至0.06 g,RB5的脱色率不再提高。由图7(b)可知,RB5的苯环降解率随着催化剂投加量的增加呈先升高再下降的变化趋势。催化剂投加量在0.005~0.04 g范围内时, RB5的苯环降解率随催化剂投加量的增加而增加。继续增加催化剂的投加量至0.06 g,苯环降解率下降至86.2%。
当催化剂投加量较少时,光生电子和空穴生成的数量较少,高活性的HO·数量也较少,催化活性较低;催化剂投加量不断增加时,增加了活性点位,产生的HO·数量也进一步增加,RB5的脱色率和苯环降解率均随之增加;但当催化剂投加量过大时,会导致溶液浑浊度增大,对光产生明显的反射和散射作用[25],导致光的利用率降低,降低了RB5的降解能力。
2.2.6 活性黑5初始浓度对其降解效果的影响 在Fe-MMT2投加量为0.02 g,pH为3,H2O2浓度为2 mmol/L的条件下,RB5初始浓度对其降解效果的影响如图8所示。随着RB5初始浓度的升高,RB5的脱色速率和苯环去除速率逐渐降低。由图8(a)可知,在RB5初始浓度的研究范围内,反应进行120 min后,脱色率均达98%以上。如图8(b)所示,RB5初始浓度为50~100 mg/L时,反应进行240 min后,苯环降解率均达90%以上。而RB5初始浓度为150 mg/L时,苯环降解率降至71.2%。RB5初始浓度较低(≤100 mg/L)时,体系中的H2O2充足,能产生足够的HO·,反应时间足够时,不同初始浓度RB5的脱色率和苯环降解率基本一致。RB5的初始浓度增加至150 mg/L时,降解有机物的量增加,而HO·的生成速率恒定[26],体系中的HO·能够破坏掉全部显色基团,却不足以破坏所有的苯环,导致苯环降解率大大下降。
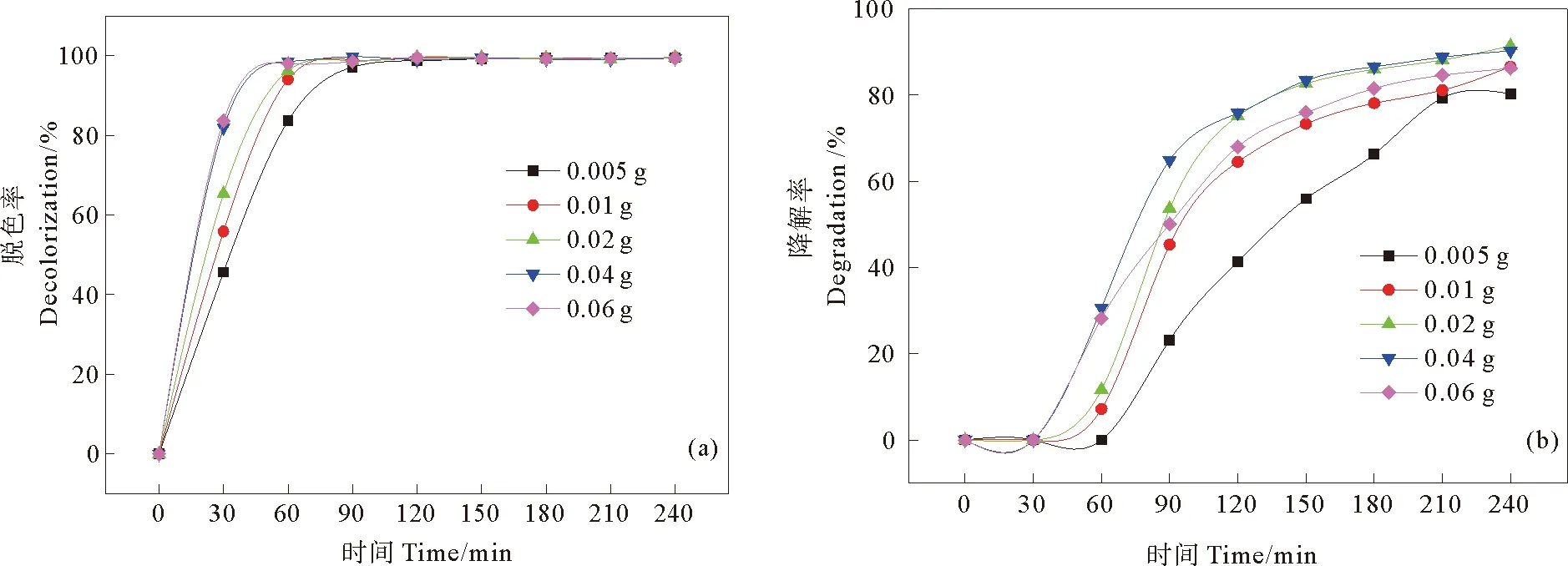
图7 催化剂投加量对光助芬顿催化降解RB5(a)脱色率和(b)苯环降解率的影响Fig. 7 Effects of catalyst dosage on (a) decolorization and (b) degradation rate of RB5 in heterogeneous photo-Fenton system

图8 RB5初始浓度对光助芬顿催化降解RB5(a)脱色率和(b)苯环降解率的影响Fig. 8 Effects of initial RB5 concentration on (a) decolorization and (b) degradation rate of RB5 in heterogeneous photo-Fenton system
2.3 活性黑5的脱色和苯环降解过程动力学研究
研究表明,准一级速率模型[27-29]和准二级速率模型[30]可以用来模拟芬顿法和类芬顿法对大多数染料的去除动力学。不同反应条件下异相光助芬顿降解RB5的速率常数及其决定系数列于表1中。如表1所示,在不同的实验条件下,对于脱色过程,准一级动力学方程的决定系数均大于相同条件下准二级动力学方程的决定系数,说明准一级动力学方程能更好地描述异相光助芬顿催化RB5的脱色过程。对于RB5的苯环降解过程,准二级动力学方程的决定系数大于相同条件下准一级动力学方程的决定系数,表明准二级动力学方程能更好地描述异相光助芬顿催化RB5的苯环降解过程。
2.4 催化剂重复使用对RB5脱色和苯环降解效果的影响
称取0.02 g Fe-MMT2加入pH为3,H2O2浓度为2 mmol/L,初始浓度为100 mg/L的RB5溶液中,光照反应240 min后,将溶液离心分离出催化剂,多次洗涤后,继续用于光催化反应,探究催化剂的重复使用对RB5脱色和苯环降解效果的影响。催化剂第1次使用时,RB5的脱色率和苯环降解率分别为99.8%和91.4%,重复使用4次后,RB5的脱色率仍可达99.8%,苯环降解率降低至87.6%。结果表明,催化剂多次使用后仍具有较高的催化活性,表现了良好的可重复使用性。
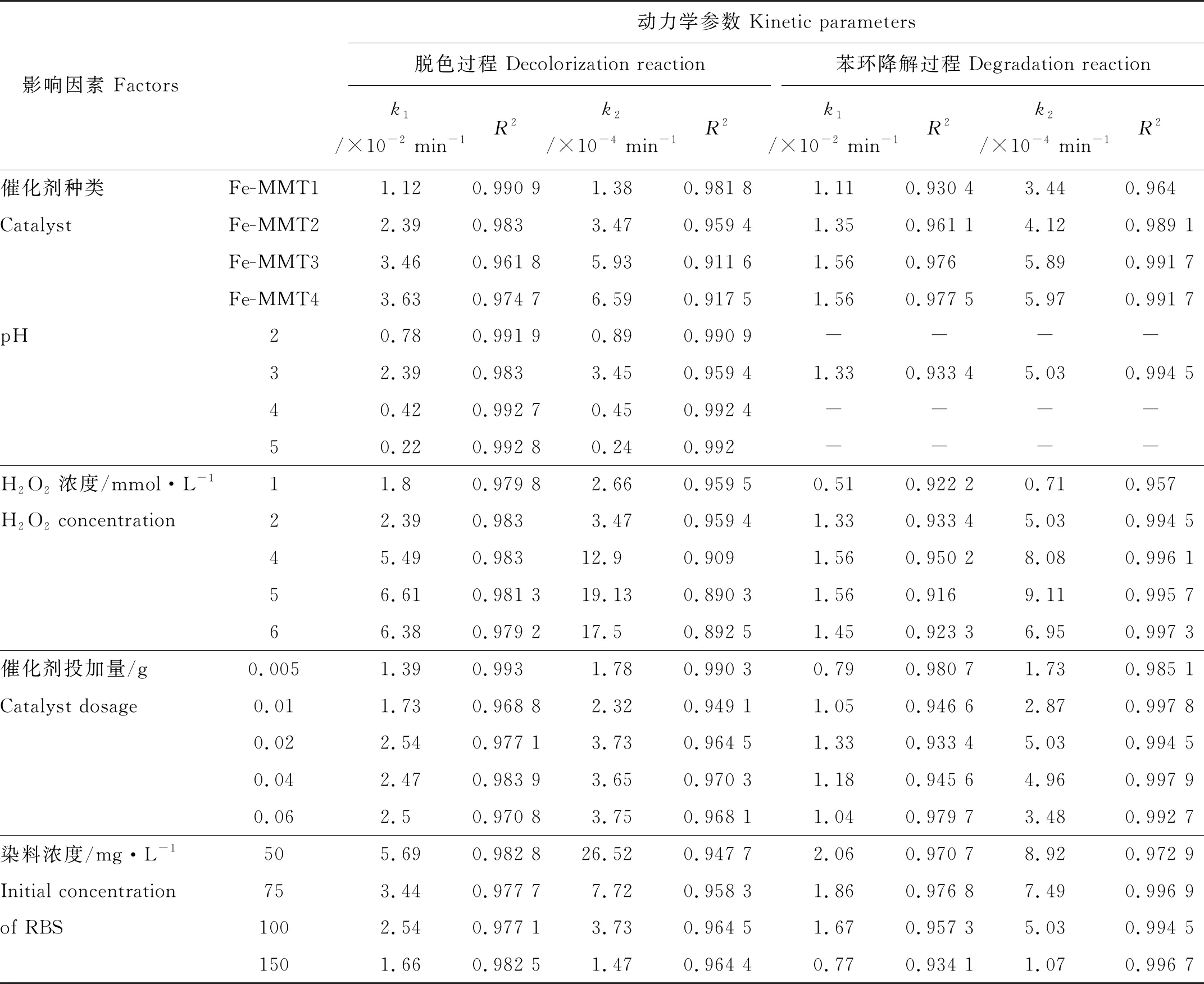
表1 RB5脱色和降解动力学模型参数及决定系数Table 1 Kinetic model and kinetic parameters for RB5 decolorization and degradation

图9 催化剂重复使用对RB5的脱色和苯环降解效果的影响Fig. 9 Effect of treatment times on the decolorization and degradation rate of catalyst
3 结论
(1) 在以Fe-MMT为催化剂构建的芬顿体系中引入光照,明显提高了对RB5的脱色和苯环降解性能。
(2) 准一级动力学模型对RB5脱色过程的拟合效果更好,准二级动力学模型对RB5苯环降解过程的拟合效果更好。
(3) 催化剂在重复使用4次后,RB5的脱色率仍为99.8%,苯环降解率为87.6%,表明催化剂具有良好的重复使用性能。
