上尿路尿路上皮癌中程序性死亡配体1的表达及其预后意义
2020-11-03孙尧荣陈辉颜辉辉林丽
孙尧荣,陈辉,颜辉辉,林丽
(台州市中西医结合医院,浙江 台州 317500,1.泌尿外科;2.护理部)
上尿路尿路上皮癌(upper tract urothelial carcinoma,UTUC)是一种不常见但具有侵袭性的疾病[1],占所有尿路上皮癌的5%~10%[2],高达60%的病例在诊断时具有侵袭性。尽管UTUC与膀胱尿路上皮癌具有许多相似之处,但在临床、病理和生物学特征方面存在重要差异[2]。目前对UTUC的确切治疗几乎没有变化,包括根治性肾切除术和切除壁内输尿管,但其5年的局部复发率高达50%[3]。因此,利用新的治疗方法来改善UTUC患者的生存率至关重要。免疫检查点抑制剂已被批准用于治疗膀胱尿路上皮癌,如程序性死亡配体1(programmed death ligand 1,PD-L1)已被证实对膀胱尿路上皮癌患者具有预后价值[4-6]。然而,在这些试验中,UTUC病例占比较少,本研究分析PD-L1在UTUC中的表达及其预后价值。
1 资料和方法
1.1 一般资料 选取151例2004—2014年间台州市中西医结合医院接受根治性肾输尿管切除术(radical nephroureterectomy,RNU)的UTUC患者肿瘤组织样本进行研究,排除标准:接受过新辅助、辅助化放疗的患者;不合适的中性甲醛固定-石蜡包埋(formalin fixation-paraffin embedding,FFPE)的组织;临床病理数据或随访、预后数据不充分的患者。所有标本的使用均事先由患者或其授权委托人签署知情同意书。本研究获得医院伦理委员会的批准。
1.2 组织芯片构建 将FFPE组织切片用HE染色,通过染色切片确定肿瘤组织学特征、病变分级和肿瘤分期。从每个病例组织样本蜡块中采集3个1 mm大小的组织样本,分别填入配体蜡块上随机安排的独立位点中构建组织芯片。将组织芯片切成4 μm厚的切片并在免疫组织化学(immunohistochemistry,IHC)染色前用HE染色确认肿瘤的存在、肿瘤组织学特征以及其他病理参数。根据2010年美国癌症联合委员会TNM分期标准对肿瘤进行分期[7],肿瘤出现膀胱外转移被定义为肿瘤3期或高于3期。
1.3 IHC染色和评估 采用PD-L1兔单克隆抗体(SP142)进行标准IHC染色。将FFPE组织蜡块切成 4 μm厚的的切片并置于65 ℃下进行烤蜡,脱蜡,再水化并放入pH 9.0的EDTA缓冲溶液中进行高温修复抗原20 min。将修复完成的切片与一抗在室温下孵育30 min。使用全自动免疫组化仪Ventana Benchmark XT进行IHC Polymer Conjugate法染色。采用半定量评分对PD-L1阳性表达的肿瘤细胞和免疫细胞数量百分比进行评估。根据细胞形态学将PD-L1表达阳性的肿瘤细胞与浸润的巨噬细胞和炎症细胞区分开来。通过将分析限制在芯片的中心部分而排除组织边缘的非特异性染色误区。每例样本随机选取10个高倍视野下的PD-L1阳性表达的肿瘤和免疫细胞进行计数并计算平均阳性率,计算每个病例的3个平行的平均值用于数据分析。评估细胞膜/细胞质被染色的肿瘤细胞和免疫细胞数量百分比,参考文献[8],分别将1%阳性和5%阳性定义为肿瘤PD-L1阳性。本研究的结果评定由2名对临床结果不知情的尿路病理学家完成,若评定结果不同,可在统一协商后达成一致结论。
1.4 随访监测 在前6个月中每2个月对患者进行疾病进展随访,之后改为每6个月进行进展随访。一般来说,随访包括病史,体格检查和实验室检查以及按照临床指示进行血清化学评估、肝功能检查和碱性磷酸酶测量。每半年或按照临床指示进行影像诊断,如超声和(或)排泄性尿路造影以及胸部X光。由主治医师决定和(或)根据疾病进展发现每年对患者进行至少一次CT或MRI检查。对出现骨痛或血清碱性磷酸酶水平升高的患者进行骨扫描检查。
根据影像学检查,将骨盆或腹膜后淋巴结肿瘤复发以及远处转移作为疾病复发的标志。患者死因由主治医师、死亡证明确认的评估表格或仅凭死亡证明确定。临床病理学数据保存在伦理委员会批准的数据库中,有定期的数据控制和质量保证核查以确保数据的有效性和完整性。
1.5 统计学处理方法 采用SPSS24.0软件进行统计分析。计数资料比较采用χ2检验,计量资料比较采用t检验;分别用Kaplan-Meier法和log-rank检验来评估、比较生存率,末次随访结束时仍生存者按截尾值处理;采用Cox比例风险回归模型进行单因素和多因素回归分析,多因素分析中包括了对单因素分析有统计意义的变量。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象一般情况及临床特征 图1为PD-L1阴性表达和阳性表达的肿瘤细胞染色结果,将1%定义为肿瘤细胞PD-L1表达阳性率的临界值。按照患者人口统计学、临床、病理特征进行分组,以1% 阳性表达作为临界值评估各组患者肿瘤细胞中的PD-L1表达情况。肿瘤中PD-L1的阴性表达与肿瘤病理分期(P=0.039),高级病变(P=0.009)和淋巴血管侵犯的存在(P=0.004)显著相关。见表1。以5%作为阳性表达临界值,肿瘤细胞中的PD-L1表达与人口统计学、临床或病理变量均无显著相关性。
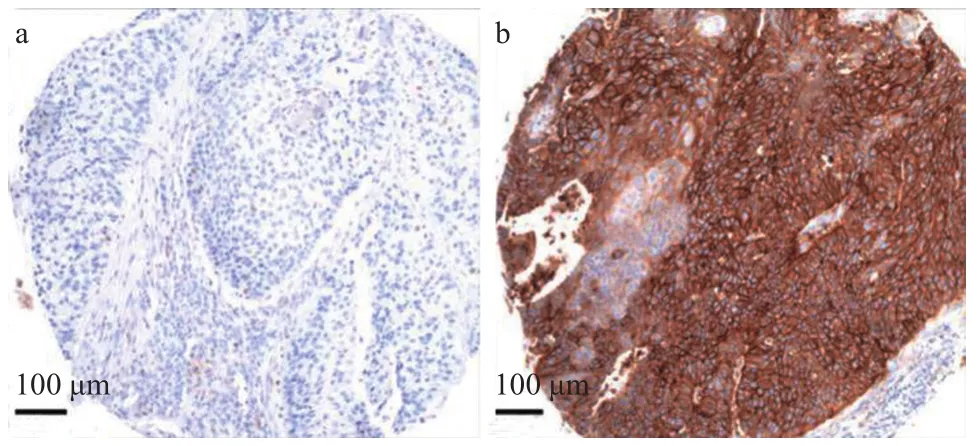
图1 肿瘤细胞PD-L1阴性(a)表达和阳性(b)表达染色结果
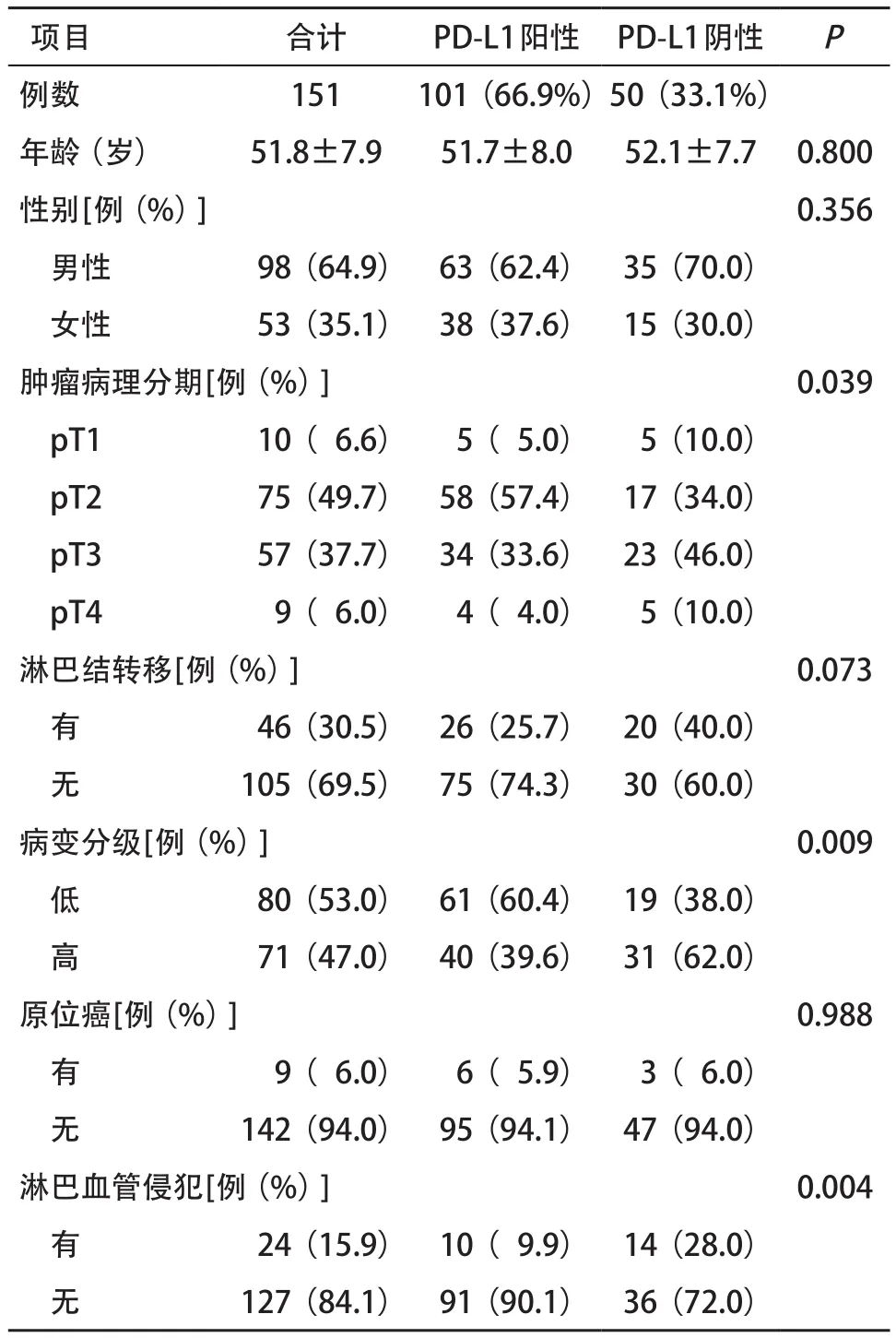
表1 研究对象一般情况与临床特征比较
2.2 复发情况 RNU后的中位随访时间为63(1~100)个月。在随访阶段,39例(25.8%)患者出现疾病复发,24例(15.9%)患者死亡。在复发的患者中,22例(56.4%)局部盆腔复发,11例(28.2%)远处转移,6例(15.4%)局部盆腔复发伴随远处转移。根据转移受累部位区分包括7例骨骼,4例肺部,2例肝脏,1例淋巴结。其中有3例患者有多处转移受累部位。
2.3 生存率情况 图2为以肿瘤中PD-L1阳性表达率1%为临界值时的无瘤生存率和肿瘤特异性生存率的Kaplan-Meier曲线分析。肿瘤中PD-L1阳性表达患者和阴性表达患者术后5年无瘤生存率分别为76%和53%(P=0.010),术后5年特异性生存率分别为83%和64%(P=0.014)。当以5%作为PD-L1阳性表达临界值时,PD-L1表达和生存率之间没有显著差异。表2为以1%作为PD-L1阳性表达临界值时的多因素Cox比例风险回归分析结果。在校正了肿瘤病理分期、病变分级、淋巴结转移和淋巴血管侵犯等因素后,肿瘤中PD-L1阴性表达与疾病复发(HR=2.05,95%CI= 1.06~3.96,P=0.032)和癌症特异性生存(HR=2.89,95%CI=1.23~6.82,P=0.024)显著相关,而当以5%作为肿瘤中PD-L1阳性表达的临界值时,肿瘤中PD-L1阴性表达与疾病复发和癌症特异性生存率没有显著关联。
3 讨论
通过对患者肿瘤组织进行IHC分析,我们发现PD-L1阴性表达与不良病理特征相关。此外,多因素分析显示,PD-L1阴性表达是疾病复发和癌症特异性生存率的独立预后因子。这表明PD-L1表达在不良病理学应用中的重要性。
肿瘤细胞中PD-L1表达维持免疫抑制环境的能力可能可以用来解释PD-L1表达与膀胱UTUC预后之间的关联[9]。在本研究中发现PD-L1的阴性表达与更差的预后如疾病复发和癌症特异性生存率独立相关,且UTUC患者中肿瘤PD-L1阳性表达和阴性表达的5年特异性生存率分别为83%和64%。本研究的发现与此前的关于PD-L1在膀胱尿路上皮癌中的预后意义的结果相反[4-6]。在这些研究中,肿瘤中PD-L1阳性表达不仅使肿瘤分期进展的风险增加了一倍[4],而且与更差的无瘤生存率、特异性生存 率[5]以及器官局限性癌症的全因死亡率相关[6]。虽然PD-L1阳性表达被认为是大多数泌尿系统恶性肿瘤预后不良的生物标志物[10],但最近一项有关UTUC的研究报道肿瘤细胞中的PD-L1阳性表达对疾病复发和全因死亡率是有利的[11]。本研究发现了PD-L1介导抑制UTUC中肿瘤微环境内的免疫应答的可能有益作用。此外,这些发现表明了将UTUC患者纳入免疫治疗临床试验的必要性,通过临床试验评估这些癌症对检查点抑制剂的免疫治疗是否有反应,以及肿瘤PD-L1阳性表达是否对该回应有预后性。
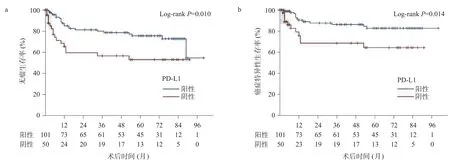
图2 UTUC患者肿瘤细胞中PD-L1阳性表达与其预后的生存曲线
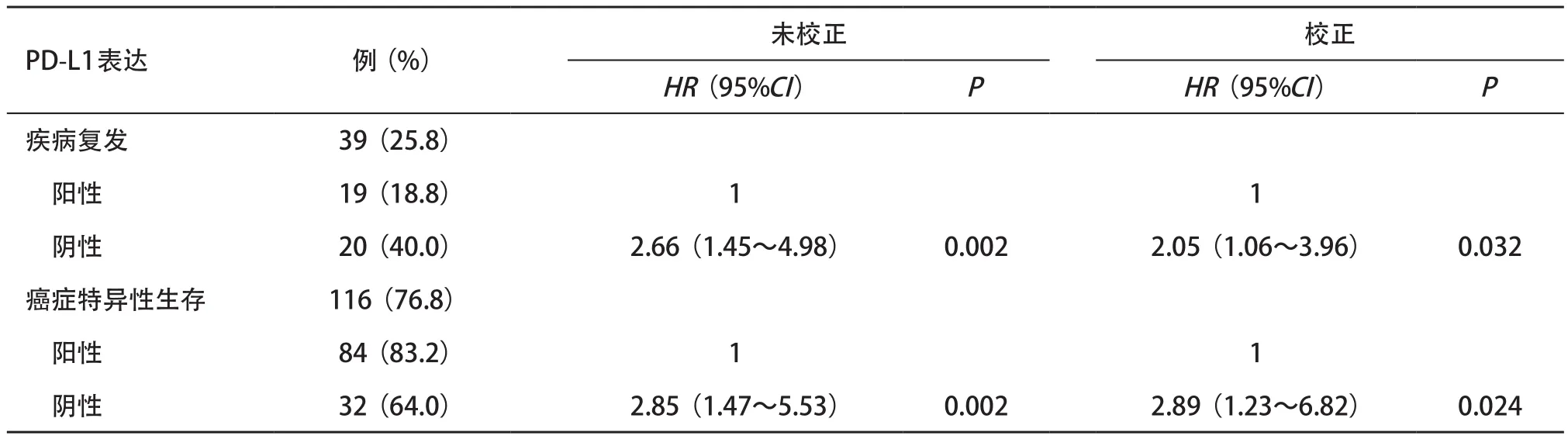
表2 多因素Cox回归模型分析
肿瘤病理分期、淋巴结状态和病变分级对UTUC的预后意义在以前的文献中已有很好论述[12-13]。王庆伟等[12]发现肿瘤分期、肿瘤分级、肿瘤数目、输尿管镜检、低位肿瘤是影响UTUC患者长期存活的危险因素和术后再发膀胱癌的高风险因素。本研究发现PD-L1的阴性表达与肿瘤膀胱外转移、高级病变和淋巴血管侵犯的存在显著相关。普遍认为淋巴血管侵犯是尿路上皮癌术后肿瘤学结果的重要预后指标,QUEK等[14]报道了淋巴血管侵犯的存在与癌症特异性死亡率和全因死亡率的高风险显著相关。
本研究发现66.9%的肿瘤样本显示出PD-L1阳性表达。先前大部分通过IHC评估膀胱尿路上皮癌中PD-L1表达的研究中肿瘤细胞PD-L1阳性染色率较低,为12.4%~50.9%[4,6,15-19]。这种差异很可能是由于UTUC和尿路上皮癌的肿瘤微环境的差异,还可能由于不同阳性表达临界值的选取以及用于染色的抗体和/或用于分析的材料(即组织芯片)的区别。然而,PD-L1可能在维持UTUC微环境中免疫激活和免疫抑制之间的平衡方面起到重要作用。
综上,PD-L1的阴性表达与RNU后UTUC较高的肿瘤分期、更高的病变等级、淋巴血管侵犯和更差的预后显著相关。本研究表明PD-L1的阳性表达可能作为免疫应答的一部分而与更好的UTUC预后相关。这些研究结果表明了将UTUC患者纳入免疫治疗临床试验,以评估肿瘤中PD-L1的阳性表达是否与更好的治疗反应相关的必要性。
