一种基于亮氨酸氨基肽酶前药分子的中间体合成及其药物缓释机制设计
2020-11-03曾繁明宋振升王飞翼马超杨桂春
曾繁明,宋振升,王飞翼,马超,杨桂春
(1. 有机功能分子合成与应用教育部重点实验室(湖北大学), 湖北 武汉 430062;2. 武汉材料保护研究所, 湖北 武汉 430030)
0 引言
癌症是威胁人类健康的重要疾病,也是目前亟待解决的健康问题之一.目前,癌症的主要治疗方法包括放射治疗、手术治疗和化学治疗等[1-4],其中化学治疗是目前癌症治疗较为便捷的方式之一,但由于化学抗癌药物普遍存在药物作用选择性不高和毒性较大等缺陷,对正常细胞和组织造成较大损伤,因而使化学抗癌药物的发展受到较大阻碍[3-7].近年来,具有靶向性的前药分子作为癌症治疗的新兴技术受到科研工作者们的广泛关注,该类前药分子能够利用肿瘤组织或细胞的特殊特性触发前药分子在肿瘤细胞或组织中释放出抗癌药物,实现对肿瘤细胞的精准杀伤,从而最终减小化学药物治疗的副作用并提高抗癌药物的治疗功效.结合荧光染料(荧光信号输出)的新型抗癌前药分子甚至可以实现对药物的释放和定位进行实时跟踪监测[8-12],非常有利于癌症治疗效果的深入研究.
喜树碱(Camptothecin,简称 CPT)是目前应用较为广泛的抗癌药物之一,基于CPT研发的抗癌前药分子已经有一些报道,例如:Wu等[13]构建了利用光控触发药物释放的前药分子,实现对癌细胞的高效杀伤;Zhu等[14]设计合成以生物硫醇类化合物(谷胱甘肽:GSH)触发药物释放的前药分子Cy-S-CPT;Kim等[15]构建的活性氧类(ROS)化合物触发CPT释放的前药分子,实现对肿瘤细胞精准杀伤等.这些前药分子在光、生物硫醇类小分子和活性氧等途径下在肿瘤组织中被激活并释放抗癌药物CPT,实现对肿瘤细胞的精准杀伤.然而,到目前为止,利用肿瘤细胞中过表达的生物酶触发前药分子药物释放的工作却鲜有报道.

图1 前药分子中间体CPT-Leu-OH结构示意图
亮氨酸氨基肽酶(Leucine aminopeptidase, 简称LAP)是生物体内一种重要的蛋白水解酶,研究表明LAP可作为癌症等诸多疾病诊断和愈后监测的重要指标[16-18],例如LAP与卵巢上皮恶性肿瘤和乳腺癌的发展紧密相关[19-20],然而目前基于LAP酶激活的前药分子还未见报道,因而推动发展基于LAP酶激活的前药分子,实现对LAP相关癌症的诊疗一体化研究将具有非常重要的意义.以此为目的,本文中我们尝试设计合成一种前药分子中间体CPT-Leu-OH(如图1所示),期望以该中间体为平台,推动构建基于LAP触控的前药分子.CPT-Leu-OH以L-亮氨酸残基为LAP酶的特异性触发基团,CPT为基础抗癌药物,该中间体还保留有易于修饰的活性基团-羟基,有利于后续引入各种荧光信号输出基团,从而最终构建基于LAP的前药分子,为LAP相关癌症的诊疗提供新的方法参考.
1 合成部分
1.1 试剂和仪器试剂:对氨基苯甲醇,Boc-L-亮氨酸,碳酸钾,N, N-二异丙基乙胺,1-羟基苯并三唑,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,三溴化磷,2-羟基-5-甲基间苯二甲醇,喜树碱,N, N-二甲氨基吡啶,三光气,N, N-二甲基甲酰胺,四氢呋喃,二氯甲烷,丙酮,乙腈,甲醇.实验中所用到的试剂和药品均是采购于商业供应商.二氯甲烷、丙酮、乙腈需除去水后使用,其他试剂不需要经过再次纯化等处理即可直接使用.
仪器:核磁共振仪WIPM 400 M(中国科学院)、液-质联用仪Waters LCT Premier XE(安捷伦科技有限公司)、pH计FiveEasy Plus(瑞士梅特勒-托利多集团).
1.2 合成路线的设计合成路线如图2所示.

图2 化合物CPT-Leu-OH的合成路线图
1.3 合成步骤化合物1的合成:在干燥的100 mL烧瓶中,将对氨基苯甲醇(1.23 g,10.00 mmol)溶解在15.00 mL干燥的N,N-二甲基甲酰胺(DMF)溶液中,在0 ℃的条件下,用注射器缓慢加入N,N-二异丙基乙胺(DIPEA,3.40 mL),搅拌15 min,再将溶于一定量干燥DMF的1-羟基苯并三唑一水物(HOBT,1.35 g,10.00 mmol)缓慢加入其中,继续搅拌15 min,然后将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCl,1.92 g,10.00 mmol)缓慢加入,搅拌20 min后,在0 ℃下,将溶解在一定量干燥DMF中的Boc-L-亮氨酸(2.77 g,12.00 mmol)缓慢加入到上述反应体系中,搅拌30 min,然后恢复到室温继续反应4 h.反应结束后,每次用20 mL乙酸乙酯(EA)将反应液萃取3次,然后减压蒸馏浓缩除去溶剂,得到残留物通过硅胶柱层析色谱法纯化,乙酸乙酯/石油醚为洗脱液(PE∶EA=4∶1,V/V),得到化合物1为白色固体(2.76 g,产率82.14%).
化合物2的合成:在氩气氛围的保护下,将化合物1(1.35 g,4.00 mmol)溶解在30.00 mL干燥的四氢呋喃(THF)中,在0 ℃下,用注射器将稀释有PBr3(184.00 μL,3.00 mmol)的5.00 mL干燥THF缓慢加入反应体系中,在0 ℃下搅拌3 h.反应结束后,将混合物用 100.00 mL冰水稀释,然后加入一定量的饱和NaHCO3溶液.用乙酸乙酯萃取三次稀释液(30 mL× 3),然后用无水硫酸钠干燥,过滤.然后减压蒸馏浓缩除去溶剂,得到残留物通过使用硅胶柱层析色谱法纯化,乙酸乙酯/石油醚为洗脱液(PE∶EA=2∶1,V/V),得到化合物2为白色固体(1.21 g,产率76.10%).
化合物3的合成:将化合物2(501.63 mg,1.26 mmol)和2-羟基-5-甲基间苯二甲醇(847.12 mg,5.04 mmol)加入到干燥的三颈烧瓶中,在氩气的保护下,加入干燥的丙酮使其溶解,在70 ℃下加热回流15 h.反应结束后,减压蒸馏除去溶剂,通过使用硅胶柱层析色谱法纯化残余物,乙酸乙酯/石油醚为洗脱液(1∶1,V/V),得到化合物3,为白色固体(398.15 mg,产率65.02%).1H NMR (400 MHz, CD3OD):δ: 9.98 (s, 1H), 7.62 (d,J=8.5 Hz, 2H), 7.38 (d,J=8.3 Hz, 2H), 7.13 (s, 2H), 7.01 (d,J=8.2 Hz, 1H), 5.01 (t,J=5.5 Hz, 2H), 4.74 (s, 2H), 4.50 (d,J=5.1 Hz, 4H), 4.12 (s, 1H),2.49 (t,J=5.3 Hz, 2H), 2.27 (s, 3H), 1.38 (s, 10H), 0.89 (dd,J=6.3, 4.3 Hz, 6H).
化合物CPT-Leu-OH的合成:在氩气氛围下,将DMAP(72.00 mg,0.59 mmol)和CPT(104.00 mg,0.30 mmol)溶解在干燥的二氯甲烷(25.00 mL)中,在0 ℃下,将三光气(30.00 mg,0.10 mmol)溶解在3 mL的干燥的二氯甲烷中,用注射器缓慢加入到反应体系中,反应30 min,将化合物3(48.63 mg,0.10 mmol)溶解在5.00 mL干燥二氯甲烷中,将其缓慢加入混合液中,然后在室温下反应15 h.反应结束后,减压蒸馏除去溶剂,通过使用硅胶柱层析色谱法纯化残余物,二氯甲烷/甲醇为洗脱液(20∶1),得到化合物CPT-Leu-OH(38.26 mg,产率44.50 %),为白色固体.1H NMR (400 MHz, CD3OD):δ: 8.66 (s, 1H), 8.31 (s, 1H), 8.13 (d,J=8.5 Hz, 1H), 7.92 (d,J=8.1 Hz, 1H), 7.82 (t,J=7.6 Hz, 1H), 7.66 (t,J=7.5 Hz, 1H), 7.29 (s, 2H), 7.24 (s, 1H), 7.18 (s, 1H), 7.11 (s, 2H), 7.04 (d,J=7.0 Hz, 1H), 5.61 (d,J=17.2 Hz, 1H), 5.34 (d,J=17.2 Hz, 1H), 5.23 (d,J=11.6 Hz, 2H), 5.19 (s, 2H), 5.10 (d,J=8.2 Hz, 1H), 4.65 (s, 2H), 4.59 (s, 2H), 4.20 (s, 1H), 3.65 (t,J=6.6 Hz, 2H), 2.20 (s, 3H), 1.60~1.50 (m, 3H), 1.44 (s, 9H), 1.37 (s, 2H), 0.95 (s, 8H); HRMS (ESI,m/z): [M+H]+Calcd. for C48H53N4O11+: 861.3596, Found: 861.3591.
1.4 化合物的表征合成出上述目标化合物后,采用核磁共振氢谱(1H NMR)和高分辨质谱(HRMS)对化合物进行测定和结构表征.相关谱图分析的结果表明;合成的亮氨酸氨基肽酶前药分子的中间体CPT-Leu-OH的结构与测定的相符.
图3为化合物3的1H NMR谱图,图中化学位移为2.27处为2-羟基-5-甲基间苯二甲醇部分上的甲基峰,7.00为其苯环上的氢特征峰,7.38和7.68为化合物2部分上的苯环上氢特征峰,9.98为识别基团酰胺键上氢的峰,说明成功合成了化合物3.图4为化合物CPT-Leu-OH的1H NMR谱图,图中化学位移1.44为化合物3部分上的Boc保护基上的氢,7.11~7.29为CPT苯环上的氢特征峰,说明CPT成功接入化合物3上,得到化合物CPT-Leu-OH.

图3 化合物3的1H NMR谱图
图5为化合物CPT-Leu-OH的高分辨质谱(HRMS)测试图,HRMS (ESI,m/z): [M+H]+计算值:C48H53N4O11+:861.359 6,高分辨质谱检测值:861.359 1,[M+Na]+计算值:C48H52N4O11Na+:883.341 0,高分辨质谱检测值:883.340 5,从图中可以看出高分辨质谱(HRMS)测试检测的质荷比与理论计算所得分子的质荷比的数值接近,证明化合物CPT-Leu-OH的结构正确性.
2 药物释放机制与展望
在设计合成前药分子中间体CPT-Leu-OH的过程中,我们在该化合物的结构上保留有易于修饰的活性基团-羟基,有利于后续引入各种荧光信号输出基团,从而最终构建基于亮氨酸氨基肽酶的前药分子.
如图6所示,我们以引入近红外荧光团(R)对前药分子中间体CPT-Leu-OH进行修饰,然后通过进一步的脱甲基.以得到基于LAP酶激活的前药分子为例:当前药分子与LAP相互作用时,前药分子结构中的LAP识别基团部分的酰胺键会被LAP酶特异性裂解,裸露出自由胺基,而自由胺基上的孤对电子会沿着共轭体系发生电子转移,引起苄基C—O键断裂,并进一步促使碳酸脂键裂解释放出抗癌药物CPT,同时作为荧光信号输出的荧光团也会被激活释放出来,引起荧光信号发生变化.该过程在释放抗癌药物杀伤癌细胞的同时,也通过荧光信号的输出,达到监测药物释放过程的目的,因而有利于对前药分子的诊疗效果进行更加深入研究.

图4 化合物CPT-Leu-OH的1H NMR谱图
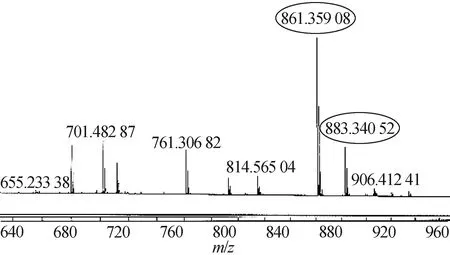
图5 化合物CPT-Leu-OH的高分辨(HRMS)质谱图

图6 前药分子的响应机理示意图
3 结论
通过上述研究工作,我们设计合成一种基于亮氨酸氨基肽酶的前药分子中间体CPT-Leu-OH,以该中间体为平台,有利于构建基于LAP触控的前药分子,用于癌症诊疗一体化研究.CPT-Leu-OH以L-亮氨酸残基基团作为LAP酶的特异性识别基团,以喜树碱CPT作为抗癌药物分子,同时在该化合物的结构上保留有易于修饰的活性基团-羟基,有利于后续引入各种荧光信号输出基团,从而最终构建基于亮氨酸氨基肽酶的前药分子,为LAP相关癌症的诊疗提供新的方法参考.
