木瓜蛋白酶分离蛋壳壳膜研究
2020-11-02李逢振

摘要 介绍了利用木瓜蛋白酶酶解分离蛋壳壳膜的方法,探讨了木瓜蛋白酶酶解分离壳膜的最佳反应条件。结果表明,木瓜蛋白酶酶解分离壳膜的最佳反应条件如下:蛋壳粉用量为50 g,木瓜蛋白酶用量占蛋壳粉量的2.5‰,反应时间为90 min,反应温度为60 ℃,反应体系pH为5.5,反应体系固液比为1∶8。在此最佳反应条件下,回收壳下膜的平均重量为1.65 g。
关键词 木瓜蛋白酶;分离;壳膜
中图分类号 TS253.9 文献标识码 A 文章编号 0517-6611(2020)19-0186-03
doi:10.3969/j.issn.0517-6611.2020.19.049
Abstract This paper introduced the method of separating shell membrane by enzymatic hydrolysis of papain. The optimal reaction conditions for the separation of shell membrane by enzymatic hydrolysis of papain were as follows: eggshell powder dosage of 50 g, the proportion of papain dosage in eggshell powder dosage of 2.5‰, the reaction time of 90 min, the reaction temperature of 60 ℃, pH of the reaction system of 5.5, solidliquid ratio of 1∶8. Under the optimal reaction conditions, the average weight of the undershell membrane recovered 1.65 g.
Key words Papain;Separation;Eggshell membrane
基金项目 衡阳市科学技术发展计划项目(2015KS26);湖南环境生物职业技术学院支柱工程资助项目。
作者简介 李逢振(1983—),男,湖南衡阳人,副教授,硕士,从事畜产品加工和畜禽废弃物综合利用研究。
收稿日期 2020-03-25
随着人们生活水平的不断提高,鸡蛋已成为居民餐桌上必不可少的动物性食品。蛋壳是鸡蛋的重要组成部分,其主要由石灰质真壳和壳下膜2个部分组成[1],石灰质真壳中的碳酸钙可以用于转化制备乳酸钙[1]、乙酸钙[2]等生物有机钙产品。从壳下膜中可以转化提取出抗氧化多肽[3]、透明质酸[4]、硫酸软骨素[5]等可溶性高分子化合物,这些物质可用于制备生物吸附剂[6]、酶生物传感器固定化膜[7]、生物矿化调控基质[8]、新型药物控释材料及医用包扎材料[9]、胶原蛋白护肤品[10]等产品,具有极高的利用价值。笔者选用木瓜蛋白酶对蛋壳进行生物酶解,使其壳膜分离,旨在为进一步研究利用石灰质真壳和壳下膜奠定基础。
1 材料与方法
1.1 试验材料
鸡蛋购于当地农贸市场;木瓜蛋白酶(食品级酶制剂,酶活200 000 U/g,南宁庞博);盐酸(分析纯,国药试剂);氢氧化钠(分析纯,国药试剂)。
1.2 主要仪器与设备
电热恒温干燥箱(型号202,上海科恒);数显恒温水浴锅(型号HHS,上海博迅);粉碎机(型号QE-200,武义屹立);电子分析天平(型号JJ224BC,常熟双杰);数显酸度计(型号PHS-3C,上海越平)。
1.3 试验原理
鸡蛋的石灰質真壳部分与壳下膜主要通过糖蛋白微细纤维相连接,其主要是由蛋白质组成,因此可以使用木瓜蛋白酶在适当条件下对其进行生物酶解,将蛋白质转化成多肽和氨基酸等物质,改变真壳乳头层中的钙纤维状锥形体与壳下膜中角蛋白的结合状态,降低石灰质真壳与壳下膜的结合力[11],从而达到分离壳膜的目的。
1.4 试验方法
1.4.1 鸡蛋壳预处理阶段。
将去除蛋黄和蛋清等可食部分的鸡蛋壳置于清水中浸泡30 min,再用清水冲洗,去除鸡蛋壳表面附着的杂质,洗净后捞出。将沥干水分的鸡蛋壳放入70 ℃恒温干燥箱中干燥3 h,待蛋壳冷却后用粉碎机粉碎3 min,贮藏备用。
1.4.2 酶解反应阶段。
取50 g蛋壳粉置于烧杯中,将调节好pH的纯净水按一定比例加入烧杯中,再加入木瓜蛋白酶搅拌5 min,将搅拌好的烧杯置于恒温水浴锅中,进行酶解反应。
1.4.3 干燥称量阶段。
待酶解反应完成后,去除上清液,再将烧杯置于电热恒温干燥箱中进行干燥,干燥完成后将上层蛋膜取出进行称量。
2 结果与分析
2.1 木瓜蛋白酶用量对回收壳下膜的影响
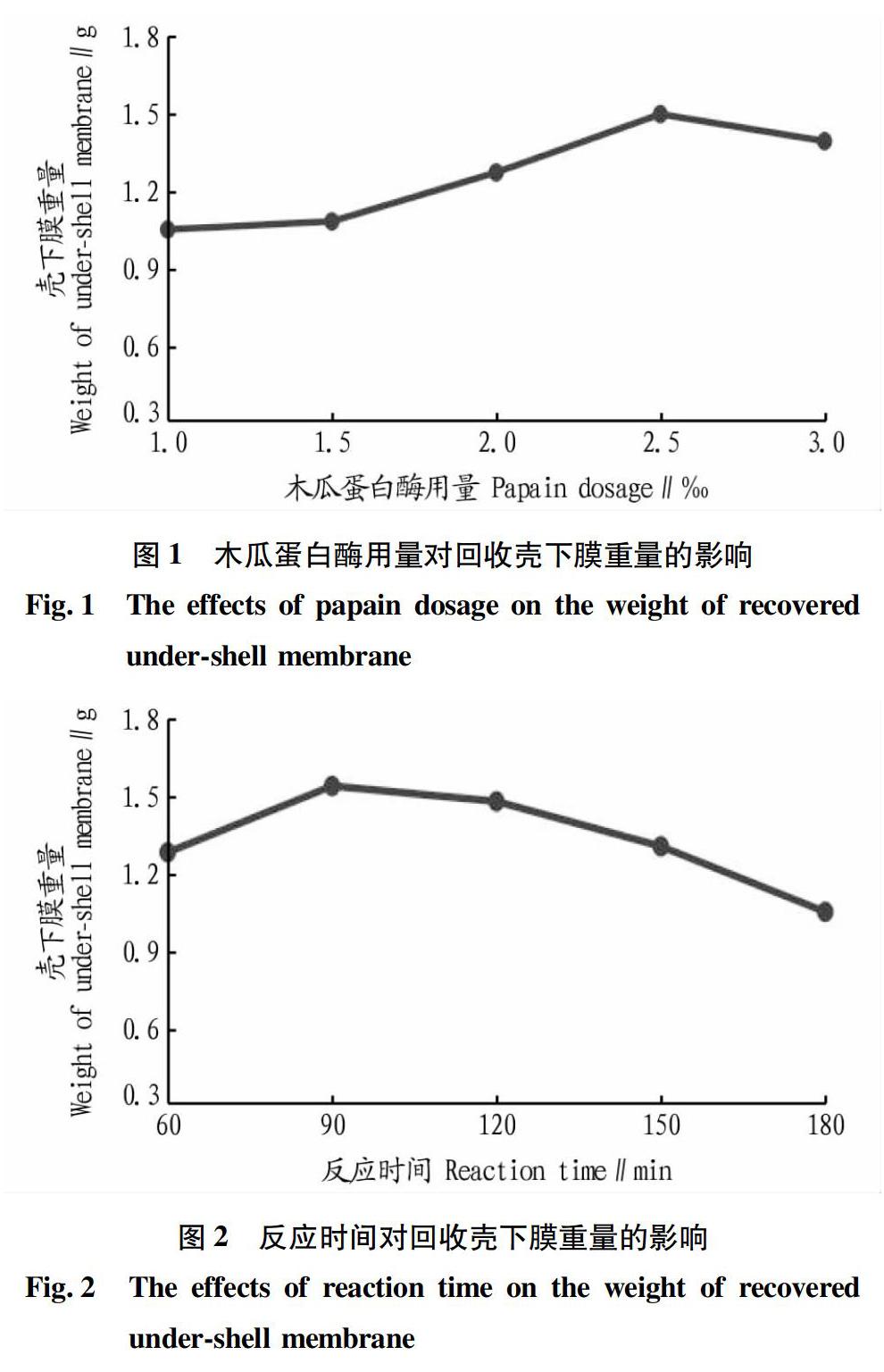
称取50 g蛋壳粉置于烧杯中,备用;将pH 5.5的纯净水按1∶8的固液比加入烧杯中,加入不同用量的木瓜蛋白酶后再将烧杯放入60 ℃恒温水浴锅中反应120 min。称量不同木瓜蛋白酶用量下酶解反应后回收的壳下膜重量,试验结果如图1所示。
从图1可以看出,随着木瓜蛋白酶用量的增加,回收的壳下膜量逐渐增加,当酶用量达到2.5‰时回收的壳下膜量最多,随后当酶用量继续增加时,回收的壳下膜量呈现下降的趋势,这是由于过量的酶与壳下膜在反应体系中继续发生酶解反应,从而导致回收的壳下膜量减少。由此可见,当木瓜蛋白酶用量为蛋壳粉量的2.5‰时,可以取得较好的壳膜分离效果。
2.2 反应时间对回收壳下膜的影响
称取50 g蛋壳粉置于烧杯中,备用;将pH 5.5的纯净水按1∶8的固液比加入烧杯中,加入2.5‰木瓜蛋白酶后再将烧杯放入60 ℃恒温水浴锅中反应不同时间。称量不同反应时间的酶解反应后回收的壳下膜重量,结果如图2所示。
从图2可以看出,随着反应时间的增加,回收的壳下膜量呈现先增加后减少的变化趋势,当反应时间为90 min时回收的壳下膜量最多,此后随着反应时间的继续增加时,木瓜蛋白酶与壳下膜继续发生酶解反应,导致壳下膜逐渐损耗。同时,随着反应时间的延长导致反应消耗的能源逐渐增加。由此可见,木瓜蛋白酶与蛋壳粉酶解反应90 min时可以取得较好的壳膜分离效果。
2.3 反应温度对回收壳下膜的影响
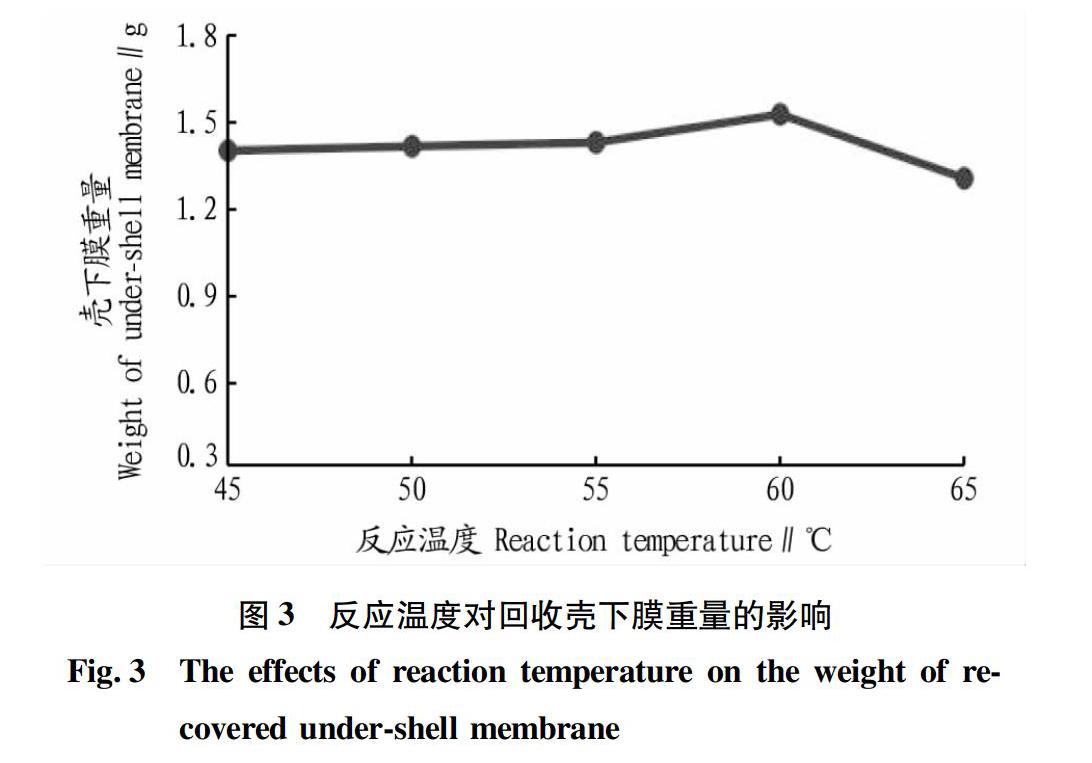
称取50 g蛋壳粉置于烧杯中备用,将pH 5.5的纯净水按1∶8的固液比加入烧杯中,加入2.5‰木瓜蛋白酶后,再将烧杯放入不同温度的恒温水浴锅中反应90 min。称量不同反应温度条件下酶解反应后回收的壳下膜重量,结果如图3所示。
从图3可以看出,当反应温度为45~60 ℃时,回收的壳下膜量逐渐增加,但总体变化不大,当反应温度超过60 ℃后,回收的壳下膜量出现明显的下降。这是因为高温导致木瓜蛋白酶发生变性,使得木瓜蛋白酶的酶活力明显减弱,从而影响了酶解反应的壳膜分离效果。由此可见,木瓜蛋白酶与蛋壳粉酶解反应温度保持在60 ℃时可以取得较好的壳膜分离效果。
2.4 反应体系pH对回收壳下膜的影响
称取50 g蛋壳粉置于烧杯中备用,将不同pH的纯净水按1∶8的固液比加入烧杯中,加入2.5‰木瓜蛋白酶后再将烧杯放入60 ℃恒温水浴锅中反应90 min。称量不同反应体系pH条件下酶解反应后回收的壳下膜重量,结果如图4所示。
从图4可以看出,木瓜蛋白酶在偏酸性和中性的环境中均能发挥较好的酶解效果,当反应体系pH为4.5~5.5时回收的壳下膜量最多,随着反应体系的pH升高,回收的壳下膜量呈现下降的趋势。这是因为反应体系的pH逐渐向木瓜蛋白酶的等电点8.75靠近,酶活性受到抑制,影响了壳膜分离效果。另外,反应体系的pH越低,反应产生的废液对环境造成污染会更加严重,因此需要在试验结果确定时进行综合考量。由此可见,木瓜蛋白酶与蛋壳粉酶解反应体系的pH控制在5.5时可以取得较好的壳膜分离效果。
2.5 反应体系固液比对回收壳下膜的影响
称取50 g蛋壳粉置于烧杯中备用,将pH 5.5的纯净水按不同的固液比加入烧杯中,加入2.5‰木瓜蛋白酶后再将烧杯放入60 ℃恒温水浴锅中反应90 min。称量不同固液比下酶解反应后回收的壳下膜重量,结果如图5所示。
从图5可以看出,随着反应体系固液比的增加,回收的壳下膜量总体上呈现增加的趋势,说明在液体环境下木瓜蛋白酶的活力得到有效激发,酶解反应顺利进行。但是,当固液比达到1∶9时,回收的壳下膜量稍微有所减少,这是由于大量液体稀释了木瓜蛋白酶的酶解效果。由此可见,木瓜蛋白酶与蛋壳粉酶解反应体系的固液比为1∶8时可以取得较好的壳膜分离效果。
2.6 最佳反应条件的确定
通过以上单因素试验确定最佳反应条件如下:蛋壳粉用量为50 g;木瓜蛋白酶用量占蛋壳粉量的2.5‰;反应时间为90 min;反应温度为60 ℃;反应体系pH为5.5;反应体系固液比为1∶8。选用最佳反应条件进行3次平行试验,确定最佳反应条件下回收的壳下膜重量,结果如表1所示。
由表1可知,在最佳反应条件下,采用木瓜蛋白酶进性壳膜分离能取得较好的效果,在蛋壳粉用量为50 g、木瓜蛋白酶用量为蛋壳粉量的2.5‰、反应时间为90 min、反应温度为60 ℃、反应体系pH为5.5、反应体系固液比为1∶8的条件下回收壳下膜的平均重量为1.65 g。
3 结论与讨论
研究发现,利用木瓜蛋白酶的酶解作用可使蛋壳真壳与壳下膜发生分离,其最佳反应条件如下:蛋壳粉用量为50 g;木瓜蛋白酶用量占蛋壳粉量的2.5‰;反应时间为90 min;反应温度为60 ℃;反应体系pH为5.5;反应体系固液比为1∶8。在此条件下回收壳下膜的平均重量为1.65 g。经过壳膜分离可以获取更加纯净的蛋壳真壳和壳下膜,为其后续的转化利用奠定了基础。
参考文献
[1] 李逢振.蛋壳壳膜分离技术的研究[J].农产品加工,2020(4):65-67.
[2] 刘敏,郭宇,武月,殷慧敏,等.食品补强剂醋酸钙的制备工艺研究[J].天津化工,2017,31(4):19-22.
[3] 李晓云. 基于鸡蛋壳膜的三种生物敷料的制备及其伤口愈合功能研究[D].武汉:华中农业大学,2019.
[4] 朱文婷,吴士筠,杨惠,等.酶法提取鸡蛋壳膜中透明质酸的工艺优化[J].食品科技,2016,41(1):204-209.
[5] 刘涛,张铁鹏,栾欣悦,等.响应面法优化蛋壳膜硫酸软骨素提取工艺[J].包装工程,2019,40(17):48-55.
[6] TSAI W T,YANG J M,LAI C W,et al.Characterization and adsorption properties of egg shells and eggshell membrane[J].Bioresour Technol,2006,97(3):488-493.
[7] ZHANG G M,LIU D S,SHUANG S M,et al.A homocystein biosensor with eggshell membrane as an enzyme immobilization platform[J].Sens Actuators B:Chem,2006,114(2):936-942.
[8] DONG Q,SU H L,ZHANG D,et al.Biotemplatedirected assembly of porous SnO2 nanoparticler into tubular hierarchical structures[J].Scripta materialia,2006,55(9):799-802.
[9] INO T,HATTORI M,YOSHIDA T,et al.Improved physical and biochemical features of a collagen membrane by conjugationg with soluble eggshell membrane protein[J].Biosci Biotechnol Biochem,2006,70(4):865-873.
[10] 趙敏,陈访访,潘津泳,等.蛋壳膜中胶原蛋白的提取分离[J].食品研究与开发,2012,33(4):17-19.
[11] 杨德玉,李珍,高新,等.酶法提取蛋壳膜中的角蛋白[J].食品科学,2007,28(6):240-242.
