鳖甲⁃莪术药对含药血清对MCF⁃7 人乳腺癌细胞的影响
2020-11-02胡雅清陈腾祥张金娟张晨宇朱曼荆
胡雅清 陈腾祥 张金娟 谢 青 张晨宇 朱曼荆 谢 甦∗
(1.贵州医科大学, 贵州 贵阳550004; 2.贵州医科大学附属医院, 贵州 贵阳550004)
如今癌症已成为威胁人类生存和社会发展的主要疾病之一,在不同地域不同人群中,乳腺癌也都是备受关注的主要癌症。在全球著名学术刊物《CA:A Cancer Journal for Clinicians》 发布的美国2018 年癌症统计报告中显示,女性新发癌症病例的30%都是乳腺癌,远远超过其他癌症,同时我国国家癌症中心发布的癌症负担最新结果表明,乳腺癌也位居女性癌症发病率首位[1]。鳖甲⁃莪术药对是国医大师刘尚义治疗恶性肿瘤的常用组合,使用频次最多,达1 201 次,已有十余年临床应用实践,但尚缺乏分子水平药理学研究[2⁃4]。鳖甲味咸、性微寒,归肝肾经,能滋阴潜阳、退热除蒸、善于软坚散结[5];莪术味辛、苦,性温,归肝、脾经,有行气破血、消积止痛之功效[6];鳖甲味咸而补益属阴,莪术味辛而走散属阳;鳖甲滋阴散结,莪术行气破血,两药合用,一补一攻、寒温相宜、阴阳相适、为消积聚癥瘕之要药[7]。本实验基于Wnt/β⁃catenin 信号通路,探讨鳖甲⁃莪术药对含药血清对乳腺癌细胞增殖的抑制作用。
1 材料
1.1 细胞株 MCF⁃7 人乳腺癌细胞株,由中国科学院上海细胞库提供。
1.2 动物 SPF 级雌性SD 大鼠55 只,体质量220~260 g,购自长沙市天勤生物技术有限公司,生产许可证号SCXK(湘)2014⁃0011,动物质量合格证号43006700016478。
1.3 药物 醋鳖甲颗粒剂(批号8127093)、莪术颗粒剂(批号8071933)均购自广东一方制药有限公司。
1.4 试剂 DMEM 培养基(美国Gibco 公司,货号8119234);胎牛血清(浙江天杭生物科技股份有限公司,货号19080505);BD Pharmingen 流式周期试剂盒(美国Sigma 公司,货号9039585);噻唑蓝(MTT,北京索莱宝科技有限公司,货号725c056);胰蛋白酶(北京索莱宝科技有限公司,货号2046777);青链霉素混合液(北京索莱宝科技有限公司,货号J190003);5⁃氟尿嘧啶MB1273(大连美仑生物有限公司,货号s0808a);Anti⁃Cyclin D1 抗 体(英 国 Abcam 公 司,货 号GR3212345⁃11,稀释倍数1/10 000);Anti⁃c⁃Myc抗体(英国Abcam 公司,货号GR3232703⁃2,稀释倍数1/1 000);Anti⁃beta Catenin 抗体(英国Abcam公司,货号GR184212⁃61,稀释倍数1/5 000)。
1.5 仪器 SW⁃CJ⁃2FD 超净工作台(苏州净化设备有限公司);Model 310 恒温CO2培养箱(美国Thermo 公司);CKX41 倒置显微镜(日本Olympus 公司);16K 台式自动离心机(珠海黑马医学仪器有限公司);Allegra 64R Centrifuge 台式高速冷冻离心机(美国Beckman Coulter 公司);多功能酶标仪(美国BioTek 公 司);EPICL XL 型流式细胞仪(美 国Beckman Coulter 公司);ChemiDoc MP 凝胶成像系统(美国Bio⁃Rad 公司);MiniVE 电泳仪(美国GE 公司);全自动雪花制冰机IMS⁃40(常熟市雪科电器有限公司);MDF⁃382E 超低温冰箱(日本SANYO 公司);KS130B 脱色摇床(德国IKA 公司)。
2 方法
2.1 细胞培养 培养人乳腺癌细胞株MCF⁃7 于含10%胎牛血清的DEME 培养基中,再将其置于5%CO2、37 ℃、饱和湿度细胞培养箱中培养,次日换液,倒置显微镜下观察细胞生长情况。当细胞生长到70%~80% 时,可进行消化传代或用于实验。
2.2 药物血清制备 将大鼠随机分鳖甲组、莪术组、鳖甲⁃莪术药对组各10 只,空白组25 只,以给药剂量为其等效剂量的20 倍计算,确定鳖甲给药剂量为3 g/kg,莪术给药剂量为1.5 g/kg,鳖甲⁃莪术药对给药剂量为4.5 g/kg,每天2 次,连续7 d。最后1 次给药前大鼠禁食不禁水12 h,给药后2 h 水合氯醛麻醉,心尖取血,2 000 r/min 离心15 min 取血清,同组混合以消除个体差异,56 ℃下灭活30 min,0.22 μm 过滤除菌,-80 ℃下保存备用。
2.3 细胞分组 正常MCF⁃7 细胞分为空白血清组(10%空白血清+90%DMEM 培养基培养)、鳖甲低剂量组(2.5% 鳖甲血清+7.5% 空白血清+90%DMEM 培养基培养)、鳖甲中剂量组(5% 鳖甲血清+5%空白血清+90%DMEM 培养基培养)、鳖甲高剂量组(10% 鳖甲血清+90% DMEM 培养基培养)、莪术低剂量组(2.5% 莪术血清+7.5% 空白血清+90% DMEM 培养基培养)、莪术中剂量组(5%莪术血清+5%空白血清+90%DMEM 培养基培养)、莪术高剂量组(10%莪术血清+90%DMEM 培养基培养)、鳖甲⁃莪术药对低剂量组(2.5%鳖甲⁃莪术药对血清+7.5%空白血清+90%DMEM 培养基培养)、鳖甲⁃莪术药对中剂量组(5%鳖甲⁃莪术药对血清+5% 空白血清+90% DMEM 培养基培养)、鳖甲⁃莪术药对高剂量组(10%鳖甲⁃莪术药对血清+90%DMEM 培养基培养)、阳性对照组(10% 空白血清+90% DMEM 培养基培养+10 mg/mL 氟尿嘧啶)。
2.4 MTT 法检测细胞增殖 取对数生长期的MCF⁃7 细胞,取100 μL 浓度为1 × 105/ mL 者接种于96 孔培养板中,每组5 个复孔,1 d 后加入饥饿培养液饥饿24 h 使细胞同步化,换不同剂量10%空白血清培养基、鳖甲血清培养基、莪术血清培养基、鳖甲⁃莪术药对血清培养基和含10 mg/mL 阳性药的空白血清培养基,在培养箱中分别培养48、72 h。培养结束后,于相应时间点在96 孔板中加入MTT 溶液20 μL,在培养箱中继续培养4 h 后,吸弃孔内培养上清液,每孔加入二甲基亚砜(DM⁃SO)150 μL,37 ℃下振荡10 min,使结晶充分溶解,于490 nm 波长处测定光密度(OD),计算细胞增殖抑制率,公式为抑制率=(1-OD实验组/OD对照组)× 100%,重复3 次。
2.5 流式细胞术检测MCF⁃7 细胞周期 取对数生长期的MCF⁃7 细胞,取1 mL 浓度为1 × 105/mL 者接种于6 孔培养板中,1 d 后加入饥饿培养液饥饿24 h 使细胞同步化,换不同剂量10% 的空白血清培养基、鳖甲血清培养基、莪术血清培养基、鳖甲⁃莪术药对血清培养基和含10 mg/mL 阳性药的空白血清培养基作用48 h,根据细胞周期检测试剂盒说明书进行操作。
2.6 Western blot 检测β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达 取对数生长期的MCF⁃7 细胞,取1 mL浓度为1×105/mL 者胞接种于6 孔培养板中,1 d 后加入饥饿培养液饥饿24 h 使细胞同步化,换不同剂量10%空白血清培养基、鳖甲血清培养基、莪术血清培养基、药对血清培养基和含10 mg/mL阳性药的空白血清培养基作用48 h,弃上清,PBS冲洗3 次,加入适量细胞裂解液,冰上裂解30 min,4 ℃、15 000 r/min 离心20 min,取上清,BCA 法对所提总蛋白进行定量,规定上样量为30 μg,加入Loading Buffer 煮沸变性,10% SDS⁃PAGE 凝胶电泳分离,电转移至PVDF 膜,一抗4 ℃下孵育过夜,二抗室温下孵育2 h,ECL 化学发光液孵育。凝胶成像系统扫描,并定量分析条带光密度值。
2.7 统计学分析 运用SPSS 20.0 统计软件进行处理,计量资料以()表示,多组间比较采用单因素方差分析,两两比较用LSD 检验。以P<0.05 为差异具有统计学意义。
3 结果
3.1 各组含药血清对MCF⁃7 细胞增殖的影响 与空白血清组比较,各含药血清组作用48、72 h 后均能抑制MCF⁃7 细胞增殖(P<0.05,P<0.01)。同一中药不同剂量的抑制率依次为高剂量组>中剂量组>低剂量组,而同一剂量不同中药抑制率依次为药对鳖甲⁃莪术含药血清组>莪术含药血清组>鳖甲含药血清组。见表1。
表1 含药血清对MCF⁃7 细胞增殖的影响(, n=3)Tab.1 Effect of medicated serum on the proliferation of MCF⁃7 cells(, n=3)

表1 含药血清对MCF⁃7 细胞增殖的影响(, n=3)Tab.1 Effect of medicated serum on the proliferation of MCF⁃7 cells(, n=3)
注:与空白血清组比较,∗P<0.05,∗∗P<0.01。
3.2 含药血清对MCF⁃7 细胞周期的影响 与空白血清组比较,各含药血清组作用48 h 后G0 /G1 期细胞比例增加(P<0.05,P<0.01),S 期细胞比例减小(P<0.05,P<0.01),表明各组含药血清作用MCF⁃7 细胞后均可阻止G1/G0 期的细胞顺利进入S期及G2 期,从而使MCF⁃7 细胞的有丝分裂过程受到干扰,导致其增殖受到抑制,且趋势与MTT 一致。见图1、表2。

图1 含药血清对MCF⁃7 细胞周期的影响Fig.1 Effect of medicated serum on the cell cycle of MCF⁃7 cells
3.3 含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响 与空白血清组比较,各含药血清组作用48 h 后β⁃Catenin、c⁃Myc、cyclin D1 表达均降低(P<0.05,P<0.01),表明含药血清可抑制Wnt/β⁃catenin 信号通路中β⁃catenin 的表达,下调靶基因cyclinD1,c⁃Myc 的表达,从而抑制MCF⁃7细胞增殖。见表3~6、图2。
表2 含药血清对MCF⁃7 细胞周期的影响(, n=3)Tab.2 Effect of medicated serum on the cell cycle of MCF⁃7 cells(, n=3)

表2 含药血清对MCF⁃7 细胞周期的影响(, n=3)Tab.2 Effect of medicated serum on the cell cycle of MCF⁃7 cells(, n=3)
注:与空白血清组比较,∗P<0.05,∗∗P<0.01。
表3 鳖甲含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响(, n=3)Tab.3 Effects of serum medicated with Trionycis Carapax on the protein expressions of β⁃Catenin,c⁃Myc and cyclin D1(, n=3)

表3 鳖甲含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响(, n=3)Tab.3 Effects of serum medicated with Trionycis Carapax on the protein expressions of β⁃Catenin,c⁃Myc and cyclin D1(, n=3)
注:与空白血清组比较,∗P<0.05,∗∗P<0.01。
表4 莪术含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响(, n=3)Tab.4 Effects of serum medicated with Zedoary Turmeric on the protein expressions of β⁃Catenin,c⁃Myc and cyclin D1(, n=3)
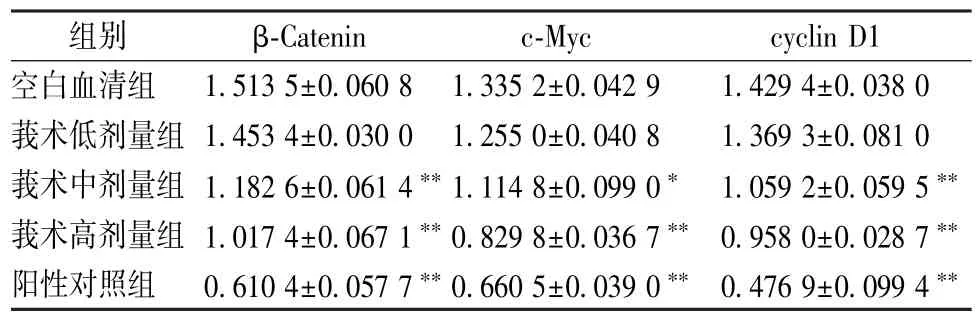
表4 莪术含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响(, n=3)Tab.4 Effects of serum medicated with Zedoary Turmeric on the protein expressions of β⁃Catenin,c⁃Myc and cyclin D1(, n=3)
注:与空白血清组比较,∗P<0.05,∗∗P<0.01。
4 讨论
西医认为,乳腺癌发病涉及多个因素的影响,该病的发生与生育史、性腺激素刺激、家族遗传史等因素有关;中医认为,正气不足是乳腺癌发病的根本原因,情志因素是乳腺癌发病的重要诱因,正气不足、情志内伤会引发脏腑功能严重异常,由于肝脏、肾脏、脾功能失调使气血运行紊乱,长期如此,痰瘀交阻于乳络,从而导致乳癌的发生[8⁃9],癌毒耗损机体正气,日久则导致气阴两虚、痰瘀交阻。针对这一病理机制,刘老提出“阴阳双消、滋阴起亟” 的治疗理念,并在此基础上以鳖甲⁃莪术药对为君药临床治疗乳腺癌上万例,疗效显著,可使患者获得较好的生存质量及较长的生存周期。
表5 鳖甲⁃莪术药对含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响(, n=3)Tab.5 Effects of serum medicated with Trionycis⁃Carapax Zedoary Turmeric on the protein expressions of β⁃Catenin,c⁃Myc and cyclin D1(, n=3)

表5 鳖甲⁃莪术药对含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响(, n=3)Tab.5 Effects of serum medicated with Trionycis⁃Carapax Zedoary Turmeric on the protein expressions of β⁃Catenin,c⁃Myc and cyclin D1(, n=3)
注:与空白血清组比较,∗P<0.05,∗∗P<0.01。
表6 各组高剂量含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响(, n=3)Tab.6 Effects of each group treated with high⁃dose medicated serum on the protein expressions of β⁃Catenin,c⁃Myc and cyclin D1(, n=3)

表6 各组高剂量含药血清对β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达的影响(, n=3)Tab.6 Effects of each group treated with high⁃dose medicated serum on the protein expressions of β⁃Catenin,c⁃Myc and cyclin D1(, n=3)
注:与空白血清组比较,∗P<0.05,∗∗P<0.01。
目前,血清药理学是研究中药复方抗肿瘤作用的有效方法,也是从细胞分子水平研究中药药理学的新手段[10],故本实验以其为理论指导探讨鳖甲⁃莪术药对含药血清治疗乳腺癌的机制。

图2 Western blot 检测β⁃Catenin、c⁃Myc、cyclin D1 蛋白表达Fig.2 Protein expressions of β⁃Catenin,c⁃Myc and cyclin D1 by Western blot
乳腺癌的发生及发展与Wnt 信号通路功能失调有密切的关系,cyclin D1、c⁃Myc 是Wnt 信号转导通路中至关重要的靶基因[11⁃12],研究表明抑癌基因失活和癌基因的激活可异常激活Wnt/β⁃catenin 信号通路,β⁃catenin 降解障碍可导致c⁃Myc等靶基因激活及细胞周期调控出现异常,从而导致乳腺癌的发生[13]。cyclin D1 作为调控细胞周期G1期的关键蛋白之一,其过度表达可以促进细胞由G1 期进入S 期,促进细胞周期转换速度的加快,最终引起细胞增殖失控,导致癌变[14]。c⁃Myc 基因既可刺激细胞增殖又可诱导细胞凋亡,其作用是通过调节细胞由G1 期进入S 期完成的,高水平的c⁃Myc mRNA 可加快细胞进入S 期的速度,导致肿瘤的发生[15]。
综上所述,各组含药血清均可抑制MCF⁃7 细胞增殖,促进其凋亡,其抗乳腺癌的机制可能与下调β⁃catenin 及β⁃catenin 下游靶基因cyclin D1、c⁃Myc 蛋白表达,阻止G1/G0 期的细胞顺利进入S期及G2 期,导致其增殖受到抑制有关。此外,鳖甲⁃莪术药对的抑制作用高于单味药,可能是配伍后相得益彰,间接辅助某一功能发挥,从而发挥协同增效的作用[16]。由于乳腺癌形成的机制十分复杂,涉及多种细胞、细胞因子以及多条信号通路,因此鳖甲⁃莪术药对含药血清抗乳腺癌作用及其机制仍需进行大量体内外实验作进一步探讨。
