VEGF纳米抗体的筛选、表达及特异性检测
2020-11-02谢秋玲罗美华雷云刘东晨熊盛
谢秋玲 罗美华 雷云 刘东晨 熊盛
(1.暨南大学 生命科学技术学院,广东 广州 510632;2.基因工程药物国家工程研究中心,广东 广州 510000)
血管内皮生长因子(VEGF)是由内皮细胞产生的能诱导血管形成、增加血管通透性和促进细胞迁移的一类生长因子。研究表明,VEGF在新生血管形成和分化中起关键作用,Ferrara等[1-2]发现肿瘤的增殖与转移、黄斑、糖尿病和高血压引起的视网膜病变均与VEGF有关。VEGF主要通过影响血管的通透性、促进新生血管的形成从而产生致病作用,肿瘤细胞和周围基质分泌的VEGF能刺激内皮细胞的增殖和存活,从而形成结构性异常的新生血管[3-4]。在许多人体肿瘤中,VEGF基因转录的信使RNA(mRNA)过度表达,其表达量与肿瘤的侵袭、转移、预后和复发相关。因此,VEGF是公认的抗肿瘤靶点之一[5]。
近年来,单克隆抗体(mAbs)在肿瘤治疗中的使用越来越广泛,抗VEGF抗体的研究也成为热点。在2004年,美国食品和药物管理局(FDA)批准抗VEGF的首个单抗贝伐珠单抗上市。贝伐珠单抗是人源化单克隆抗体,可用于治疗转移性结直肠癌、非小细胞肺癌和转移性乳腺癌[6]。随后,FDA先后批准上市抗VEGF的单抗有:适用于胃癌、胃食管结合部腺癌、非小细胞肺癌、转移性结直肠癌的雷莫芦单抗(Cyramza),适用于湿疹年龄相关黄斑变性的单克隆抗体片段(Fab)的雷珠单抗以及两种抗VEGF的融合蛋白-阿柏西普和康柏西普。虽然这些抗体药物在肿瘤治疗上取得了显著的疗效,但其稳定性、亲和力、特异性和组织穿透能力仍亟待提高。
纳米抗体是骆驼外周血中的一种天然无轻链的抗体,仅有重链(VHHs)和两个常规的CH2与CH3区,是能结合目的抗原的最小单位,分子质量只有常规抗体的1/10左右,仅为15 kDa;但其含有3个抗原互补决定区(CDR),具有完整的与抗原高亲和力结合的特性。与常规抗体相比,纳米抗体在功能上具有独特的性质,例如:由于纳米抗体缺少常规抗体的Fc段,因此能避免产生补体反应;可以在大肠杆菌或酵母中生产,生产成本低[7];同时具有高水溶性、高稳定性、高抗原结合性、低免疫原性、较强的组织穿透力等优点[8-11]。因此,纳米抗体的出现为替代传统的单抗提供了理想选择。2017年,靶向PD-L1的纳米抗体KN035被FDA批准临床研究,次年,首个治疗成人获得性血栓性血小板紫癜(aTTP)纳米抗体Caplacizumab获得批准在欧盟上市。
本实验以VEGF为靶点,通过免疫羊驼,构建噬菌体文库,并从文库中筛选到VEGF纳米抗体基因VHH片段。再通过重组构建表达质粒将筛选到的基因在大肠杆菌中表达,以期获得VEGF的纳米抗体(NbVEGF)蛋白,检测和筛选对抗原VEGF具有特异性和亲和力的纳米抗体,可为进一步开发检测和治疗相关疾病的抗体药物奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒、抗原和菌株
噬菌体质粒pComb3X和表达质粒pNCS均购自Allele Biotechnology and Pharmaceuticals公司,E.coliDH5α和XL1-blue购自上海Novagen公司。anti-flag-HRP抗体和VEGF抗原人源化VEGFmAb购自美国Sigma公司。
1.1.2 相关试剂与仪器
TaqDNA聚合酶购自美国NEB公司,T4DNA连接酶、核酸限制性内切酶和DNA Maker均购自日本TaKaRa公司,蛋白Marker(10~170 kDa)、牛血清白蛋白(BSA)购自上海Roche公司,脱脂奶粉、酵母提取物、胰蛋白胨购自英国OXOID公司,5 mL XK16/20型Ni亲和层析柱购自美国GE公司。
1.2 方法
1.2.1 免疫羊驼
在羊驼颈部皮下分4次多点注射VEGF抗原,两周一次,每次注射抗原250 μg。免疫前一周和末次免疫两周后,对羊驼进行颈静脉采血5 mL,3 500 r/min离心15 min,取上层血清于洁净的EP管中,用VEGF抗体进行滴度检测。对末次免疫两周后的羊驼采血100 mL,用于分离外周血淋巴细胞;提取外周血淋巴细胞总RNA,使用AMV First Strand cDNA Synthesis Kit将所提取的RNA逆转录为cDNA。
1.2.2 VHH基因片段的扩增
引物设计:以羊驼重链可变区前导肽的保守序列设计上游引物,再以羊驼两种亚型IgG铰链区的特异氨基酸序列设计下游引物,序列如表1所示。PCR产物和pComb-3X载体使用SfiⅠ内切酶进行酶切后进行连接,并使用该引物验证载体构建的正确性。

表1 VHH基因片段的扩增的引物序列Table 1 Primers for the amplification of VHH gene fragments
1.2.3 噬菌体文库的制备和淘洗
采用电转法将pComb-3X-VHH载体转入大肠杆菌XL1-blue内,并加入辅助噬菌体VCSM13过夜培养后于4 ℃,3 000g离心15 min。将上清转移至含有4% PEG-8 000和3% NaCl的50 mL离心管中,涡旋混匀,并于4 ℃孵育30 min,用于沉淀噬菌体。
用三乙醇胺缓冲盐水溶液(TBS)稀释VEGF抗原至10 μg/mL,以100 μL/孔加入96孔酶标板内,于4 ℃过夜包被。拍干包被液,用0.05% PBST洗板,之后用5%脱脂牛奶封闭。将噬菌体文库制备液加入包被有抗原的孔和阴性对照孔中,37 ℃放置2 h。
对于入库滴度的计算,将所制备好的噬菌体文库制备液梯度稀释10-8倍,取1 μL感染200 μL的XL1-blue菌液,室温孵育15 min。然后取100 μL被感染的菌液涂布于LB+Carbe平板,于37 ℃过夜培养。文库大小=(克隆数×培养体积)/涂板体积。
1.2.4 NbVEGF在大肠杆菌中的表达
将PCR纯化后的产物和经改造后的pNCS的质粒(在C端添加flag-tag和N端添加His-tag融合标签蛋白基因)分别用BamHⅠ和XhoⅠ双酶切后,以T4DNA连接酶于16℃连接过夜;连接产物转化至E.coliDH5α。提取质粒进行双酶切鉴定,将阳性重组质粒送至生工生物工程(上海)进行测序。构建正确的重组质粒并命名为pNCS-NbVEGF。
将重组质粒转化至E.coliDH5α,在含100 μg/mL氨苄青霉素(Amp)的细菌基础培养基(LB)平板上37 ℃培养过夜。挑取阳性克隆,接种至LB(含100 μg/mL Amp),37 ℃振荡培养至600 nm吸光度为1.4,离心收集菌体,进行聚丙烯酰胺凝胶电泳(SDS-PAGE),随后采用蛋白质印迹法(Western blot)分析:将SDS-PAGE跑胶的分离胶切下,350 mA,转膜30 min至与分离胶同等大小的硝酸纤维素膜上,然后用5%脱脂牛奶封闭硝酸纤维素膜1 h,按照1:10 000稀释比加入anti-flag-HRP抗体至硝酸纤维素膜再孵育1 h,最后滴加ECL显色液显色。同时重悬菌体至均质,加入1%的100 mmol 的蛋白酶抑制剂(PMSF)并混匀,冰浴超声波破碎后离心,分别收集上清、沉淀进行SDS-PAGE检测分析。
1.2.5 目的蛋白的纯化
以镍NTA(Ni-NTA)亲和层析介质为介质装柱,5~10倍柱床体积的1×PBS缓冲液(pH=7.4)平衡,0.45 μm过滤膜过滤后的破菌液上清上样,90 mmol/L咪唑洗脱杂蛋白,300 mmol/L咪唑洗脱目的蛋白,收集洗脱峰。SDS-PAGE蛋白电泳检测目的蛋白的分子质量及纯度。
1.2.6 ELISA检测目的蛋白的抗原结合
使用酶联免疫吸附试验(ELISA)检测目的蛋白的特异性,简要步骤如下:将稀释至0.5 μg/mL的抗原(VEGF和TNF-α、FGF-2、BSA、Milk)加入96孔酶标板中包被过夜后,加入5%的脱脂牛奶37 ℃恒温封闭2 h后,加入300 ng/mL的NbVEGF蛋白,以VEGFmAb为阳性对照,以PBS为空白对照组,37 ℃恒温孵育1 h后加入1 μg/mL anti-flag-HRP抗体,37 ℃孵育1 h后,加入3,3′,5,5′-四甲基联苯胺(TMB)显色液,37 ℃避光孵育15 min。加入2.29%硫酸终止反应,最后用酶标仪检测在405 nm和630 nm的吸光度。
2 结果分析
2.1 羊驼免疫前后血清中VEGF抗体滴度的检测
以VEGF为抗原,分别检测免疫前(Pre)和最终免疫后(Imn)羊驼血清中针对VEGF抗原的特异性抗体水平变化,结果如图1所示。与免疫前相比,羊驼免疫后体内的VEGF特异性抗体滴度有所增加。说明VEGF免疫羊驼后,羊驼体内产生了一定浓度的针对VEGF抗原的特异性抗体。

图1 羊驼免疫前后血清中VEGF抗体滴度的检测Fig.1 Titer of antibody in llama immunized with VEGF
2.2 羊驼VHH基因的扩增
提取羊驼外周血淋巴细胞的总RNA,经过逆转录反应,合成cDNA,并以此为模板,根据羊驼重链可变区的前导肽保守序列设计上游引物F-primer,以羊驼两种亚型IgG铰链区的特异氨基酸序列设计下游引物R-primer 1和R-primer 2,采用PCR法扩增羊驼两种亚型重链抗体的VHH片段,将VHH基因和噬菌体载体pComb-3X用SfiⅠ内切酶进行单酶切后进行连接,构建pComb-3X-VHH载体。pComb-3X-VHH酶切后,收集酶切产物,使用VHH的特异性引物进行PCR鉴定,结果如图2所示。载体双酶切大小为4 991 bp(泳道1-4),目的基因大小约为350~400 bp(泳道5-8),均与理论值相符,经测序后,表明质粒构建成功。

图2 噬菌体载体pComb-3X酶切和VHH PCR验证Fig.2 pComb-3X digestion and VHH PCR verification
2.3 噬菌体文库的筛选
采用电转法将pComb-3X-VHH载体转入大肠杆菌XL1-blue内构建噬菌体文库,并利用VEGF抗原进行淘洗。经过3轮淘洗,噬菌体的滴度得到了显著富集(见图3)。从第3轮淘洗的细菌平板上随机挑取80个单克隆,经过扩增后,收集噬菌体液。以TBS作为阴性对照,用ELISA方法初步检测噬菌体单克隆与VEGF的结合能力。当噬菌体单克隆与VEGF结合的吸光度为阴性对照吸光度3倍及以上时,可认为该噬菌体对VEGF具有高亲和力,界定为阳性克隆;在该实验中获得了30个初步鉴定为阳性克隆。最后,经过单克隆测序获得10个阳性抗体单克隆,分别为NbVEGF-1、NbVEGF-2、NbVEGF-3、NbVEGF-4、NbVEGF-5、NbVEGF-6、NbVEGF-7、NbVEGF-8、NbVEGF-9、NbVEGF-10。

第1轮淘洗 第2轮淘洗 第3轮淘洗图3 噬菌体文库的淘洗Fig.3 Panning of phage library
2.4 NbVEGF蛋白的理化性质预测
通过测序获得了以上10个抗体的基因序列,并推导出其蛋白序列。利用软件ExPASy对10个NbVEGF纳米蛋白序列的分子质量、理论等电点(pI)和总亲水性平均系数(GRAVY)进行分析。如表2所示,10个NbVEGF蛋白分子质量在20.1~20.7 kDa之间,符合纳米抗体分子质量的特点;理论等电点均低于7,在5.76~6.49之间,表明NbVEGF在生理环境中带负电荷,与VEGF发生结合反应可能是通过静电作用实现的。10个NbVEGF蛋白的GRAVY值均为负值,表明NbVEGF蛋白为亲水性蛋白质。

表2 NbVEGF蛋白的理化性质Table 2 Physicochemical properties of NbVEGF protein
2.5 NbVEGF纳米抗体在大肠杆菌中的表达
以上10个VHH片段基因与表达质粒pNCS质粒(在C端添加Flag-tag和N端添加His-tag融合标签蛋白基因)连接构建重组质粒。重组质粒经PCR(见图4(a))和双酶切(见图4(b))鉴定,条带大小符合预期,且测序结果与预期一致,证明质粒构建成功。

图4 重组质粒pNCs-NbVEGF的构建Fig.4 Construction of recombinant plasmid pNCs-NbVEGF
收集表达的菌体经离心、超声破菌后,SDS-PAGE电泳分析全菌液、上清、沉淀,NbVEGF蛋白大部分都表达在上清液中,即所有抗体都是可溶性表达,这有利于后期的蛋白纯化。重组pNCS-NbVEGF表达载体转入至E.coliDH5α培养后,收集菌体,超声破碎后,离心取上清,经SDS-PAGE电泳及Western blot分析,结果表明:10个单克隆菌株均有表达,蛋白条带大约在20 kDa,与预期的NbVEGF蛋白分子质量一致,但几个抗体的表达量存在差异(见图5)。

图5 重组表达的NbVEGF的SDS-PAGE电泳及Western blot结果分析Fig.5 SDS-PAGE electrophoresis and Western blot result analy-sis of NbVEGF
2.6 NbVEGF蛋白的纯化
将10种菌体破碎后,收集上清。因为抗体的N端连有His标签,因此采用Ni柱亲和层析进行蛋白纯化。SDS-PAGE蛋白电泳如图6所示,10个NbVEGF蛋白经亲和纯化后,目的蛋白得到富集,纯度均大于80%。

图6 纯化后的NbVEGF蛋白Fig.6 Purified NbVEGF proteins
2.7 NbVEGF蛋白的抗原结合
以VEGF为目的抗原,血清白蛋白(BSA)、成纤维细胞生长因子-2(FGF-2)、肿瘤坏死因子-α(TNF-α)、牛奶(Milk)作为对照抗原,VEGFmAb为阳性对照,PBS为空白对照,采用ELISA检测10个NbVEGF蛋白与抗原的结合能力。结果表明:在10个纳米抗体蛋白中,NbVEGF-3、NbVEGF-7、NbVEGF-10均具有与VEGF抗原的结合特异性,与4个其他对照抗原特异结合能力弱或不结合,其他纳米抗体蛋白则无抗原特异性。其中NbVEGF-3与VEGF抗原的结合能力最强(见图7),与阳性对照亲和力相似。
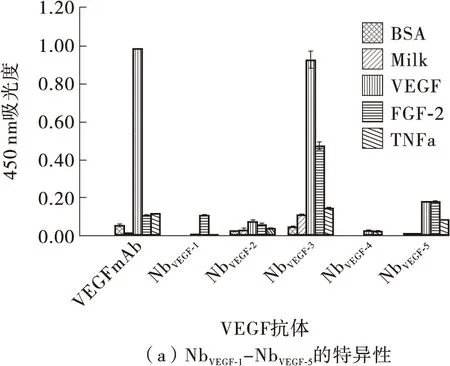
图7 NbVEGF蛋白的特异性Fig.7 Specificity of NbVEGF proteins
3 讨论
因具有独特的生物和生化特性,纳米抗体应用前景广阔。研究表明,纳米抗体能与免疫原蛋白、酶、毒素和半抗原等多种抗原类型结合[12],可用于蛋白质、微生物、小分子的检测,在生物医药和环境监测等多个领域可发挥作用[7]。如Qiu等[13]利用噬菌体展示技术建立了一种可以特异性检测Cry1Ab毒素的纳米抗体,该纳米抗体可用于转基因生物的分析。纳米抗体也可用于甲氨蝶呤[14]和偶氮酮[15]等小分子的检测。另一方面,纳米抗体还可用于疾病治疗和病原体防御。如对抗病毒,纳米抗体在病毒复制中的附着、进入、脱壳各阶段均能发挥作用[16]。由于纳米抗体具有特异性好、良好的组织透过性以及能快速清除、副作用小的优点,其在肿瘤治疗方面具有独特的优势。
肿瘤与血液供应之间的联系最早提出在100多年前[17],但直到1939年,人们才假设肿瘤细胞本身会释放一种与肿瘤快速增长相关的血管生长刺激因子[18]。1989年,血管内皮生长因子A(VEGFA)的分离和克隆,是了解血管生成机制的重要一步[19-20]。近年来,研究表明胚胎血管生成、骨骼生长和软骨形成、卵巢血管生成均与VEGF有关[21]。因此,抑制VEGF的活性是治疗许多血管形成性相关疾病的关键,例如,Kim等[22]证明抗VEGF抗体能在裸鼠体内抑制肿瘤细胞的增殖;Paul等[23]发现通过抑制Src家族的活性间接抑制VEGF介导的血管通透性从而能防止野生型大鼠出现脑损伤。而在眼科疾病治疗方面,据MARINA和ANCHOR研究数据显示,年龄相关性黄斑变性(AMD)患者连续服用抗VEGF的雷珠单抗12个月后,可恢复7-11个字母的视力,40%以上患者可恢复15个字母的视力[24]。目前,能有效抑制VEGF活性的药物有:VEGF抑制剂、单克隆抗体和抗体片段[25]。1993年,Kim等[22]发现了能靶向和中和VEGFA并抑制肿瘤生长的单克隆抗体,随后首个人源化VEGF特异性单克隆抗体bevacizumab在2004年被美国FDA批准用于转移性结直肠癌治疗。2006年,哌加他尼和雷珠单抗获得FDA批准治疗AMD[26-27]。虽然VEGF单克隆抗体bevacizumab能对肿瘤有治疗效果,但是其起效维持时间短[28],且其在实体组织的穿透率低,分布不对称,导致临床上靶向肿瘤不恰当[29];此外,bevacizumab会引起很多不良反应,在早期对多种癌症类型使用bevacizumab的研究建立了一组由抗血管生成治疗引起的不良事件(AEs),其中记载的毒性最大的是高血压,在患者中占比高达36%[30]。另外,其他患者出现蛋白尿、直肠出血和泪目障碍等副作用[31-32]。与常规的抗体相比,纳米抗体具有体积小,高亲和力等优点,是作为抗VEGF研究的理想材料;但迄今为止,抗VEGF的纳米抗体仍未问世。因此,抗VEGF的纳米抗体的研究具有十分重要的意义。
4 结语
通过用VEGF免疫羊驼,抽取外周血构建了VEGF的纳米抗体噬菌体库,并筛选获得10株与VEGF有亲和力的VHH片段基因。进一步在大肠杆菌中重组表达该10个纳米抗体获得VEGF纳米抗体蛋白,经理化性质预测和实验验证了其与VEGF特异性的亲和,获得了3个具有VEGF结合特异性的纳米抗体,其中1个具有较高的抗原亲和力。这为将来进一步进行VEGF纳米抗体的研发奠定了基础。接下来应进一步地探究这3个纳米抗体NbVEGF的稳定性和对血管形成的抑制作用等生物活性,以及更深入地研究纳米抗体的肿瘤治疗及眼内新生血管综合症和脑水肿等疾病的疗效。
