氯沙坦及雷公藤多苷对贝伐珠单抗诱导的小鼠蛋白尿的影响及其相关机制的研究
2020-11-02陈文彬
陈文彬,张 楠,谢 凤,王 颖
0 引言
贝伐珠单抗(Bevacizumab,BEV)作为针对血管内皮生长因子(Vascular endothelial growth factor,VEGF)的抗肿瘤药物,通过与VEGF特异性结合阻碍VEGF与其受体在内皮细胞表面相互作用,抑制血管生成,从而发挥抗肿瘤作用。它被广泛用于治疗各种恶性肿瘤,如结直肠癌[1-3]、转移性肾细胞癌[4]、非小细胞肺癌[5]及卵巢癌[6]等。但高血压、蛋白尿、出血和血栓性静脉炎是BEV比较常见的不良反应[7]。BEV相关蛋白尿尚无有效预防及治疗方法,其是否会影响患者的肾功能仍有争议,对于应用BEV出现严重蛋白尿的患者,一般采取停止使用BEV,但这样会影响其临床治疗效果。多项研究证实,血管紧张素Ⅱ受体拮抗剂及中药雷公藤多苷具有改善肾小球足细胞的裂隙膜蛋白、稳定足细胞的细胞骨架、维持肾小球滤过屏障、减少尿蛋白泄漏的作用[8-10]。借鉴已有研究,笔者将其移植到BEV不良反应蛋白尿的研究之中。本研究观察氯沙坦及雷公藤多苷对BEV相关小鼠肾损伤的预防性保护作用并探索其可能的作用机制,为治疗BEV导致的蛋白尿提供有益的探索和帮助。
1 资料与方法
1.1 药物与试剂 贝伐珠单抗注射液,规格:每瓶4 ml/100 mg,进口药品注册证号:S20120068,购自瑞士罗氏制药公司;氯沙坦钾片(Losartan potassium tablets),规格:每片50 mg,国药准字:J20130148,购于杭州默沙东制药有限公司;雷公藤多苷片(Tripterygium glycosides tablets),规格:每片10 mg,国药准字:Z31020415,购于上海复旦复华药业有限公司;兔抗鼠VEGF、nephrin、podocin单克隆抗体购自美国Abcam公司;GAPDH一抗购于proteintech公司;免疫组化EliVision检测试剂盒购于福州迈新生物技术开发有限公司。
1.2 仪器 电子分析天平购于上海梅特勒-托利多;生物显微镜购于日本Nikon;高压灭菌器购于日本三洋;生物组织包埋机购于德国Leica;石蜡切片机购于德国美康;多功能酶标仪购于美国BioTek。
2 方法与结果
2.1 实验动物 SPF级ICR雄性小鼠,6~8周龄,体重18~22 g(小鼠饲养于中国医科大学实验动物部SPF级动物房),购于辽宁长生实验动物有限公司,动物生产许可证号:SCXK(辽)2015-0001。自由采食及饮水。
2.2 方法
2.2.1 肾损伤模型的建立 将24只ICR小鼠适应性喂养1周,随机分为4组:对照组,尾静脉注射同体积生理盐水;BEV低剂量组,尾静脉注射BEV 10 mg/(kg·w);BEV中剂量组,尾静脉注射BEV 35 mg/(kg·w);BEV高剂量组,尾静脉注射BEV 60 mg/(kg·w)。每周根据其体重变化调整用药剂量。4周末(第28天)留取小鼠24 h尿液冷冻保存,测24 h尿蛋白量。然后眼球取血检测生化指标。处死小鼠取其肾组织,进行HE染色,免疫组化法及Western blot法测定肾组织中VEGF、podocin、nephrin蛋白的表达。
4周后,10、35、60 mg/(kg·w)3个阶梯BEV剂量组,中、高剂量组小鼠全部诱导产生蛋白尿,成功建立肾损伤模型。考虑实验周期及实验目的,选取高剂量建立肾损伤模型。
2.2.2 肾损伤模型的建立及给药干预 将42只ICR小鼠适应性喂养1周,随机分为7组。对照组:尾静脉注射同体积生理盐水;BEV组:尾静脉注射BEV 60 mg/(kg·w);LOS1组:尾静脉注射BEV 60 mg/(kg·w),同时灌胃给予氯沙坦5 mg/(kg·d);LOS2组:尾静脉注射BEV 60 mg/(kg·w),同时灌胃给予氯沙坦10 mg/(kg·d);LOS3组:尾静脉注射BEV 60 mg/(kg·w),同时灌胃给予氯沙坦20 mg/(kg·d);TGT组:尾静脉注射BEV 60 mg/(kg·w),同时灌胃给予雷公藤多苷10 mg/(kg·d);联合组:BEV尾静脉注射60 mg/(kg·w),同时灌胃给予氯沙坦及雷公藤多苷各10 mg/(kg·d)。每周根据其体重变化调整用药剂量。4周末(第28天)留取小鼠24 h尿液冷冻保存。然后眼球取血检测生化指标。处死小鼠取其肾组织,进行下一步检测。
2.2.3 24 h尿液总蛋白定量测定 将小鼠放入代谢笼内,收集24 h的尿液(期间禁食,不禁水),测定24 h尿蛋白量。根据试剂盒说明书测定(南京建成生物工程研究所)。
2.2.4 血生化指标检测 根据试剂盒说明书使用全自动多功能生化分析仪测定血肌酐(Cr)、血尿素氮(BUN)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)等生化指标。
2.2.5 光学显微镜观察肾组织病理改变 取部分肾组织标本在4%多聚甲醛中固定,脱水、透明、浸蜡、包埋,常规切片,厚度2 μm。HE染色,在光镜下观察肾组织的病理改变。
2.2.6 免疫组化法观察VEGF、nephrin、podocin分布 将石蜡切片脱蜡,用微波法修复抗原(抗原修复液为柠檬酸盐缓冲液)。按照免疫组化说明书步骤加入一抗(VEGF、nephrin、podocin抗体)4 ℃孵育过夜,DAB显色2~6 min,并用自来水终止显色,最后封片镜检。
2.2.7 Western blot法测定肾组织中VEGF、podocin、nephrin蛋白的表达 适量肾组织加入裂解液匀浆,离心,取上清液测蛋白浓度,样品电泳后转膜,5%脱脂奶粉-TBST溶液室温下封闭2 h,洗膜后加入一抗(VEGF、nephrin、podocin抗体),4 ℃孵育过夜,洗膜后HRP标记山羊抗兔二抗室温孵育1 h,滴加ECL发光液反应2 min。以GAPDH作为内参,使用凝胶成像系统分析结果,内参与所测蛋白的比为该蛋白的相对值。
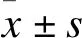
2.3 结果
2.3.1 干预对24 h尿液总蛋白量的影响 如图1所示,BEV组尿蛋白水平明显高于对照组,差异有统计学意义(P<0.001)。与BEV组相比,LOS1组、LOS2组、LOS3组、TGT组、联合组尿蛋白量明显降低,差异有统计学意义(P<0.05);联合组较LOS2组和TGT组相比也明显降低,差异有统计学意义(P<0.001)。
图1 各组小鼠24 h尿蛋白的变化注:与对照组比较,###P<0.001;与BEV组比较,*P<0.05,***P<0.001;与LOS2组比较,▲▲▲P<0.001;与TGT组比较,△△△P<0.001
2.3.2 各组小鼠血生化分析 各组小鼠ALT、AST、BUN、Cr比较差异无统计学意义(P>0.05)。见表1。
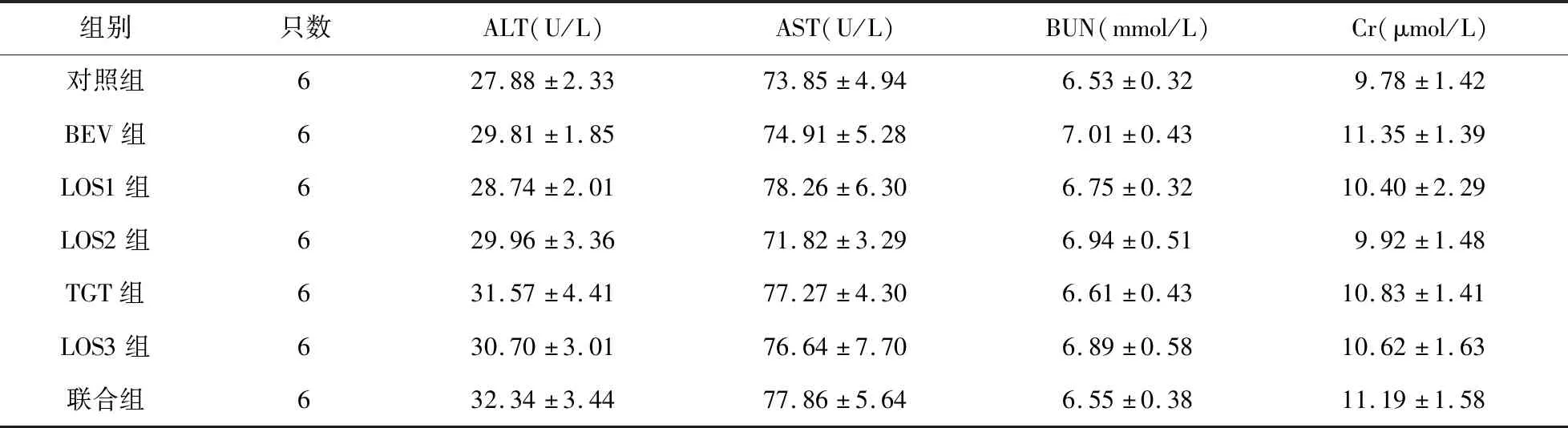
表1 各组小鼠血生化指标比较
2.3.3 光学显微镜观察肾组织病理改变 如图2示,光镜下对照组小鼠肾小球结构正常;BEV组小鼠肾小球内皮细胞出现萎缩、空泡状改变;与BEV组相比,LOS1组肾小球结构轻微损伤,LOS2组、TGT组、LOS3组、联合组肾小球结构均无明显损伤改变。
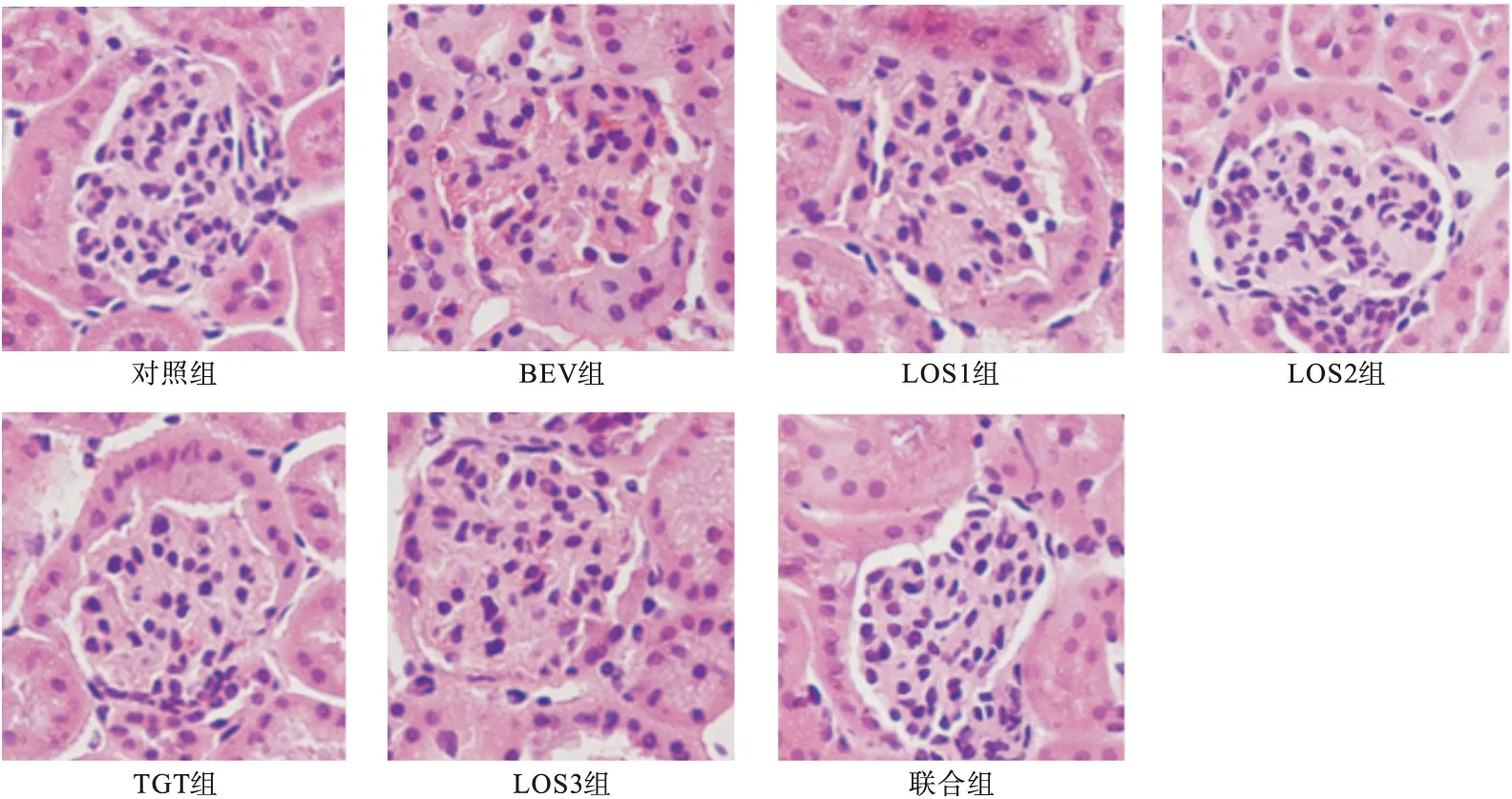
图2 各组小鼠肾组织病理改变(HE,400×)
2.3.4 免疫组化法观察VEGF、nephrin、podocin分布 光镜下观察并以染色强度与肾小球阳性细胞百分比综合计分进行半定量分析,以PBS液代替一抗作为阴性对照。切片中胞质染为淡黄色至棕褐色者为阳性细胞标志。染色强度以多数细胞呈现的染色特性(染色深浅需与背景着色相对比)计分:无着色0分,淡黄色1分,棕黄色2分,棕褐色3分。阳性细胞百分比计算方法为每个视野下阳性细胞面积占总面积的比例:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。每张切片400×镜下随机选取5个肾小球,将每个肾小球进行染色强度计分与阳性细胞面积百分比计分,最后计算出5个肾小球平均阳性细胞面积百分比。染色强度与阳性细胞百分比的乘积:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
免疫组化结果见图3~图5。结果表明,对照组、LOS3组、联合组小鼠肾组织VEGF、podocin、nephrin蛋白的表达均呈现出强阳性,BEV组和LOS1组小鼠肾组织VEGF、podocin、nephrin蛋白的表达呈现出弱阳性或阴性,TGT组和LOS2组小鼠肾组织VEGF、podocin、nephrin蛋白的表达呈现出中强阳性。

图3 各组小鼠肾组织VEGF蛋白表达(免疫组化结果,400×)

图4 各组小鼠肾组织podocin蛋白表达(免疫组化结果,400×)

图5 各组小鼠肾组织nephrin蛋白表达(免疫组化结果,400×)
2.3.5 Western blot法测定小鼠肾组织中VEGF、podocin、nephrin蛋白的表达 如图6~图7所示,BEV组较对照组VEGF、podocin、nephrin蛋白的表达明显下降,差异均有统计学意义(P<0.001)。LOS1组、LOS2组、LOS3组、TGT组、联合组蛋白表达比BEV组明显上调,差异有统计学意义(P<0.05);联合组蛋白表达明显高于LOS2组和TGT组,差异有统计学意义(P<0.05)。
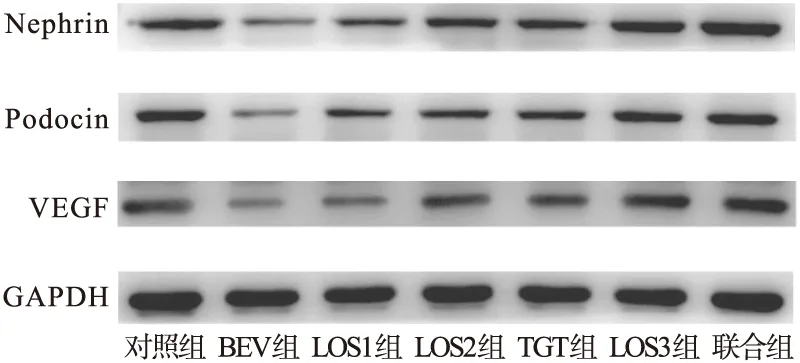
图6 Western blot法检测各组小鼠VEGF、podocin、nephrin蛋白表达

图7 各组小鼠VEGF、podocin、nephrin蛋白表达注:A.VEGF蛋白,B.podocin蛋白,C.nephrin蛋白。与对照组比较,###P<0.001;与BEV组比较,**P<0.01,***P<0.001;与LOS2组比较,▲P<0.05,▲▲P<0.01;与TGT组比较,●P<0.05,●●P<0.01
3 讨论
肿瘤血管生成是肿瘤生长和转移的关键过程,并受促血管生成因子和抗血管生成因子的平衡调节,其中VEGF是关键的血管生成因子。而且肿瘤组织中VEGF表达的强度和高血管密度与多种类型肿瘤的预后不良有关[11-13]。足细胞分泌的VEGF在肾小球发育、维持肾小球结构和功能完整中发挥重要作用。在生理范围内足细胞分泌的VEGF增加可中止由足细胞损伤引起的肾小球发育恶化[14]。肾脏中VEGF的逐渐耗竭会导致蛋白尿和肾小球透水性增加[15],证明BEV(针对所有形式VEGF的抗体)可导致肾损伤。蛋白尿作为BEV比较常见的不良反应之一,研究显示其具有剂量依赖性[16],且发生率也与肿瘤的类型有关,非小细胞肺癌患者蛋白尿的发生率低于结直肠癌患者[17]。
根据相关BEV的实验研究[18-21]及其临床使用剂量,在实验中设置3个阶梯BEV剂量4周后,中、高剂量组小鼠全部诱导产生蛋白尿,成功建立肾损伤模型,考虑实验周期选取BEV尾静脉注射60 mg/(kg·w)。
目前,研究认为,BEV相关蛋白尿与足细胞表面的蛋白分子表达异常有关(如nephrin、podocin、CD2A)[18-19]。Nephrin和podocin位于足细胞足突之间的裂隙隔膜(SD)处,是肾小球滤过屏障形成和功能维持所必须的[22-23]。因此,我们评估了使用BEV后小鼠肾脏中这2种蛋白表达的变化,发现其表达水平与蛋白尿水平之间呈负相关。证明BEV可降低足细胞VEGF的表达,下调nephrin、podocin的表达,破坏肾小球滤过屏障,导致蛋白尿,且具有剂量相关性。HE结果也显示了BEV导致肾小球内皮细胞萎缩、空泡状改变等病理变化。尽管蛋白尿被认为是可能导致肾功能受损的因素,但各组小鼠的血生化指标无显著差异,表明BEV诱导的足细胞损伤短期不至于引起明显的肾功能变化。
蛋白尿在一定程度上限制了BEV临床使用,无论是其发生机制和预防处理,目前国内外研究均较少,需要研究加以解决。多数研究表明,中药如雷公藤多苷、血管紧张素受体阻断剂(ARB)在肾小球肾病、糖尿病肾病的临床治疗中有确切疗效。雷公藤多苷具有免疫抑制、抗炎、抗癌[24]和修复足细胞损伤,增加nephrin、podocin表达,改善由BEV诱导的足细胞损伤的作用[20,25]。ARB可能通过增加由足细胞等产生的VEGF表达来促进肾小球修复[26]。阿西替尼诱导的大鼠蛋白尿与nephrin和podocin的下调相关,预防性给予坎地沙坦可以减轻蛋白尿及上调nephrin和podocin的表达[21]。而且有研究显示,雷公藤多苷和ARB协同可有效治疗2型糖尿病蛋白尿[27]。但关于二者治疗BEV诱导的蛋白尿的研究比较有限。
在使用BEV治疗的恶性肿瘤患者中维持肾功能是有利的,可以延长治疗时间。因此,我们进一步评估了预防性给予氯沙坦及雷公藤多苷对BEV引起的潜在肾损害的影响。光镜下HE及24 h蛋白尿结果显示,随着氯沙坦剂量增加及TGT联合用药,显著减轻了BEV导致的肾损伤。免疫组化及Western blot等结果提示,随着氯沙坦剂量及联合用药上调VEGF、nephrin、podocin蛋白表达,且肾组织损伤改善程度与氯沙坦剂量呈正相关。联合组VEGF、nephrin、podocin蛋白表达比LOS1组和TGT组上调,表明两者联合用药减轻BEV诱导的蛋白尿的疗效显著优于其任一单药,两者具有协同作用。本实验证明,LOS及TGT是治疗BEV相关蛋白尿的有效药物,为临床治疗提供了思路。本研究想法来源于临床实践,为克服贝伐珠单抗的不良反应,本研究只是一种尝试和探索,未来还需要在临床上开展相应的研究。
