冰片配伍黄芪甲苷和三七总皂苷对大鼠脑缺血再灌注损伤神经元的保护作用
2020-11-02欧阳波刘晓丹杨筱倩黄小平邓常清
欧阳波,刘晓丹,杨筱倩,丁 煌,唐 三,黄小平*,邓常清*
(湖南中医药大学分子病理实验室,中西医结合心脑疾病防治湖南省重点实验室,细胞生物学与分子技术湖南省高校重点实验室,湖南 长沙410208)
缺血性脑卒中是严重威胁人类生命健康的疾病,具有高致病率、高致残率和高致死率的特点。中医认为缺血性脑卒中的主要病机是气虚血瘀。中药黄芪配伍三七具有补气活血的功效,能针对脑缺血的主要病机发挥药理作用,是治疗缺血性脑卒中的常用中药。现代药理学研究表明,黄芪的主要有效组分是黄芪甲苷(astragaloside Ⅳ, AST Ⅳ)[1],三七的主要有效组分是三七总皂苷(panax notoginseng saponins, PNS)[2]。在中药复方有效组(成)分配伍研究模式指导下,课题组前期研究表明,AST Ⅳ配伍PNS 可以通过多环节、多靶点机制发挥抗脑缺血作用[3-4]。但是,在脑组织和外周血液之间存在一个复杂的细胞结构屏障——血脑屏障(blood-brain barrier, BBB)。BBB 控制脑脊液与血液之间的物质转运,虽然能阻止大分子有害物质进入脑组织,但是也限制了大分子药物进入脑内发挥药理作用。AST Ⅳ及PNS 相对分子量均较大,难以透过BBB进入脑组织,这就限制了其发挥药理作用。冰片可“引药上行”,能促进一些大分子药物透过BBB[5]。我们以往的研究表明,冰片与AST IV、PNS 配伍后,能促进AST IV 及PNS 的主要成分人参皂苷Rb1、Rg1 和三七皂苷R1 向大脑皮层富集,尤其是向脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)侧大脑皮层富集[6]。进一步研究表明,冰片配伍AST IV 和PNS 不但不增加脑缺血后BBB 的通透性,反而对受损BBB 具有保护作用,其促进药物透过BBB的作用是通过抑制BBB 上药物转运相关的外排蛋白、促进药物摄取蛋白表达而促进药物进入脑组织[7]。以上研究提示冰片配伍AST Ⅳ和PNS后可促进药物透过BBB 入脑,更好地发挥抗脑缺血的作用。本文进一步研究冰片配伍AST Ⅳ和PNS对脑缺血后神经元的保护作用,从而为其合理应用与开发提供实验依据。
1 材料与方法
1.1 动物
雄性SPF 级SD 大鼠,体质量240~260 g,由湖南斯莱克景达实验动物有限公司提供,动物生产合格证号:43004700037715。饲养于湖南中医药大学动物实验中心,场地许可证号:SKY(湘)2013-0005。 实验前适应性喂养5~7 d,给药前禁食12 h,自由饮水。 动物的使用符合科技部《关于善待实验动物的指导性意见》相关规定。
1.2 主要药物
冰片(左旋龙脑,主要成分为1,7-三甲基-二环庚-2-醇,含量86%,购自湖北俊辉有限公司,批号:20170815);AST Ⅳ(纯度≥98%,批号:MUST-17022804)、PNS(纯度≥98%,批号:MUST-17060601)均购自成都曼思特生物科技有限公司,用时以0.5%羧甲基纤维素钠配成混悬液。 依达拉奉注射液(3-甲基-1-苯基-2-吡唑啉-5 酮)购自南京先声东元制药有限公司,批号:80-090104,规格10 mg/支(5 mL),用时以生理盐水配成0.4 mg·mL-1溶液备用。
1.3 主要试剂
甲苯胺蓝染液(谷歌生物,批号G1032);小鼠抗大鼠神经丝蛋白200(neurofilament-200, NF-200)单克隆抗体(美国CST 公司,批号2836);小鼠抗大鼠αII-血影蛋白(αII-Spectrin, αII SP)单克隆抗体(美国Abcam 公司,批号ab11755);兔抗大鼠β-actin多克隆抗体(美国ABclonal 公司,批号A7248);HRP标记的山羊抗兔二抗(美国Proteintech 公司,批号SA00001-2);HRP 标记的山羊抗小鼠二抗(美国ABclonal公司,批号AS003);Cy5 标记山羊抗小鼠IgG(谷歌生物,批号GB27301);DAPI 染色液(北京鼎国昌盛生物科技有限公司,批号GD3410);RIPA 蛋白裂解液(康为世纪生物科技有限公司,批号CW2333);蛋白酶抑制剂混合物(批号P1005)、磷酸酶抑制剂混合物A(批号P1082)(碧云天生物技术有限公司);ECL 化学发光液(北京鼎国昌盛生物科技有限公司,批号GE2301);蛋白Marker(美国Thermo-fisher公司,批号515683);BCA 蛋白定量试剂盒(北京中杉金桥生物技术有限公司,批号K176810E)。
1.4 主要仪器
BX51 光学显微镜(日本Olympus 公司);Nikon Eclipse C1 正置荧光显微镜、Nikon DS-U3 成像系统(日本Nikon 公司);EG1160 组织病理包埋仪(德国leica 公司);Chemi-DoC-XRS+化学发光成像分析仪、041BR132283 电泳/转膜装置(美国Bio-Rad 公司);ELX800 多功能酶标仪(美国Biotek 公司)。
2 方法
2.1 动物分组与给药
根据以往研究[8],将动物随机分为假手术组、模型组、冰片组(7.5 mg·kg-1)、AST Ⅳ组(10 mg·kg-1)、PNS 组(25 mg·kg-1)、AST Ⅳ+PNS 组(AST Ⅳ10 mg·kg-1+PNS 25 mg·kg-1)、低剂量组(冰片7.5 mg·kg-1+AST Ⅳ10 mg·kg-1+PNS 25 mg·kg-1)、高剂量组(冰片15 mg·kg-1+AST Ⅳ20 mg·kg-1+PNS 50 mg·kg-1)、依达拉奉组(4 mg·kg-1)。 冰片、AST Ⅳ、PNS 及其配伍各组于造模前3 d 灌胃给药,每日2 次,同时腹腔注射等量生理盐水。依达拉奉组腹腔注射给药,同时灌胃等量0.5%羧甲基纤维素钠,每日2 次。假手术组和模型组以0.5%羧甲基纤维素钠10 mL·kg-1剂量灌胃给药,同时腹腔注射等量生理盐水,每日2 次。末次给药后2 h 造模。 缺血2 h 后进行再灌注,再灌注期间同前给药,再灌注后22 h 进行检测。
2.2 右侧大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)制备大鼠CIRI 模型
按以往方法[3]制作线栓法MCAO 局灶性脑缺血模型,阻断2 h 后,拔出线栓进行再灌注22 h。假手术组不做插线处理,其他操作同模型组。各组纳入Bederson 评分[9]为1~3 分的大鼠,剔除评分为0 分或4 分的大鼠。
2.3 检测指标
2.3.1 神经功能缺损评分 采用Zea Longa 评分法[10]测定神经功能评分。0 分:无明显神经功能缺失症状;1 分:轻度局灶性神经功能障碍(不能完全伸展左侧前肢);2 分:中度局灶性神经功能障碍(行走时向左侧旋转);3 分:重度神经功能障碍(行走时向左侧倾倒);4 分:极重度神经功能障碍(不能自发行走或意识丧失)。
2.3.2 尼氏染色法测定脑组织CA1 区病理形态 再灌注22 h 后,再次麻醉动物,经心脏灌流生理盐水,断头取脑,去除小脑和脑干,4%多聚甲醛固定24~48 h。自视交叉后2~4 mm 处,冠状切取2 mm 厚脑组织(含有海马),常规脱水、二甲苯透明、石蜡包埋,冠状位切片,片厚5 μm。 行尼氏染色:依次将切片放入二甲苯Ⅰ(20 min)、二甲苯Ⅱ(20 min)、无水乙醇Ⅰ(5 min)、无水乙醇Ⅱ(5 min)、75%酒精(5 min),自来水冲洗。 蒸馏水稍洗后,置于1%甲苯胺蓝染液中50~60 ℃浸染30 min。继续蒸馏水稍洗,于95%酒精中迅速分化,使用无水酒精脱水、二甲苯透明、中性树胶封片。按照文献[11]方法,观察缺血侧海马CA1 区,取长度200 μm 海马CA1 区,用ImageJ 图像分析软件计录氏体数量,每张切片计数3 个不重复视野的尼氏体数量,取均值进行分析。
2.3.3 免疫荧光法检测NF-200 蛋白表达 按“2.3.2”项方法制成石蜡切片。将石蜡切片脱蜡至水后置于抗原修复缓冲液中行抗原修复;然后滴加3% BSA孵育30 min;再滴加小鼠抗大鼠NF-200单克隆抗体一抗(1∶500),4 ℃孵育过夜。 滴加HRP标记的山羊抗小鼠二抗(1∶1 000),于室温孵育30 min。滴加Cy5 标记山羊抗小鼠IgG(1∶500)试剂,避光、室温下孵育10 min。滴加自发荧光淬灭剂5 min;最后滴加DAPI 染液,避光、室温下孵育10 min后,用抗荧光淬灭封片剂封片。 置荧光显微镜下观察并采集右脑缺血侧海马CA1 区图像,DAPI 激发为蓝光荧光,CY5 激发为粉色荧光。随机取3 个不重叠高倍视野(×400)拍照。 Nikon DS-U3 图像采集分析系统测定海马CA1 区NF-200 免疫荧光强度,以荧光强度表示蛋白的表达。
2.3.4 Western blot 检测αⅡ-Spectrin 蛋白的表达 取患侧视交叉后2~4 mm 脑组织50 mg,提取总蛋白,BCA 法测定总蛋白量。 每个样本取80 μg 蛋白,100 ℃水浴10 min 使蛋白变性,SDS-PAGE 电泳90 min,200 mA 转膜2 h,5%脱脂牛奶封闭1 h,分别加入小鼠抗大鼠αⅡ-Spectrin 单克隆抗体(1∶1 000)、兔抗大鼠β-actin 多克隆抗体(1∶1 000),于4 ℃孵育过夜,TBST 洗膜3 次。 再分别加羊抗小鼠二抗(1∶8 000)或羊抗兔二抗(1∶5 000),于37 ℃孵育1 h,TBST 洗膜3 次后加ECL 化学发光剂显影。 用Image Lab 图像分析软件测定目的条带的积分光密度值(integral optical density, IOD),以目的条带的IOD 值与β-actin 条带IOD 值的比值作为该目的蛋白相对表达量。
2.4 统计分析
3 结果
3.1 冰片配伍AST Ⅳ和PNS 对神经功能缺损评分的影响
与假手术组比较,模型组大鼠出现神经功能障碍体征,神经功能缺损评分显著升高(P<0.01)。 与模型组比较,AST Ⅳ+PNS 组、低剂量组、高剂量组、依达拉奉组神经功能缺损评分显著降低(P<0.05,P<0.01),冰片组、AST Ⅳ组、PNS 组神经功能缺损评分差异无统计学意义(P>0.05)。与AST Ⅳ组、PNS 组比较,AST Ⅳ+PNS 组神经功能缺损评分差异无统计学意义(P>0.05)。与冰片组、AST Ⅳ组、PNS 组、ASTⅣ+PNS 组比较,低剂量组神经功能缺损评分显著降低(P<0.05 和P<0.01);与冰片组、AST Ⅳ组、PNS 组比较,高剂量组神经功能缺损评分显著降低(P<0.05和P<0.01),但与AST Ⅳ+PNS 组比较差异无统计学意义(P>0.05)。 低剂量组和高剂量组比较,神经功能缺损评分差异无统计学意义(P>0.05)。 见图1。
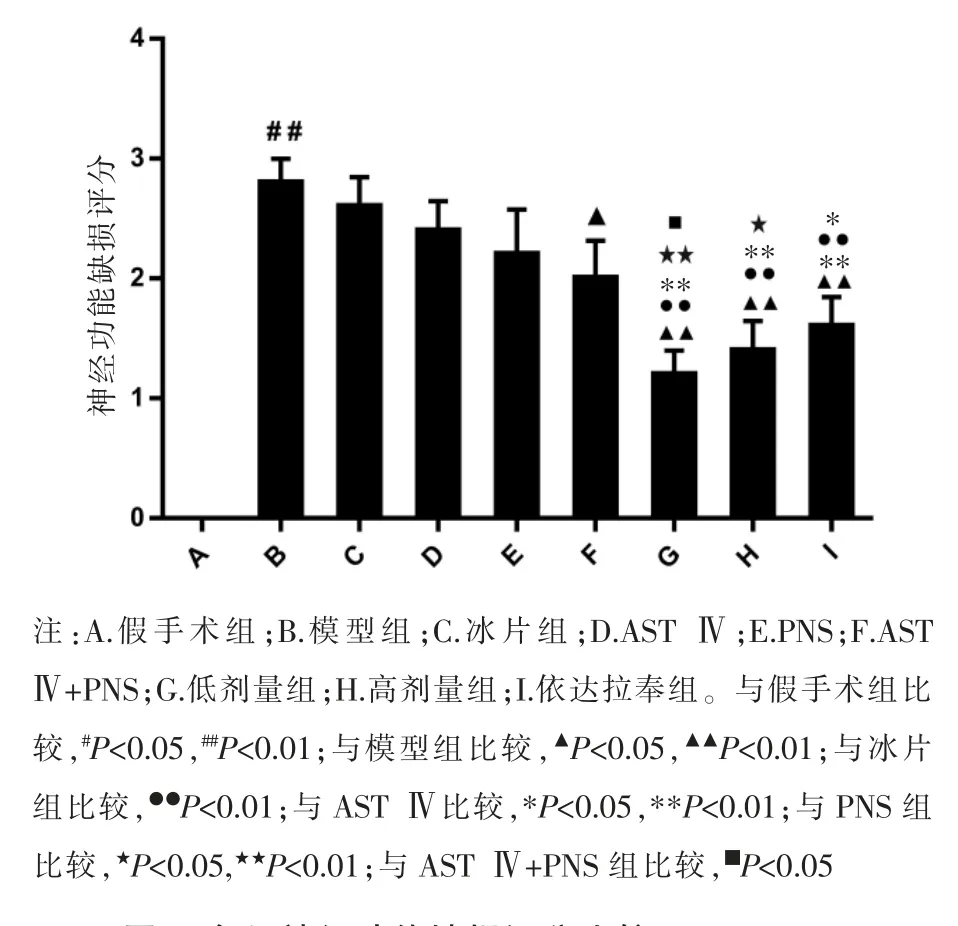
图1 各组神经功能缺损评分比较(±s,n=5)
3.2 冰片配伍AST Ⅳ和PNS 对海马CA1 区尼氏体数量的影响
假手术组海马CA1 区神经元胞质内可见深蓝色斑块状尼氏体。与假手术组比较,模型组尼氏体数量显著减少(P<0.01)。与模型组比较,冰片组、ASTⅣ组、PNS 组、AST Ⅳ+PNS 组、低剂量组、高剂量组、依达拉奉组尼氏体数量显著增加(P<0.01)。 与AST Ⅳ组、PNS 组比较,AST Ⅳ+PNS 组尼氏体数量显著增加(P<0.05 和P<0.01)。与冰片组、AST Ⅳ组、PNS 组和AST Ⅳ+PNS 组比较,低剂量组尼氏体数显著增加(P<0.01)。与冰片组、AST Ⅳ组、PNS 组比较,高剂量组尼氏体数显著增加(P<0.01),但与AST Ⅳ+PNS 组比较,高剂量组差异无统计学意义(P>0.05)。低剂量组和高剂量组比较,尼氏体数量差异无统计学意义(P>0.05)。 见表1 和图2。
表1 各组海马CA1 区尼氏体数量比较(±s,n=5)
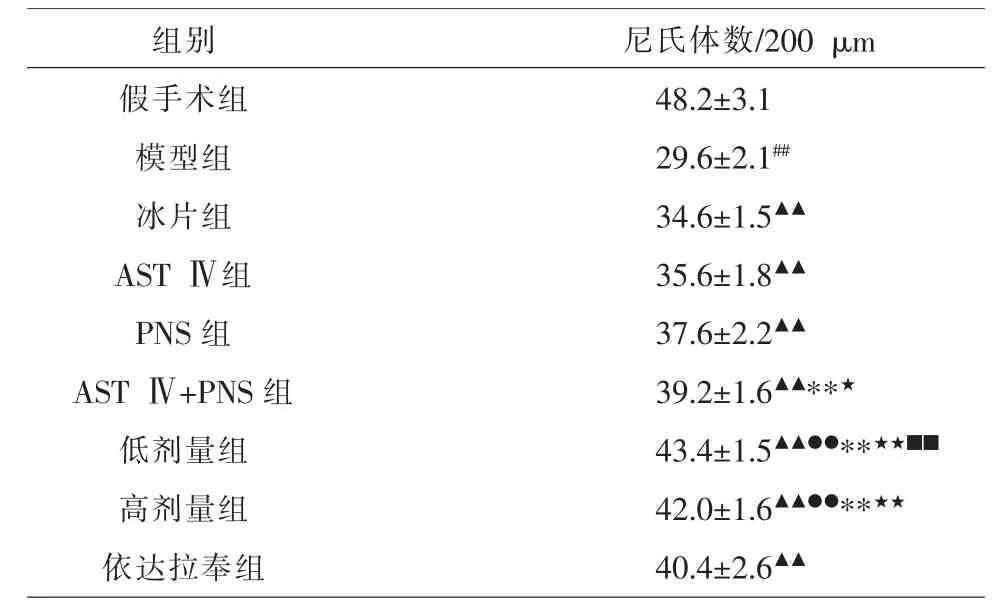
表1 各组海马CA1 区尼氏体数量比较(±s,n=5)
注:与假手术组比较,##P<0.01;与模型组比较,▲▲P<0.01;与冰片组比较,●●P<0.01;与AST Ⅳ比较,**P<0.01;与PNS 组比较,★P<0.05,★★P<0.01;与AST Ⅳ+PNS 组比较,■■P<0.01
尼氏体数/200 μm 48.2±3.1 29.6±2.1##34.6±1.5▲▲35.6±1.8▲▲37.6±2.2▲▲39.2±1.6▲▲**★43.4±1.5▲▲●●**★★■■42.0±1.6▲▲●●**★★40.4±2.6▲▲组别假手术组模型组冰片组AST Ⅳ组PNS 组AST Ⅳ+PNS 组低剂量组高剂量组依达拉奉组
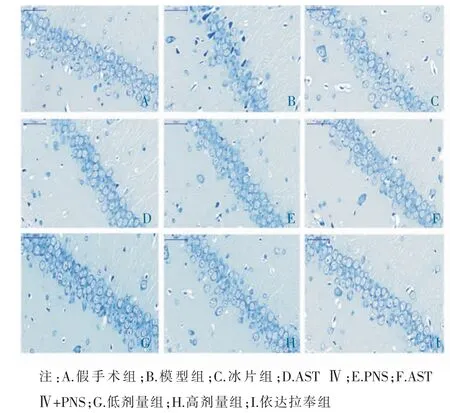
图2 各组海马CA1 区尼氏体计数图(×400)
3.3 冰片配伍AST Ⅳ和PNS 对海马CA1 区NF-200 蛋白表达的影响
与假手术组比较,模型组海马CA1 区NF-200蛋白表达显著减少(P<0.01)。与模型组比较,冰片组、AST Ⅳ组、PNS 组、AST Ⅳ+PNS 组 海 马CA1 区NF-200 表达差异无统计学意义(P>0.05),低剂量组、高剂量组、依达拉奉组海马CA1 区NF-200 表达显著增加(P<0.05,P<0.01)。 与AST Ⅳ组、PNS 组比较,AST Ⅳ+PNS 组海马CA1 区NF-200 表达差异无统计学意义(P>0.05)。 与冰片组、AST Ⅳ组、PNS组和AST Ⅳ+PNS 组比较,低剂量组和高剂量组海马CA1区NF-200 表达均显著增加(P<0.05,P<0.01)。 低剂量组和高剂量组比较,海马CA1 区NF-200 表达差异无统计学意义(P>0.05)。 见图3。
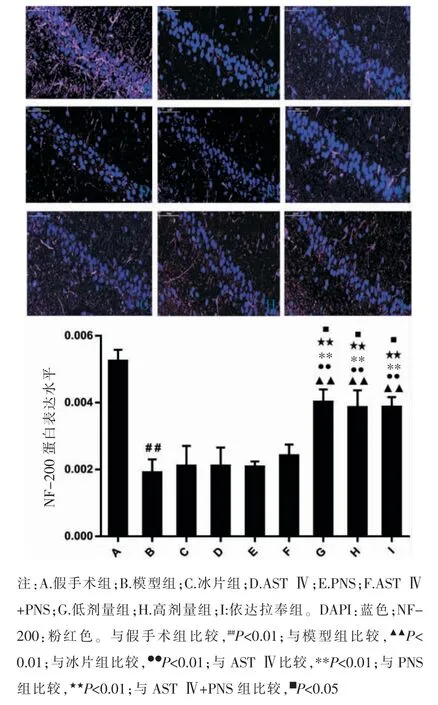
图3 各组海马CA1 区NF-200 蛋白表达的比较(±s,n=5,×400)
3.4 冰片配伍AST Ⅳ和PNS 对αⅡ-Spectrin 蛋白表达的影响
与假手术组比较,模型组αII-Spectrin 表达显著减少(P<0.01)。与模型组比较,冰片组、AST Ⅳ组、PNS 组、AST Ⅳ+PNS 组、高剂量组、依达拉奉组αII-Spectrin 表达差异无统计学意义(P>0.05),低剂量组αII-Spectrin表达显著增加(P<0.01)。 与AST Ⅳ组、PNS 组比较,AST Ⅳ+PNS 组αII-Spectrin 表达差异无统计学意义(P>0.05)。与冰片组、AST Ⅳ组、PNS组和AST Ⅳ+PNS 组比较,低剂量组αII-Spectrin 表达显著增加(P<0.05 和P<0.01),但高剂量组αIISpectrin 表达差异无统计学意义(P>0.05)。 与高剂量组比较,低剂量组αII-Spectrin 的表达组显著增加(P<0.05)。 见图4。
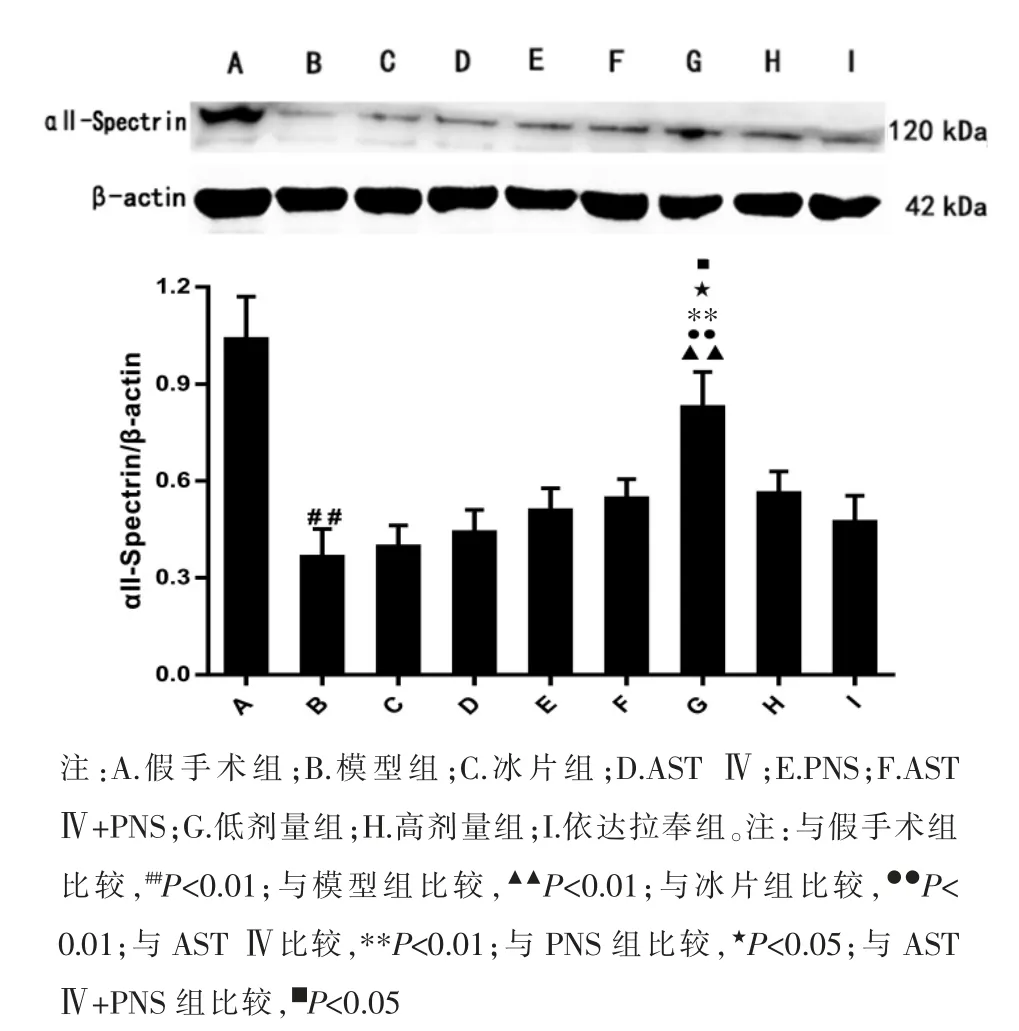
图4 各组αII-Spectrin 蛋白表达的比较(±s,n=5)
4 讨论
CIRI 的病理是一个复杂的损伤级联反应。当脑缺血缺氧后,脑组织能量代谢障碍、兴奋性氨基酸毒性、氧化/硝化应激损伤、Ca2+超载、炎症反应等一系列病理因素相互作用,形成恶性循环,损伤神经细胞和血脑屏障,加重脑水肿,导致脑组织不可逆性损伤[12-13]。 神经元是中枢神经系统的主要成分之一,CIRI 后可导致神经元损伤,引起神经功能障碍。因而,脑缺血后在尽快恢复脑血流的同时,减轻再灌注后神经元损伤、恢复神经功能对于缺血性脑损伤的治疗具有重要意义。
尼氏体是分布在神经元除轴突和轴丘以外胞浆中的一种物质,是神经元胞体细胞质的特征结构[14]。当神经元变性死亡时,尼氏体可出现数量及位置的变化,甚至溶解,故尼氏体数量可作为神经元胞体损伤的指标[15]。NF-200 是成熟神经元特有的细胞骨架蛋白,是神经轴突的重要组成部分[16-17]。YU 等[18]研究表明,大鼠缺血区脑组织中NF-200 的表达在脑卒中急性期显著降低。 故NF-200 可作为神经元轴突损伤的标志。αII-Spectrin 是神经元的一种重要的蛋白质成分,大量分布在轴突和突触前终端[19]。在短暂性脑缺血、外伤性脑损伤时,Calpain-1 和Caspase-3 被激活,选择性水解神经元的结构蛋白αII-Spectrin,使神经元的结构蛋白降解,细胞结构完整性受损,引起轴突运输障碍,从而造成神经元损伤甚至死亡[20]。故αII-Spectrin 表达可以反映神经元的轴突和突触损伤程度。 本研究表明,CIRI 后,大鼠出现明显的神经功能障碍,AST Ⅳ+PNS、低剂量和高剂量组均能降低CIRI 后神经功能缺损评分;冰片、AST Ⅳ、PNS、AST Ⅳ+PNS、 低剂量和高剂量组均可增加尼氏体数量;冰片+AST Ⅳ+PNS 组可上调NF-200 蛋白表达,上调αII-Spectrin 表达。 提示冰片配伍AST Ⅳ和PNS 能减轻神经元胞体、树突及轴突损伤,3 种药物合用组的效应显著强于各药物单用组和AST Ⅳ+PNS 组,表明冰片与AST Ⅳ、PNS 配伍能减轻神经元损伤,改善CIRI 后的神经功能障碍。这可能与冰片能促进AST Ⅳ、PNS透过BBB 入脑,增强药物抗CIRI 的效应有关。
综上所述,冰片、AST Ⅳ、PNS 具有抗CIRI 后神经元损伤的作用,且冰片配伍AST Ⅳ+PNS 后,对脑缺血后具有比AST Ⅳ配伍PNS 更好的神经元保护作用,3 种药物配伍的作用增强。目前冰片配伍AST Ⅳ和PNS 针对神经元细胞的保护作用探究只是一个初步的认识,而冰片配伍AST Ⅳ和PNS 增强抗缺血性脑损伤作用的确切机制及药物的量效关系尚有待进一步阐明。
