窄治疗指数药物安全性的再认识
2020-10-30陈志东
摘 要 窄治疗指数药物(narrow therapeutic index drugs, NTIDs)特别容易产生不良反应,其用药剂量的微小变化就会导致药物作用或效应的显著变化,临床上应予以更多的关注。本文论述NTIDs的安全性问题。
关键词 窄治疗指数药物 安全性 疗效不等
中图分类号:R969.3; R926 文献标志码:C 文章编号:1006-1533(2020)19-0057-08
Rethinking of the safety of narrow therapeutic index drugs
CHEN Zhidong*
(Department of Pharmacy, the 6th Peoples Hospital, Shanghai Jiao Tong University, Shanghai 200233, China)
ABSTRACT Narrow therapeutic index drugs (NTIDs) are particularly liable to produce adverse reactions, which means small changes in the dose results in significant changes in the drugs effects, so more attention should be paid in clinical practice. The safety of NTIDs is rethought in this article.
KEY WORDS narrow therapeutic index drugs; safety; therapeutic inequivalence
世界卫生组织(World Health Organization, WHO)警示:窄治疗指数药物(narrow therapeutic index drugs, NTIDs)特别容易产生不良反应[1],其用药剂量的微小变化就会导致药物作用或效应的显著变化[2],且NTIDs仿制药的安全性风险更大[3],临床上应予以高度关注。但我国对NTIDs仍普遍存在认识不足、疏于管理的问题,迫切需要强化NTIDs的全生命周期管理来确保患者的用药安全。好在由上海医药行业协会组织制定的《窄治疗指数药物质量评价及标准制订的通用技术要求》[4]已于2020年5月20日正式发布,并已有8家制药企业决定率先采用此标准。由于安全性问题是NTIDs的共有特点,因此笔者欲在《窄治疗指数药物的多样性及安全用药建议》[5]一文的基础上,继续探讨NTIDs的安全性问题,以期进一步提高制药企业、医疗机构和管理部门对NTIDs的质量安全和使用安全的认识。
1 NTIDs的定义安全
NTIDs具有内在的不安全特性,若其定义既无明确的标准,又不能贴近临床实践,还不能包括尽可能多的NTIDs,那么出现管理错位,如将部分NTIDs当成非 NTIDs或非NTIDs当成NTIDs,便在所难免,这样的定义本身就存在安全性问题。目前,关于NTIDs的定义至少有3类,不同的定义的内涵并不完全一致(表1)。第一类定义以治疗指数为依据,即将药物的半致死量与半有效剂量的比值或最低中毒浓度与最低有效浓度的比值<2定义为窄治疗指数[6],具有窄治疗指数的药物为NTIDs。不过,半致死量与半有效剂量来自于动物实验,且不同的研究者可能采用不同种类和品系的实验动物,致使结果与临床上患者的真实情况相距甚远;最低中毒浓度与最低有效浓度虽可自人体试验得到,但并非易事。所以,这类定义通常不为药品管理部门所采用。第二类定义建立在临床用药安全性基础上,更注重临床实践,故使用临床上更直观、更易获得的用药剂量或血药浓度变化及其产生的结果来定义NTIDs,即NTIDs为用药剂量或血药浓度发生微小变化就可能导致严重不良后果(治疗失败、毒性反应)的药物。这类定义容易理解,但难以量化,主观性大。第三类定义以临床患者为研究对象,通过对药物治疗监测结果进行分析、评估获得治疗指数,再按治疗指数≤2[7]或≤3[8]来定义NTIDs,如环孢素、地高辛的治疗指数均为2 ~ 3[7, 9],苯妥英为0.7 ~ 1.5[10]或2[11],卡马西平为3[11],苯巴比妥、丙戊酸(盐)均>2[11]。治疗指数在临床患者中似也有个体差异性。以治疗指数≤3定义NTIDs的安全性相对较高,且未排除环孢素、地高辛、卡马西平等治疗指数≥2并已获得公认的NTIDs。这与美国FDA药学专家提出的将治疗指数≤3的药物定义为NTIDs的建议[12]一致。我国还没有确定NTIDs的定义。中国药典认为,应从临床角度考虑,根据具体情况决定一种活性物质是否为NTIDs[13]。
2 NTIDs的目录安全
明确的NTIDs目录清单有助于NTIDs的安全使用。日本《风险管理计划指导原则(初稿)》[18]中要求,使用NTIDs治疗疾病的医师应具有丰富的专业知识和NTIDs使用经验。因此,应首先明确NTIDs目录清单。不过,迄今仍无国际级的NTIDs目录清单可供参考[19],欧洲药品管理局也没有发布过。最早的国家级NTIDs目录清单是1988年美国FDA发布的,加拿大、日本和我国也制定过各自的NTIDs目录清单[20-21]。但这4份国家级NTIDs目录清单(表2)至今均未进行过完善与更新,如我国的目录清单中有盐酸克林霉素,那么磷酸克林霉素是否也属NTIDs?此外,很多属NTIDs的老药没有被列入目录清单,包括嗎啡等阿片类药物[22-23]、氨基糖苷类抗菌药物[24], [25]384等。在美国,尽管FDA药物科学咨询委员会曾一致建议FDA发布明确的NTIDs目录清单,但FDA却一直没有这么做[5]。所以,上述各国家级NTIDs目录清单至今均仅包含少数NTIDs,既不能及时给临床提供更多的NTIDs安全性警示,也不利于NTIDs的安全使用。Li等[8]给出了一份包含123种药物的NTIDs目录清单(表3),其中有多西他赛、奥沙利铂等33种抗肿瘤药物,占比达26.8%,位列各类别药物之首。另外,国外一些专著也认定了许多NTIDs[26-37],有些在以上几份目录清单中均未提及(表4)。医疗机构作为NTIDs的使用单位,至少应制定本院的NTIDs目录清单,以供临床用药和药学服务等相关人员参考。

3 NTIDs的质量安全
NTIDs的质量是否安全,与制药企业的软、硬件条件,如员工、制剂配方、原辅料、生产设备、生产工艺和质量控制标准等诸多因素有关。尽管各国药品管理部门均在致力于提高NTIDs的质量控制标准,美、日和欧盟国家等已将90%置信区间下限≥90.00%作为NTIDs生物等效性试验的低限[37],但不同制药企业生产的相同NTIDs之间仍存在着一定的质量差异。
NTIDs的质量安全是个全球性问题,尤其是NTIDs的仿制药。美国作为全球公认的药物研发和生产强国,其FDA拥有一套严密和科学的药品质量管理体系,但同样存在NTIDs的质量问题。FDA公布的数据显示,因药品含量、稳定性、有效期和溶出试验等问题,NTIDs的召回率明显高于总体情况[38]。FDA的资料还显示,在2012年6月—2015年12月间Ⅰ级召回的抗肿瘤药物中,原研药有4次,仿制药达13次[39]。多西他赛是临床上常用的细胞毒性抗肿瘤药物,仿制药众多,质量安全问题较普遍:对14个国家31种多西他赛仿制药的质量分析[39-40]结果显示,21种仿制药(67.7%)的标示含量<90%,其中11种(35.5%)标示含量<80%,23种仿制药(74.2%)的杂质含量>3%;在我国生产的3种多西他赛仿制药中,有2种标示含量<80%,1种<90%,2种杂质含量>3%,1种<3%。由于多数抗肿瘤药物被认定是NTIDs[41-43],尤其是其中的细胞毒性药物[44],此类药物的仿制药质量问题亟需予以更多的关注。
华法林是临床上最常用的NTIDs之一,我国已有华法林仿制药等NTIDs通过了质量和疗效一致性评价(以下简称为“一致性评价”)。但我国对华法林等NTIDs仿制药的生物等效性试验要求仅为适当缩小90%置信区间的范围[45],与美国FDA的要求相比存在明显差距。FDA在其2012年发布的《华法林生物等效性试验指导原则(初稿)》[46]中要求,对华法林仿制药应进行四相全重复交叉试验(4-way, fully replicated crossover design in-vivo),且受试和参比华法林制剂个体内标准方差比值的90%置信区间上限应≤2.5。标准的差距往往意味着质量的差距,如我国已通过一致性评价的华法林仿制药的有效期为2年,而荷兰产的华法林原研药的有效期为3年[5],至于其他质量指标值有无差距,尚不得而知。欲使NTIDs的仿制药质量达到或超过其参比制剂,并非易事。
我国仿制药一致性评价尚在进行之中。一项对485名医药界人士进行的关于仿制药质量的问卷调查结果显示,担心仿制药质量较差或不稳定者的比例达71%[47],说明一致性评价仍无法提高临床对仿制药质量安全的信心。此问卷调查未分列NTIDs,但估计临床对NTIDs仿制药质量安全的信心可能更低。
4 NTIDs的使用安全
NTIDs更易引起不良反应。挪威的一项调查结果显示,在住院患者中,接受NTIDs和非NTIDs治疗(分别为292和535例)患者出现药物相关問题的比例分别为40%和19%,风险比分别为0.5和0.2(P<0.01)[48];印度的一项调查结果也显示,在住院患者中,接受NTIDs和非NTIDs治疗(分别为100和100例)患者出现药物相关问题的比例分别为16.9%和10.5%,风险比分别为0.22和0.08(P<0.01)[49]。NTIDs的安全性风险明显高于非NTIDs。
NTIDs的使用达标率低也是普遍现象。除地高辛和抗癫痫药物苯妥英、卡马西平、丙戊酸等外[5],华法林、万古霉素等NTIDs同样存在使用达标率低的问题。一项对380例使用华法林治疗的住院患者的调查结果显示,国际标准化比值(international normalized ratio, INR)在2.0 ~ 3.0间的患者比例仅为34.74%[50]。另一项调查结果亦显示,602例使用华法林治疗的住院患者的INR达标率只有29.9%[51]。万古霉素的有效血药谷浓度为10 ~ 20 μg/ml,但一些研究的监测结果显示,患者的达标率只有50.94%[52]、38.24%[53]、33.9%[54]、31.79%[55]和41.67%[56]。
NTIDs仿制药更易引起不良事件,给人印象较深的是抗肿瘤药物中的NTIDs仿制药。在日本仿制药质量考察组的58篇抗肿瘤药物研究报告中,有13篇(22.4%)显示仿制药的毒性反应高于原研药[39]。此外,在来自7个国家的8项旨在比较多西他赛原研药和仿制药不良事件的临床研究中,7项研究[57-63]显示仿制药的不良事件发生率高于原研药,1项研究[64]显示原研药的不良事件发生率高于仿制药。
NTIDs的使用安全已引起业内人士的担忧。对710名美国药师的调查结果显示,认为NTIDs仿制药可能有效和肯定有效的药师比例分别为64%和23%,可能安全和肯定安全的药师比例分别为53%和40%[65],表明约半数药师对NTIDs仿制药的疗效和安全性信心不足。我国一项对485名医药界人士进行的调查结果也显示,65%的受调查者认为国产仿制药的疗效不如原研药,43%的受调查者认为国产仿制药的不良反应多于原研药[47]。如对NTIDs仿制药作单独调查,结果或许更不乐观。
5 NTIDs的替换安全
替换是仿制药的终极目标,NTIDs仿制药也不例外,但目前对替换有着不同的理解[39, 66]。笔者认为,狭义的NTIDs替换应该是指用相同通用名的NTIDs仿制药替换NTIDs原研药,广义的NTIDs替换则还包括相同通用名的各NTIDs仿制药间的替换。通常狭义的NTIDs替换更受关注,因为这是NTIDs仿制药与其参比NTIDs间的替换,临床上非常关注NTIDs仿制药能否达到参比NTIDs的质量、疗效,甚至更优。理想的替换结果应利大于弊,即符合安全、有效、经济的替换原则。
美国FDA橙皮书[67]规定的替换条件是治疗等效,即仿制药应同时符合药剂学等效和生物等效。但这只是基于实验室数据的一种推测。在临床上以仿制药替换原研药时,常会出现疗效不一致的现象,即疗效不等[68-69],其定义为具有相同主成分、剂型和给药途径的药品(包括呈体内生物等效的药品)在相同用药剂量及用法下产生的不相等的临床反应。这种不相等的临床反应包括疗效增强或减弱以及产生意料之外的不良反应或不良反应的强度、频率增加,通常发生在替换不同制药企业生产的具有相同通用名的药品或同一制药企业生产的不同批号的同一药品时。疗效不等无疑会导致治疗失败或毒性反应增强。对此, FDA 1988年即成立了疗效不等评估委员会[68]。NTIDs的疗效不等似更常见,2019年第3季度FDA的药品不良事件通报中就载明了他克莫司胶囊的疗效不等事件[70]。出现疗效不等的原因除仿制药与原研药的内在质量存在差异外,还与普通患者不同于受试者有关。受试者是经严格筛选过的,个体差异小,而普通患者存在各种情况,甚至同时罹患多种基础疾病,个体差异大。此外,临床上使用的药品也不同于试验药品。所以,依据仿制药生物等效性试验结果推测而来的治疗等效不可能完全表现为临床上的治疗等效,尤其是对质量要求更严格的NTIDs仿制药。
对NTIDs替换也一直存在着争议,有赞成,有反对。有研究者分析了2006年7月—2015年7月间接受华法林(原研药和4种仿制药)治疗的74.6万心房颤动患者的临床数据,结果显示使用华法林原研药治疗患者更健康[71]。但一项对11篇文献(合计包括4万多例患者)的系统分析结果却表明,华法林仿制药和原研药的安全性和疗效均相当[72]。抗癫痫药物仿制药与原研药的临床效果间同样存在有差异和无差异的现象[73]:一项研究显示,抗癫痫药物仿制药治疗能较原研药治疗出现更少的癫痫发作[74];但一项对68篇文献的系统分析则认为,应避免狭义和广义的抗癫痫药物替换[75]。
NTIDs的质量特性使得一些专业人士对NTIDs替换持谨慎态度,认为应避免替换,特殊情况则建议应知情同意,并要求药房保障原研药的供给[76]。对219名马来西亚药师的调查结果显示,75.8%的药师认为NTIDs替换不合适[77]。目前,美国至少有9个州通过立法明确限制NTIDs替换[65](表5)。在我国,业内人士只选择原研药而不关注药品价格的占14.43%,注射剂选择原研药的占10.10%,只有在原研药价格过高时才考虑选择国产仿制药的占48.04%,通常选择国产仿制药的仅占13.40%,两者均可的占10.52%[47]。对NTIDs,估计选择国产仿制药者的比例会更低。
6 结语
NTIDs的安全性问题已逐渐为人所认识,医药界亟需提高对NTIDs质量安全和使用安全的意识。NTIDs特别容易产生不良反应,用药剂量的微小变化即可能导致作用或效应的显著变化。因此,执行严格的质量控制标准、明确的NTIDs目录清单、规范化使用和谨慎替换等措施,才有可能保证NTIDs的使用安全。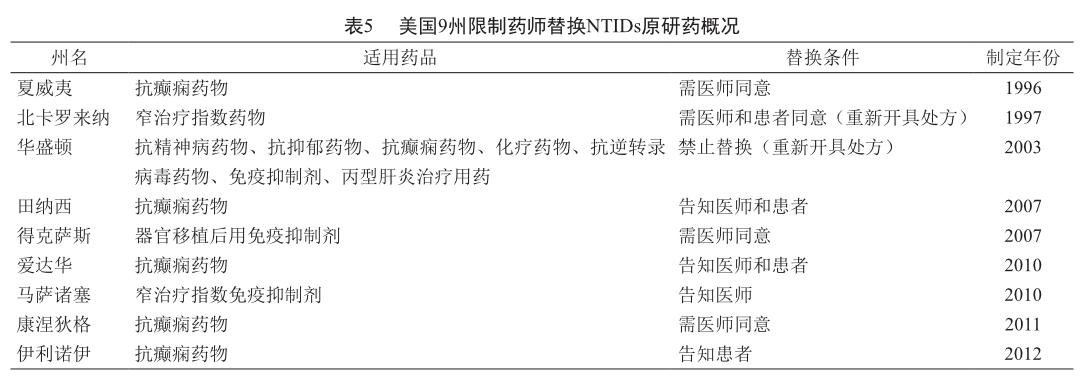
參考文献
[1] Sheikh A, Dhingra-Kumar N, Kelley E, et al. The third global patient safety challenge: tackling medication-related harm [J/ OL]. Bull World Health Organ, 2017, 95(8): 546-546A [2020-07-01]. doi: 10.2471/BLT.17.198002.
[2] Bachenheimer BS. Manual for pharmacy technicians [M]. 5th ed. Bethesda, MD, USA: American Society of Health-System Pharmacists, Inc., 2019: 186.
[3] Waller DG, Sampson AP. Medical pharmacology and therapeutics [M]. 5th ed. Philadelphia, PA, USA: Elsevier Ltd., 2018: 689.
[4] 上海医药行业协会. 窄治疗指数药物质量评价及标准制订的通用技术要求[EB/OL]. (2020-05-20) [2020-07-01]. http://www.ttbz.org.cn/Pdfs/Index/?ftype=st&pms=35584.
[5] 陈志东. 窄治疗指数药物的多样性及安全用药建议[J]. 上海医药, 2019, 40(13): 29-35.
[6] e-CFR §320.33 Criteria and evidence to assess actual or potential bioequivalence problems [EB/OL]. [2020-07-01]. https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/ CFRSearch.cfm?fr=320.33.
[7] Ericson JE, Zimmerman KO, Gonzalez D, et al. A systematic literature review approach to estimate the therapeutic index of selected immunosuppressant drugs after renal transplantation[J]. Ther Drug Monit, 2017, 39(1): 13-20.
[8] Li XX, Yin J, Tang J, et al. Determining the balance between drug efficacy and safety by the network and biological system profile of its therapeutic target [J/OL]. Front Pharmacol, 2018, 9: 1245 [2020-07-01]. doi: 10.3389/fphar.2018.01245.
[9] Kimura S, Nakamura Y. Poor quality pharmaceuticals in global public health [M]. Singapore City, Singapore: Springer Nature Singapore Pte Ltd., 2020: 23.
[10] Ku LC, Wu H, Greenberg RG, et al. Use of therapeutic drug monitoring, electronic health record data, and pharmacokinetic modeling to determine the therapeutic index of phenytoin and lamotrigine [J]. Ther Drug Monit, 2016, 38(6): 728-737.
[11] Greenberg RG, Melloni C, Wu H, et al. Therapeutic index estimation of antiepileptic drugs: a systematic literature review approach [J]. Clin Neuropharmacol, 2016, 39(5): 232-240.
[12] FDA. Pharmacometric approach to define narrow therapeutic index (NTI) drugs & evaluate bioequivalence (BE) criteria for NTI drugs [EB/OL]. [2020-07-01]. https://www.fda.gov/ media/108490/download.
[13] 國家药典委员会. 中华人民共和国药典2020年版四部[M]. 北京: 中国医药科技出版社, 2020: 464.
[14] FDA. FY2015 regulatory science research report: narrow therapeutic index drugs [EB/OL]. [2020-07-01]. https://www. fda.gov/industry/generic-drug-user-fee-amendments/fy2015-regulatory-science-research-report-narrow-therapeutic-indexdrugs.
[15] Health Canada. Guidance document - comparative bioavailability standards: formulations used for systemic effects [EB/OL]. [2020-07-01]. https://www.canada.ca/ content/dam/hc-sc/migration/hc-sc/dhp-mps/alt_formats/ pdf/prodpharma/applic-demande/guide-ld/bio/comparativebioavailability-standards-formulations-used-systemic-effects. pdf.
[16] Benet LZ, Goyan JE. Bioequivalence and narrow therapeutic index drugs [J]. Pharmacotherapy, 1995, 15(4): 433-440.
[17] Levy G. What are narrow therapeutic index drugs? [J]. Clin Pharmacol Ther, 1998, 63(5): 501-505.
[18] Pharmaceuticals and Medical Devices Agency. Risk management plan (RMP) guidance (draft) [EB/OL].[2020-07-01]. https://www.pmda.go.jp/files/000153112. pdf#page=11?00153112.pdf.
[19] Committee for Medicinal Products for Human Use. ICH M9 guideline on biopharmaceutics classification systembased biowaivers - questions and answers. Step 5 [EB/OL].[2020-07-01]. https://www.ema.europa.eu/en/documents/ other/ich-m9-biopharmaceutics-classification-system-basedbiowaivers-step-5-questions-answers_en.pdf.
[20] Haas B, Weber-Lassalle K, Fr?tschl R, et al. Is sunitinib a narrow therapeutic index drug? - A systematic review and in vitro toxicology-analysis of sunitinib vs. imatinib in cells from different tissues [J]. Regul Toxicol Pharmacol, 2016, 77: 25-34.
[21] 國家食品药品监督管理局. 已上市化学药品变更研究的技术指导原则(一)[EB/OL]. (2008-05-15) [2020-07-01]. http://www.nmpa.gov.cn/gsjz08242/gsjz08242.rar.
[22] Luellmann H, Mohr K, Hein L. Color atlas of pharmacology[M]. 5th ed. Noida, Uttar Pradesh, India: Thieme Publishm Delhi, 2018: 210.
[23] Allen LV Jr. Remington: an introduction to pharmacy [M]. London, UK: Pharmaceutical Press, 2013: 455.
[24] Alves R. Aminoglycosides: pharmacology, clinical uses and health effects [M]. New York, USA: Nova Science Publishers, Inc., 2016: 54.
[25] Anzenbacher P, Zanger UM. Metabolism of drugs and other xenobiotics [M]. Weinheim, Baden-Württemberg, GER: Wiley-VCH Verlag GmbH & Co. KGaA, 2012.
[26] The American Cancer Society. The American Cancer Societys oncology in practice: clinical management [M]. Hoboken, NJ, USA: John Wiley & Sons, Inc., 2018: 14.
[27] Brody T. FDAs drug review process and the package label: strategies for writing successful FDA submissions [M]. Philadelphia, PA, USA: Elsevier Inc., 2018: 105.
[28] Murphy JE. Clinical pharmacokinetics [M]. 6th ed. Bethesda, MD, USA: American Society of Health-System Pharmacists, Inc., 2017: 23.
[29] Abrams AC, Pennington SS, Lammon CB, et al. Clinical drug therapy: rationales for nursing practice [M]. 9th ed. Philadelphia, PA, USA: Lippincott Williams & Wilkins, Inc., 2009: 289.
[30] Bennett JE, Dolin R, Blaser MJ, et al. Mandell, Douglas, and Bennetts principles and practice of infectious diseases [M]. 9th ed. Philadelphia, PA, USA: Elsevier Inc., 2020: 587.
[31] Haddad PM, Nutt DJ. Seminars in clinical psychopharmacology[M]. 3rd ed. Cambridge, Cambridgeshire, UK: Cambridge University Press, 2020: 447.
[32] Antman EM, Sabatine MS, Lemos JD, et al. Cardiovascular therapeutics: a companion to braunwalds heart disease [M]. 4th ed. Philadelphia, PA, USA: Elsevier Inc., 2013: 119.
[33] Wolverton SE, Wu JJ. Comprehensive dermatologic drug therapy [M]. 4th ed. Philadelphia, PA, USA: Elsevier Inc., 2019: 4; 246; 726.
[34] Martindale Editorial Team. Martindale: the complete drug reference [M]. 38th ed. London, UK: Pharmaceutical Press, 2014: 120.
[35] Ashley C, Dunleavy A. The renal drug handbook: the ultimate prescribing guide for renal practitioners [M]. 5th ed. Boca Raton, FL, USA: CRC Press, 2019: 653.
[36] Burchum JR, Rosenthal LD. Lehnes pharmacology for nursing care [M]. 10th ed. St. Louis, MO, USA: Elsevier Health Sciences, 2019: 1123.
[37] Tamargo J, Le Heuzey JY, Mabo P. Narrow therapeutic index drugs: a clinical pharmacological consideration to flecainide[J]. Eur J Clin Pharmacol, 2015, 71(5): 549-567.
[38] FDA. Quality and bioequivalence standards for narrow therapeutic index drugs [EB/OL]. [2020-07-01]. https://www. fda.gov/media/82940/download.
[39] Yang YT, Nagai S, Chen BK, et al. Generic oncology drugs: are they all safe? [J]. Lancet Oncol, 2016, 17(11): e493-e501.
[40] Vial J, Cohen M, Sassiat P, et al. Pharmaceutical quality of docetaxel generics versus originator drug product: a comparative analysis [J]. Curr Med Res Opin, 2008, 24(7): 2019-2033.
[41] Brody T. Clinical trials [M]. 2nd ed. Philadelphia, PA, USA: Elsevier Inc., 2016: 51.
[42] Tsakalozou E, Eckman AM, Bae Y. Combination effects of docetaxel and doxorubicin in hormone-refractory prostate cancer cells [J/OL]. Biochem Res Int, 2012, 2012: 832059[2020-07-01]. doi: 10.1155/2012/832059.
[43] Rudek MA, Chau CH, Figg WD, et al. Handbook of anticancer pharmacokinetics and pharmacodynamics [M]. 2nd ed. New York, USA: Springer, 2014: 141.
[44] Sisay EA, Engidawork E, Yesuf TA, et al. Drug related problems in chemotherapy of cancer patients [J]. J Cancer Sci Ther, 2015, 7(2): 055-059.
[45] 國家药品监督管理局. 以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则[EB/ OL]. (2015-11-27) [2020-07-01]. http://www.cde.org.cn/ attachmentout.do?mothed=list&id=067280c7661829b3.
[46] FDA. Draft guidance on warfarin sodium [EB/OL]. [2020-07-01]. https://www.accessdata.fda.gov/drugsatfda_docs/psg/ Warfarin_Sodium_tab_09218_RC12-12.pdf.
[47] 陈震, 杨建红, 张彦彦, 等. 影响我国化学药品仿制药质量因素的问卷调查分析[J]. 中国新药杂志, 2017, 26(13): 1477-1483.
[48] Blix HS, Viktil KK, Moger TA, et al. Drugs with narrow therapeutic index as indicators in the risk management of hospitalised patients [J]. Pharm Pract (Granada), 2010, 8(1): 50-55.
[49] Iyer K, Dilipkumar N, Vasaya S, et al. Comparison of drug related problems associated with use of narrow therapeutic index drugs and other drugs in hospitalized patients [J]. J Young Pharm, 2018, 10(3): 318-321.
[50] 李丙添, 廖础欣, 刘锐锋, 等. 380份住院患者病历华法林应用分析[J]. 中国医院用药评价与分析, 2018, 18(8): 1110-1111; 1115.
[51] 兰艳纤, 冯茜, 韦美丹. 602例住院患者华法林临床应用分析[J]. 中国药物应用与监测, 2019, 16(1): 36-39.
[52] 倪春艳, 钱春艳, 夏宗玲. 万古霉素抗感染治疗患者血药浓度的监测与分析[J]. 抗感染药学, 2019, 16(2): 200-204.
[53] 方玲, 夏泉, 汪燕燕, 等. 万古霉素血药浓度监测256例次分析[J]. 安徽医药, 2019, 23(7): 1468-1472.
[54] 许大庆, 王博. HPLC法测定万古霉素血药浓度的临床应用[J]. 北方药学, 2019, 16(7): 3-5.
[71] Bird ST, Flowers N, Zhao Y, et al. Healthy user bias in comparative safety studies for brand-name vs. generic products: the example of warfarin [J]. Clin Pharmacol Ther, 2019, 106(5): 1037-1045.
[72] Dentali F, Donadini MP, Clark N, et al. Brand name versus generic warfarin: a systematic review of the literature [J]. Pharmacotherapy, 2011, 31(4): 386-393.
[73] Holtkamp M, Theodore WH. Generic antiepileptic drugs -safe or harmful in patients with epilepsy? [J]. Epilepsia, 2018, 59(7): 1273-1281.
[74] Gagne JJ, Kesselheim AS, Choudhry NK, et al. Comparative effectiveness of generic versus brand-name antiepileptic medications [J]. Epilepsy Behav, 2015, 52(Pt A): 14-18.
[75] Atif M, Azeem M, Sarwar MR. Potential problems and recommendations regarding substitution of generic antiepileptic drugs: a systematic review of literature [J/ OL]. Springerplus, 2016, 5: 182 [2020-07-01]. doi: 10.1186/ s40064-016-1824-2.
[76] Paveliu MS, Bengea S, Paveliu FS. Generic substitution issues: brand-generic substitution, generic-generic substitution, and generic substitution of narrow therapeutic index (NTI)/critical dose drugs [J]. Maedica (Buchar), 2011, 6(1): 52-58.
[77] Chong CP, Hassali MA, Bahari MB, et al. Exploring community pharmacists views on generic medicines: a nationwide study from Malaysia [J]. Int J Clin Pharm, 2011, 33(1): 124-131.
