雪胆素甲对小鼠乳腺肿瘤的抑制作用及其机制*
2020-10-30吴璐璐田瑜龚令熙黄光英
吴璐璐,田瑜,龚令熙,黄光英
(陆军军医大学第二附属医院药剂科,重庆 400038)
乳腺肿瘤是当前全球女性发病率最高的肿瘤疾病,每年因罹患乳腺肿瘤死亡的妇女约52万例,乳腺肿瘤高居女性恶性肿瘤死亡第一位[1]。2012年数据显示,中国女性乳腺癌新发约19万例,死亡近5万例。虽然按统计中国乳腺癌发病率仍属低发,但呈逐年上升趋势[2]。目前,恶性乳腺肿瘤的治疗尤其是三阴性乳腺肿瘤的治疗方法进展不多,以手术切除和放化疗结合为主要治疗手段。化学治疗(化疗)常规药物为蒽环类、抗代谢类、铂类、紫杉类及内分泌辅助药物如他莫昔芬、托瑞米芬等[3]。上述治疗药物均存在靶向性差、全身性毒副作用明显、症状改善能力有限等缺点。其他如分子靶向药物曲妥珠单抗、利妥昔单抗等价格昂贵,普通患者难以承受。因此,开发高效、低毒和价廉的乳腺肿瘤治疗药物是新药研发的重点和难点。
近年来,中药复方黄黛片等[4]治疗肿瘤取得进展。中药雪胆(HemsleyachinensisCogn.ex Forbes et Hemsl.)为葫芦科植物雪胆Hemsleyaamabilis Diels的干燥块根,能清热解毒、消炎杀菌[5],临床用于胃炎、胃溃疡及呼吸道感染等的治疗。近来研究发现,其三萜类成分雪胆素甲对非小细胞肺癌有一定抑制作用[6-7]。笔者在本实验观察雪胆素甲(cucurbitacin α,CUBα)对乳腺肿瘤模型小鼠肿瘤的抑制作用并初步探讨其机制。
1 材料与方法
1.1试药 CUBα,含量不低于90%(高效液相色谱法测定),购于辽宁大连美仑化学试剂公司,批号:160325;橄榄油,购于西安天龙试剂公司,批号:TA15060;二甲基苯蒽(methylnitrosourea,DMBA),批号:089K073,纯度≥95%,购于美国Sigma公司;他莫昔芬,奥地利Ebewe Pharma公司产品,批号:612487-72-6;10%水合氯醛,购于重庆医科大学附属儿童医院,批号:20180516;无水乙醇,化学纯,购于重庆浩康医药化工集团有限公司,批号:20161205。Na+-K+-ATP酶、 Ca2+-Mg2+-ATP 酶、超氧化物歧化酶(SOD) 、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性检测试剂盒,雌二醇和孕酮酶联免疫试剂盒(均购自武汉华美生物工程有限公司,批号分别为171020、170806、170628、171011、170906);肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)酶联免疫试剂盒购自南京建成生物技术公司,批号分别为20171218和20180115。
1.2仪器与设备 UV2000紫外分光光度计(日本岛津公司);全波长扫描酶标仪(美国Thermo科技公司);倒置显微镜(日本奥林巴斯公司);飞鸽TGL-16B台式高速离心机(离心半径8.76 cm,上海安亭科学仪器厂);多功能小鼠活动记录仪(上海智尚医学设备公司)。
1.3实验动物 雌性Balb/c小鼠,无特定病原体(SPF)级,7~8周龄,体质量(19.2±3.6) g,购于重庆医科大学动物中心,实验动物生产许可证号:SCXK(渝)2012-0002。小鼠常规饲养,自由饮水,实验开始前适应性饲养5 d。
1.4动物的造模与处理 实验小鼠以普通标准饲料喂养3 d,按体质量采用配对设计随机分组法分为6组,每组12只,即空白对照组、模型对照组、他莫昔芬(阳性对照)组和CUBα小剂量组、中剂量组、大剂量组。模型对照组、他莫昔芬组(阳性对照组)和CUBα 小剂量、中剂量、大剂量组参照文献[8]方法并改良,造模,每3 d给予15 mg·mL-1DMBA橄榄油溶液 8 μL皮下注射,连续8周,以手触摸小鼠有肿瘤出现为止;他莫昔芬组造模开始时按5 mg·kg-1·d-1灌胃给予他莫昔芬混悬液(0.9%氯化钠溶液混悬,0.2 mg·mL-1);CUBα各剂量组按12.5,25,50 mg·kg-1·d-1灌胃给予 CUBα混悬液(0.2%聚山梨酯-羧甲基纤维素钠混悬,30 mg·mL-1);空白对照组灌胃等体积0.9%氯化钠溶液;停止DMBA后继续给药16周,迅速断头处死(为避免麻醉药对检测指标影响),取血液,剥离脏器及肿瘤组织,血浆置-80 ℃保存备用。组织除需立即检测外,其他以4%甲醛固定备用。实验过程中小鼠均给予普通标准饲料喂养。
1.5检测指标
1.5.1一般状况、雌二醇和孕酮水平 造模开始后,每周观察小鼠状态,测量体质量和直肠温度;监测小鼠 10 min内自主活动次数;实验开始后第8,16,24周,经眼眶采血0.5 mL,加入有乙二胺四乙酸二钠的无菌离心管,颠倒离心管混匀,4 ℃静置30 min,3000 r·min-1离心10 min,取上清液于新离心管,按试剂盒说明书检测雌二醇和孕酮水平。
1.5.2瘤体和免疫脏器质量检测 处死小鼠,分离并测定脾脏、胸腺质量,计算抑瘤率、胸腺指数和脾指数。抑瘤率(%)=(模型对照组瘤质量-给药组瘤质量)/模型对照组瘤质量×100%;脏器指数=胸腺(脾)质量/(体质量×100)。
1.5.3免疫指标检测 末次给药24 h后经尾静脉取血,立即送检白细胞计数(WBC);小鼠断头所取血浆(乙二胺四乙酸二钠抗凝),1200 r·min-1离心5 min,按试剂盒说明书,ELISA法检测TNF-α和IL-6水平。
1.5.4酶活性检测 小鼠瘤体和组织以预冷0.9%氯化钠溶液洗净、剪碎,制成10%匀浆液,5 000 r·min-1离心5 min,取上清液,按试剂盒说明书标示法测定组织Na+-K+-ATP酶、Ca2+-Mg2+-ATP 酶、SOD酶、GSH-Px酶活性,其中膜蛋白以小牛血清白蛋白为参比,采用 Lowry 法测定。
1.5.5肿瘤肺转移观察 参照文献[9]方法,取小鼠肺组织,冰冷0.9%氯化钠溶液冲洗干净,Bouin液固定过夜,无水乙醇浸泡至颜色恢复。显微镜观察计算白色肺转移结节数。结节总数(个) =Ⅰ×1+Ⅱ ×2+Ⅲ×3+ Ⅳ×4,按结节直径分为四级:Ⅰ级<0.5 mm,0.5 mm≤Ⅱ级<1 mm,1 mm≤Ⅲ级≤2 mm,Ⅳ级>2 mm。
2 结果
2.1对小鼠体质量和体温的影响 开始造模14周后,模型对照组、CUBα小剂量组体温明显低于空白对照组(P<0.05)(图1A),模型对照组小鼠体质量增长明显低于空白对照组。他莫昔芬组小鼠体质量增长最缓慢(图1B)。

A.体温;B.体质量。
2.2对肿瘤生长进展的影响 结果见表1。造模后16周,空白对照组小鼠未见肿瘤生长;模型对照组小鼠瘤体生长明显,肿瘤发生率100%,平均瘤体质量(4.72±1.02) g;单因素方差分析结果显示,与模型对照组比较,给予他莫昔芬(5 mg·kg-1)和中、大剂量CUBα后,瘤体质量均明显减小(P<0.05)。与他莫昔芬组比较,CUBα中剂量组、大剂量组瘤体质量差异无统计学意义。
2.3对血清性激素的影响 结果见表2。与空白对照组比较,模型对照组小鼠在实验开始后8周、16周和24周血清雌二醇和孕酮水平明显升高,差异均有统计学意义(P<0.05)。与模型对照组比较,他莫昔芬组小鼠雌二醇(16周、24周)和孕酮(8周、16周和24周)血清水平均显著降低(P<0.05)。给予不同剂量CUBα后,小鼠血清雌二醇和孕酮水平较模型对照组低,高于他莫昔芬组,但差异均无统计学意义。
2.4对白细胞和免疫器官的影响 结果见表3。与空白对照组比较,模型对照组WBC和脾脏、胸腺脏器指数均有所增加,且差异有统计学意义(P<0.05)。给予他莫昔芬后,荷瘤小鼠WBC降至(9.75±1.22)×109·L-1,脾脏指数和胸腺指数分别减少到(5.97±1.04)和(1.91±0.95) mg·g-1,均显著低于模型对照组(P<0.01)。给予小剂量、中剂量、大剂量CUBα处理的小鼠,其WBC、脾脏指数和胸腺指数与模型对照组比较,均差异无统计学意义,但明显高于他莫昔芬,差异有统计学意义(P<0.05)。

表1 6组小鼠瘤体质量与抑瘤率测定结果
表2 6组小鼠激素水平测定结果
Tab.2 Determination results of the hormonal level in six groups of mice

表2 6组小鼠激素水平测定结果
组别雌二醇8周16周24周孕酮8周16周24周空白对照组157.7±12.9112.8±20.877.9±9.232.8±8.127.7±5.021.4±6.5模型对照组218.2±24.1①203.5±15.8①188.2±19.2①43.5±6.4①38.6±9.5①33.5±7.3①他莫昔芬组205.1±11.4141.9±8.5②85.9±6.0②37.1±4.6②31.3±5.1②25.3±3.5②CUBα 小剂量组 228.2±19.1182.8±20.2168.5±15.942.9±8.736.2±5.630.8±7.2 中剂量组198.0±14.7193.9±22.4170.6±17.641.9±7.635.0±6.329.3±2.6 大剂量组187.8±10.6183.3±19.2167.3±24.640.8±10.234.8±5.329.4±3.2
①与空白对照组比较,t=2.865~5.665,P<0.05;②与模型对照组比较,t=3.536~12.997,P<0.05。
①Compared with blank control group,t=2.865-5.665,P<0.05;②Compared with model control group,t=3.536-12.997,P<0.05.

表3 6组小鼠WBC与免疫器官脏器指数测定结果
2.5对免疫相关生化指标的影响 与空白对照组比较,模型对照组小鼠血浆TNF-α和IL-6均明显增高(P<0.05)。与模型对照组比较,他莫昔芬组TNF-α降低21.1%,差异有统计学意义(P<0.05),IL-6水平降低但差异无统计学意义;与模型对照组比较,CUBα各剂量组TNF-α和IL-6水平下降并呈剂量相关性。CUBα中剂量、大剂量组TNF-α与IL-6均明显低于他莫昔芬组(均P<0.05)。与空白对照组比较,CUBα大剂量组IL-6水平更高,但差异无统计学意义。结果见图2。
2.6对肿瘤相关酶活性指标的影响 结果见表3。与空白对照组比较,模型对照组Na+-K+-ATP酶、Ca2+- Mg2+-ATP 酶、SOD酶和GSH-Px酶活性均明显下降(P<0.05)。加入他莫昔芬或不同剂量CUBα处理后,酶活性均有所恢复但均低于空白对照组,其中大剂量CUBα组小鼠Na+-K+-ATP酶、Ca2+- Mg2+-ATP 酶和GSH-Px与空白对照组差异无统计学意义,SOD活性水平仍明显低于空白对照组(P<0.05)。与他莫昔芬组比较,大剂量CUBα对Ca2+- Mg2+-ATP 酶活性的保护作用更强,两组差异有统计学意义(P<0.05),Na+-K+-ATP酶、SOD酶和GSH-Px酶活性方面小剂量、中剂量CUBα组与他莫昔芬组差异无统计学意义。对荷瘤小组Na+-K+-ATP酶、Ca2+- Mg2+-ATP 酶、SOD酶和GSH-Px酶活性的保护作用,小剂量组、中剂量组、大剂量组呈剂量相关性,且大剂量组具有更强的酶活性保护作用。

①与空白对照组比较,t=3.275,6.492,P<0.05;②与模型对照组比较,t=2.740,P<0.05;③与他莫昔芬组比较,t=2.807~7.338,P<0.05。

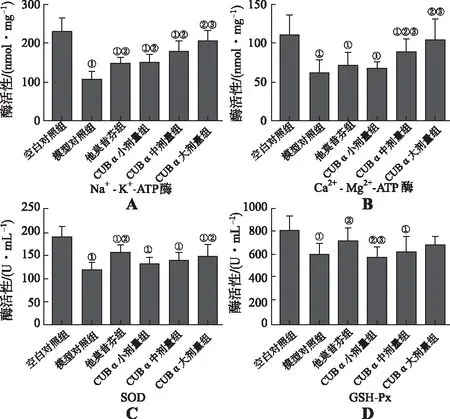
①与空白对照组比较,t=2.935 2~6.239 0,P<0.05;②与模型对照组比较,t=2.174 3~5.412 0,P<0.05;③与他莫昔芬组比较,t=2.589 0~4.181 6,P<0.05。

2.7对肿瘤肺转移的影响 结果见表4。空白对照组小鼠未见肺结节。他莫昔芬组平均结节数较模型对照组多2.6个,差异无统计学意义(P>0.05)。给予不同剂量CUBα后,小鼠肺转移结节数均有所降低,且剂量越大,小鼠肺转移结节数越少。其中,CUBα中剂量组、大剂量组与空白对照组和他莫昔芬组比较,差异有统计学意义(P<0.05)。

表4 6组小鼠乳腺肿瘤肺转移结节数统计结果
3 讨论
DMBA诱导Balb/c小鼠建立乳腺肿瘤模型,属较成熟的诱发性乳腺肿瘤模型,其肿瘤模型的形态学特性、内分泌影响和侵袭性特点与人类乳腺肿瘤相似,已广泛用于肿瘤的病理生理及药物分子机制等研究[10-11]。然而,不同动物对DMBA诱导乳腺癌的敏感性差异较大,发病率也不一致[12]。笔者在本研究采用改进剂量和给药方式造模,给药后8周小鼠出现明显肿瘤体征,且激素水平、免疫器官及功能、肿瘤相关酶指标变化以及在他莫昔芬作用下的应答均与文献报道一致,提示本研究建立的乳腺肿瘤小鼠模型可用于肿瘤药物治疗相关研究[8~11]。
CUBα是从葫芦科雪胆属块茎中分离出的有效成分之一,既往研究[13]表明CUBα可通过破坏肌动蛋白细胞骨架而抑制细胞增殖,导致细胞周期阻滞而诱导肿瘤细胞凋亡[13-15],从而阻止肿瘤的发生发展。本实验研究发现,模型对照组小鼠在造模过程中逐渐出现自主活动明显减少,踡缩少动、弓背毛松、畏寒喜暖、莫名寒战等现象,造模14周后,模型对照组、CUBα 小剂量组体温和体质量增长明显低于空白对照组,模型对照组肿瘤增长迅速,肿瘤发生率100%。阳性药物他莫昔芬治疗后,瘤体生长明显降低,CUBα中剂量组、大剂量组瘤体质量较模型对照组明显降低,但较他莫昔芬组抑制程度略低,且CUBα小剂量组、中剂量组、大剂量组肺转移结节数均低于模型对照组和他莫昔芬组,表明CUBα能改善模型小鼠肿瘤体征,抑制肿瘤生长,阻止肿瘤进展。
研究认为有丝分裂激酶Aurora A的抑制剂有明显的抗乳腺肿瘤效果,尤其是在雌激素受体阳性乳腺肿瘤细胞中,能逆转乳腺肿瘤细胞的耐药性,提高对内分泌治疗应答的的敏感性[10]。而近来对CUBα的研究[6]发现,其抑制人非小细胞肺癌A549细胞增殖的机制,很可能与其抑制Aurora A 磷酸化,进而诱导肿瘤细胞凋亡,阻滞细胞周期于G2/M期有关,提示CUBα作为潜在的Aurora A酶抑制剂,可能对乳腺肿瘤具有抑制作用。
乳腺癌是妇女常见的恶性肿瘤,其发病与遗传、内分泌和环境等多种因素有关,尤其与性激素密切相关。徐红等[16]研究认为血清中雌激素、孕激素水平增高可能是致乳腺纤维腺瘤、乳腺癌的直接原因。他莫昔芬是首个上市的抗雌激素受体的肿瘤内分泌治疗药物,用于乳腺癌、卵巢癌等肿瘤治疗及预防等[17]。他莫昔芬可与雌激素受体竞争结合,形成受体复合体,从而阻止雌激素发挥作用,以抑制乳腺癌细胞的增殖或减少肿瘤发生。本实验结果显示, 相较于模型对照组,给予他莫昔芬后,雌二醇和孕酮水平均明显降低,而给予CUBα虽能降低雌二醇和孕酮水平,但3个剂量组均无统计学意义,提示CUBα对肿瘤作用的机制可能与他莫昔芬不同。
在肿瘤的发生过程中,核因子κB ( nuclear factor,NF-κB)和信号传导蛋白和转录激活物(signal transducersand activators of transcription 3,STAT3) 可能是调控肿瘤炎性微环境核心分子,并在多种肿瘤中检测到NF-κB和STAT3的共激活[18]。研究发现,IL-1、TNF-α等炎症因子可通过上调NF-кB活性促进 IL-6分泌,间接活化STAT3,从而通过介导炎症递质的细胞外信号调控肿瘤细胞、免疫细胞等的生物学行为,促进肿瘤发生及肿瘤相关性炎症的形成[15]。本实验结果显示,相较于模型对照组,小鼠给予不同剂量CUBα后,TNF-α和IL-6水平均下降并呈疗效相关性,中剂量和大剂量CUBα组TNF-α和IL-6均明显低于他莫昔芬组,提示CUBα可能参与抑制炎症相关因子的形成,抑制肿瘤炎症微环境进而抑制肿瘤发生发展。进一步研究发现,给予不同剂量CUBα后,Na+-K+-ATP酶和Ca2+-Mg2+-ATP 酶活性水平明显提高,并具疗效关系,可能与其具有较强的保护细胞膜、改善细胞稳定性作用有关。
在本研究的12.5~50 mg·kg-1剂量范围内,CUBα能改善模型小鼠肿瘤体征,抑制肿瘤生长,降低雌二醇和孕酮水平,保护SOD、GSH-Px酶活性及减少肺转移。尤其在对改善白细胞计数及脾、胸腺指数、TNF-α和IL-6水平等免疫相关指标的影响上,作用明显且具较明显的量效关系,提示CUBα对DMBA小鼠肿瘤的抑制作用可能与其保护抗炎[5]、保护免疫系统和调节免疫功能有关。进一步研究发现,CUBα剂量相关性提升血液红细胞膜Na+-K+-ATP酶和Ca2+-Mg2+-ATP 酶活性水平,并且中剂量、大剂量效果明显强于5 mg·kg-1他莫昔芬,提示CUBα对肿瘤作用的机制与他莫昔芬不同,可能与其具有较强的保护细胞膜、改善细胞稳定性作用有关,但该现象是否与其调节免疫进而抑制肿瘤的药理作用关联,以及其分子机制如何,尚待进一步研究。
