(围)妊娠期HPV疫苗接种对后代出生缺陷发生风险的影响
2020-10-30汪安石黄演林刘畅王逾男杜丽熊盈赵馨吴菁骆明勇张畅斌
汪安石 黄演林 刘畅 王逾男 杜丽 熊盈 赵馨 吴菁 骆明勇 张畅斌
(广东省妇幼保健院 医学遗传中心,广东 广州 511400)
人乳头瘤病毒(human papilloma virus,HPV)是最常见的性传播病原体之一,其持续感染可导致子宫、阴道、肛门、阴茎、咽喉部的癌前病变和恶性病变[1,2]。许多国家已将预防性HPV疫苗接种纳入国家免疫计划。国家食品药品监督管理局(The China Food and Drug Administration,CFDA)批准二价HPV疫苗的接种人群为9~25岁的女性、四价疫苗为20~45岁女性、九价疫苗为16~26岁女性。而中国第六次人口普查数据显示,我国育龄女性的生育高峰期位于20~34岁[3]。可见,我国女性的生育年龄与CFDA建议的HPV疫苗接种年龄有很大程度重叠,这意味着孕龄女性在接种HPV疫苗期间或临近接种期可能发生计划外怀孕[4]。
由于孕妇及胎儿特殊的生理特点,其免疫状态、药物代谢过程、不良反应等情况均可能与一般人不同,因而孕妇用药及预防性免疫具有一定的特殊性[5]。目前,依据临床试验中意外怀孕数据和上市后监测结果,就HPV疫苗接种期意外怀孕所做出的安全性评估能力十分有限,世界卫生组织及疫苗生产厂商均建议在妊娠期避免HPV疫苗接种,但对妊娠期意外接种者也不建议进行干预[6]。(围)妊娠期接种HPV疫苗的安全性是受到监管单位及广大受种者关注的重要问题,本研究汇总整理了关于(围)妊娠期HPV疫苗接种对后代出生缺陷发生风险影响的数据资料,进行系统评价与荟萃分析,旨在为(围)妊娠期HPV疫苗接种人群的产前咨询提供依据。
1 材料与方法
1.1 数据纳入 根据系统评价与荟萃分析指南的首选报告项目(Preferred Reporting Items for Systematic Reviews and Meta-Analyses,PRISMA)[7]进行文献综述。采用关键词或《医学主题词表》主题词:“human papillomavirus vaccine”, “HPV vaccine”, “pregnancy”, “pregnancy outcome”,“birth defect”或“人类乳头状瘤病毒疫苗”、“HPV疫苗”、“ 妊娠”、“妊娠结局”、“出生缺陷”进行文献检索,检索数据库包括PubMed文献数据库、Cochrane Library数据库、中国知网和万方数据库,检索时限截至2019年10月31日。纳入标准:包含接种HPV疫苗孕妇的原始数据;描述在末次月经前90天至妊娠期间发生的疫苗暴露;包含妊娠结局结局的报告。排除标准:非英语或汉语研究;非对照研究;交叉重复研究。
1.2 数据提取 数据由2名审查员使用标准化数据提取表独立提取,任何不一致处经协商一致或经第三名审查员协商解决。数据收集包括以下信息[8]:研究特征(研究设计、数据源、国家、年份);受检者情况(研究人群、样本量);疫苗使用情况(HPV疫苗类型和暴露时段);对照组情况(包括混杂因素);研究结果(包括研究结果确定及随访时间)。
1.3 偏倚风险评估 使用纽卡斯尔-渥太华质量评估量表(The Newcastle-Ottawa Scale,NOS)评估观察性研究的文献质量[8]。通过三大维度(研究人群选择、可比性、暴露评价或结果评价)共8个条目对文献质量进行星级系统的半量化评估。并使用Jadad量表[9]评估随机对照试验的文献质量,通过随机、双盲、失访等3个条目进行打分评价。本研究采用漏斗图评估文献的发表偏倚。
1.4 统计学分析 采用Review Manager 5.3(Cochrane Collaboration,Oxford,UK)统计软件对文献进行荟萃分析,采用Cochrane Q检验和I2统计量对研究资料进行异质性检验,若Q检验的P>0.10,或I2≤50%,则认为研究间不存在异质性,选择固定效应模型计算合并效应值;反之,则采用随机效应模型计算合并效应值。二分类变量采用相对危险度(risk ration,RR)作为效应量指标,计量资料采用标准化均数差(mean difference,MD),对其结局指标进行荟萃分析。各效应量均以95%置信区间(confidence interal,CI)表达,检验水准为0.05。
2 结果
2.1 文献检索结果 如图1所示,系统搜索总共提供491篇文献,阅读题目和摘要后初筛文献57篇,排除8篇综述和13篇评论,阅读全文复筛后获得文献36篇,最终纳入文献6篇。表1总结了该系统评价中纳入研究的基本特征。
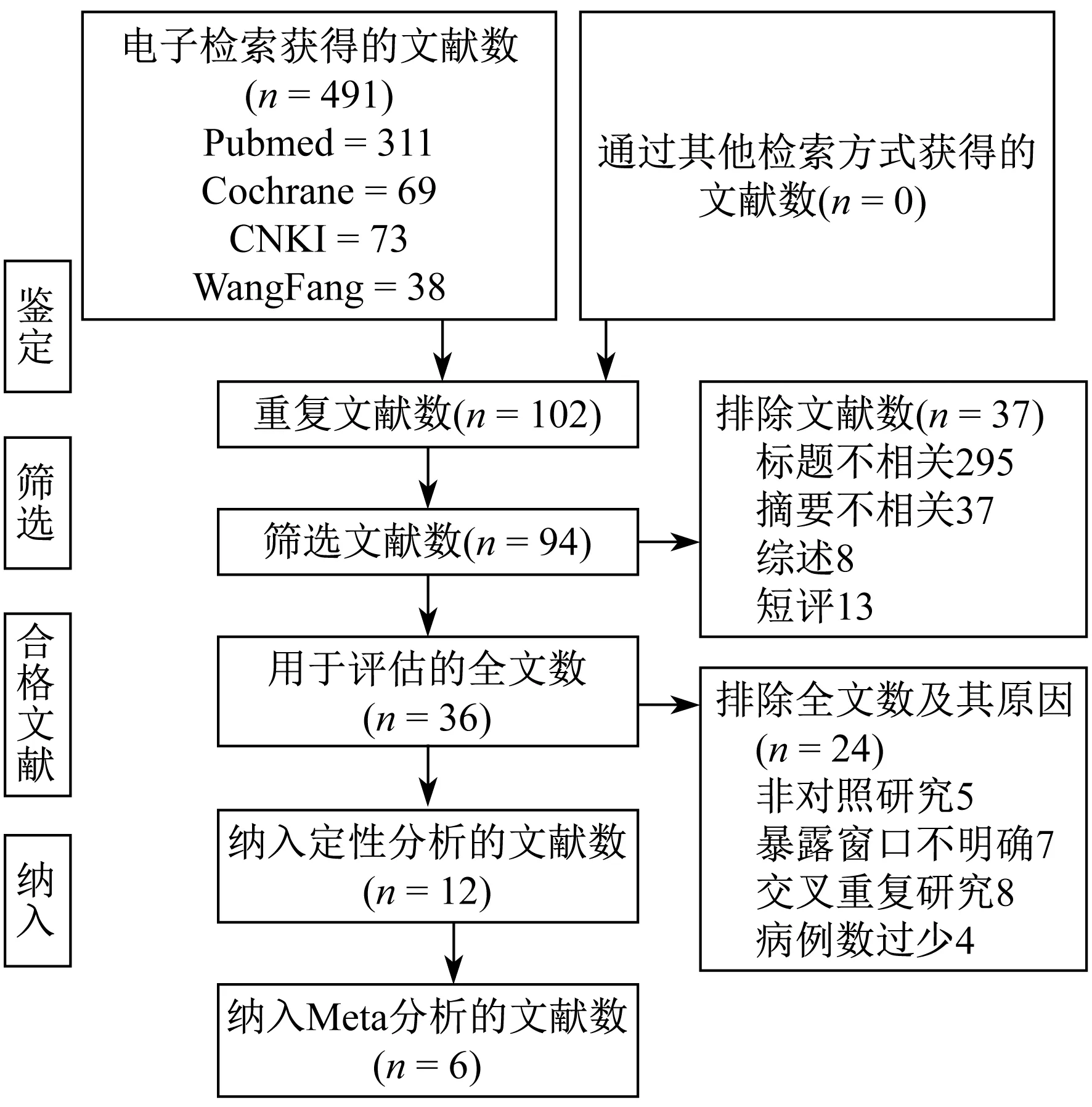
图1 文献筛选流程图
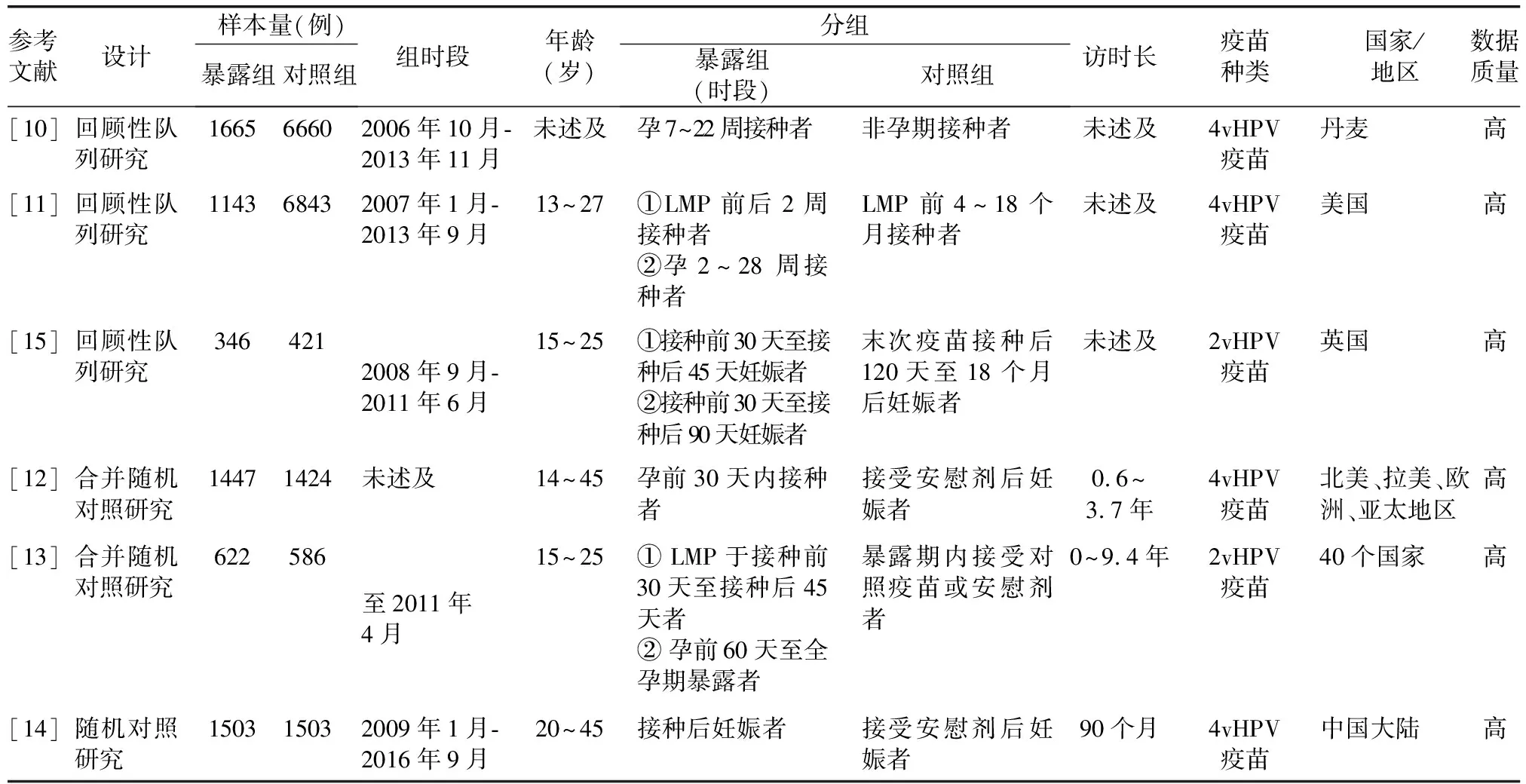
表1 纳入研究的基本特征
2.2 文献质量评价 采用NOS对纳入研究的偏倚风险进行评估。质量评估涉及8个方面:暴露队列的代表性、非暴露队列的选择、暴露的确定、研究开始时没有出现感兴趣的结果、基于设计或分析的队列可比性、结果评估、随访持续时间、队列随访充分性。系统评价中纳入的随机对照试验的方法学质量使用Jadad量表进行评估,以确定每项研究中的偏倚风险。该量表包含描述随机性、盲法设置性和退出与失访等3个项目。
2.3 (围)妊娠期HPV疫苗接种与后代出生缺陷发生风险
2.3.1 (围)妊娠期四价HPV疫苗接种与后代出生缺陷发生风险 6项研究[10-14]报告了(围)妊娠期四价HPV疫苗接种与后代出生缺陷发生风险间的关联。根据(围)妊娠期内HPV疫苗暴露的不同时间窗进行荟萃分析。①妊娠前45天至妊娠结束期间暴露组各研究间无明显异质性(I2=0%,P=0.63),荟萃分析结果显示试验组妊娠前45天至妊娠结束期间接种四价HPV疫苗并未增加出生缺陷发生风险(RR=0.94,95% CI: 0.60-1.48);②妊娠前45天至LMP期间暴露组各研究间无明显异质性(I2=0%,P=0.74),荟萃分析结果显示试验组妊娠前45天至LMP期间接种四价HPV疫苗增加出生缺陷发生风险(RR=1.34,95% CI: 1.01-1.78);③妊娠期间暴露组各研究间无明显异质性(I2=0%,P=0.95),荟萃分析结果显示试验组妊娠期间接种四价HPV疫苗并未增加出生缺陷发生风险(RR=1.18,95% CI: 0.92-1.51)(表2、图2)。
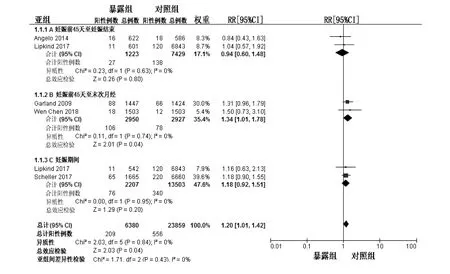
图2 (围)妊娠期HPV疫苗接种对后代出生缺陷发生风险的评估
2.3.2 (围)妊娠期二价HPV疫苗暴露与后代出生缺陷发生风险 仅1项研究[15]报告了(围)妊娠期二价HPV疫苗接种与后代出生缺陷发生风险间的关联[13]。该研究中,妊娠前45天至妊娠结束期间接种二价HPV疫苗并未增加出生缺陷发生风险(RR=0.93,95% CI: 0.49-1.75)(表2)。
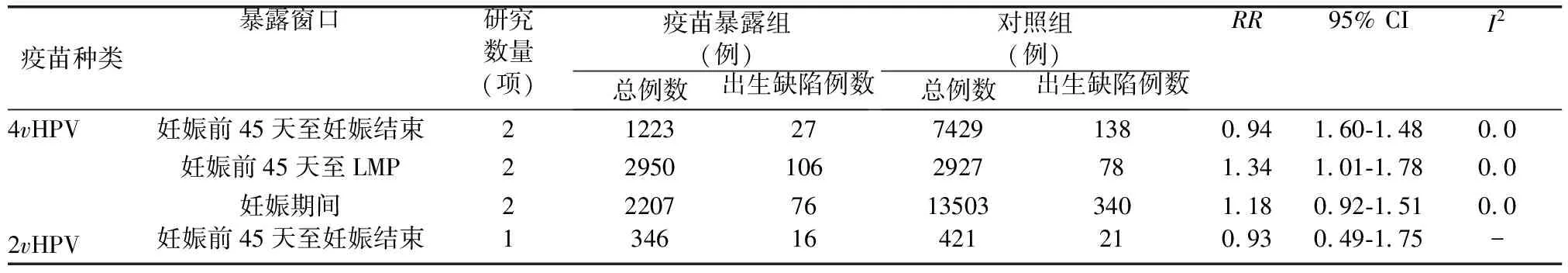
表2 (围)妊娠期HPV疫苗暴露与出生缺陷发生风险的相关性研究
3 讨论

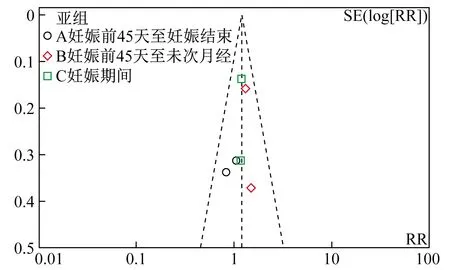
图3 通过漏斗图评估纳入文献的发表偏倚
本研究通过系统评价与荟萃分析对(围)妊娠期接种HPV疫苗的安全性进行了初步评价。但目前研究仍存在一定的局限性。首先,一些基于疫苗安全数据库展开的非对照研究因为无法计算效应值,未被纳入评价;其次,既往研究中大量数据基于HPV疫苗制造商出于监管目的展开的研究,旨在监测HPV疫苗接种后的一般不良反应,而非围绕疫苗接种对妊娠结局的影响展开,因而其中包含一些未对影响妊娠结局的混杂因素做有效控制与调整的小样本量研究[5]。事实上,对母亲吸烟史、饮酒史、药物使用、家族疾病史及既往疾病史等重要因素进行控制和调整,才能有效评估孕期HPV疫苗暴露的安全性[16]。此外,部分研究对(围)妊娠期HPV疫苗接种时间划分模糊,影响评估的客观性和准确性[17]。药物作用时胎儿组织分化程度与发育成熟程度是分析药物毒性效应的重要因素, 暴露窗口的准确划分才能有效评估孕期HPV疫苗暴露的安全性。另外,既往关于(围)妊娠期HPV疫苗接种对后代出生缺陷发生风险影响的研究主要集中于二价疫苗及四价疫苗,而对于九价HPV疫苗接种对妊娠结局影响的研究很少。九价HPV疫苗相较二价、四价疫苗上市较晚,就九价HPV疫苗接种对妊娠结局的影响未得到充分评估。可见,基于既往研究对孕前或孕期意外接种HPV疫苗与后代出生缺陷发生风险的相关性研究尚不充分,仍需进一步全面收集数据、展开研究,对(围)妊娠期接种HPV疫苗的安全性进行更充分地评价。美国免疫接种咨询委员会和世界卫生组织建议使用最新证据审查、推断HPV疫苗接种的公共卫生相关益处,认为其大于潜在危害。
